Молекула воды, построенная из двух атомов водорода и одного атома кислорода, как установлено исследованиями оптических спектров воды в гипотетическом состоянии полного отсутствия движения имеет структуру равнобедренного треугольника, вершину треугольника занимает кислород, а два атома водорода лежат в основании треугольника (рис. 30 а).
|
|
|
|
а) |
б) |
Рис. 30. Геометрическая схема (а) и пространственная электронная структура (б) мономера Н2О
Угол треугольника равен 104,5°, расстояние между кислородом и водородом 0,96 Å. Для ближайшего гомолога воды Н2S угол составляет около 92° (табл. 4.2.1).
Таблица 4.2.1. Длины связей (Н-Э) и углы гомологов воды
|
Наименование параметра |
Н–Э |
|||
|
Молекула |
Н2О |
Н2S |
Н2Se |
Н2Те |
|
Длина связи, 10–8 см |
0,957 |
1,334 |
1,460 |
1,653 |
|
Угол молекулы, град |
104,52 |
92,16 |
90,53 |
90,25 |
В образовании каждой ковалентной связи О-Н участвуют по одному электрону от атомов кислорода и водорода. У кислорода остается одна неподеленная пара электронов, которая в изолированной молекуле воды остается свободной, но при сближении с другими молекулами воды играет важную роль в образовании молекулярной структуры воды, а именно в способности к образованию водородных связей. Водородные связи между молекулами воды возникают в результате специфического распределения в них электронной плотности.
Неподеленные электроны отталкиваются от связей О-Н, поэтому их орбиты сильно вытянуты в сторону, противоположную атомам водорода. Таким образом, в трехмерном пространстве молекулу воды можно изобразить в виде тетраэдра, в центре которого находится атом кислорода, а в двух вершинах – по атому водорода (рис. 29 б). Каждый из протонов может образовывать связь с неподеленным электроном другой молекулы. Первая молекула при этом выступает в качестве акцептора, а вторая донора, образуя водородную связь. Таким образом, молекула воды представляет собой двойной симметричный донор и акцептор, что позволяет ей образовывать водородные связи с соседними молекулами воды с точным балансом числа донорных и акцепторных связей. Электронная структура молекул воды определяет условия их объединения в сложную трехмерную сеть водородных связей, как в воде, так и во льду. Пока молекула воды свободна, электроны, которые не участвуют в образовании связи, располагаются ближе к ядру кислорода, чем связывающие и сильно отталкивают связывающие электроны, при этом угол НОН свободной молекулы около 1040, а при образовании водородных связей угол возрастает до 1090. Водородная связь имеет электростатическую природу. У гомологов воды атомы практически нейтральны, поэтому водородные связи между их молекулами не образуются. Только в системе молекул воды водородные связи полностью определяют геометрию кристаллов и свойства жидкой воды.
Водородные связи вокруг каждой молекулы воды реализуются в кристаллах льда. Схематически структура льда представлена на рис. 31.
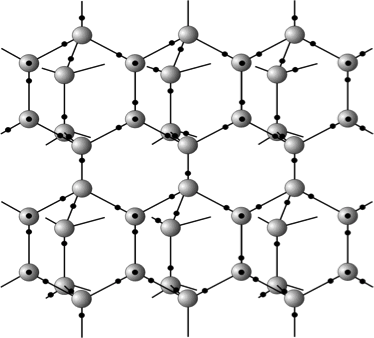
Рис. 31. Гексагональная структура льда Ih
Это так называемый гексагональный лед, который образуется при давлении 1 атм. Получается сетка водородных связей, в узлах сетки находятся молекулы воды, в каждом ее узле сходится четыре связи. Все углы между связями в сетке равны тетраэдрическому углу 1090. Сетка состоит из изогнутых шестичленных колец, поэтому сетка называется гексагональной и вся структура льда обозначается как гексагональный лед (лед Ih). Характерной особенностью структуры льда является рыхлая упаковка в ней молекул. Если бы молекулы воды во льду были плотно упакованы, то его плотность составляла бы 2,0 г/см3, на самом деле она равна 0,92 г/см3. Но рыхлость упаковки не ведет к неустойчивости структуры. При сжатии льда сетка водородных связей не разрушается, а перестраивается, сохраняя свою четверную конфигурацию. Более выгодным оказывается не разорвать некоторые водородные связи, а сохранить их, лишь деформируя сетку, несколько изменяя углы между связями. При повышении давления гексагональный лед Ih меняет свою структуру. При деформации гексагональной сетки плотность увеличивается, а углы между соседними связями отличаются от тетраэдрических. Гексагональный лед обладает минимальной плотностью и наибольшей рыхлостью. По своим электрическим свойствам лед относят к протонным полупроводникам, так как носителями заряда во льду являются неупорядоченные протоны. В кристаллической решетке льда упорядочено расположение атомов кислорода, а по протонам – это неупорядоченная среда.
Гексагональная форма льда является не единственной. Полиморфных форм льда, образуемых при различных давлениях и температурах, насчитывают от 12 до 14. При плавлении льда тетраэдрическая сетка водородных связей не должна разрушаться, но кристаллический порядок нарушается.
Поскольку вода является сложной ассоциированной жидкостью с динамическим характером связей, то описание ее свойств на молекулярном уровне возможно лишь с помощью квантово-механических моделей различной сложности и строгости. Таких моделей достаточно много. В последние годы все больше появляется данных о существовании сетки водородных связей в воде в виде разнообразных структур кластерного типа. Под кластерами понимают кристаллоподобные структуры, которые могут содержать полости. Водные кластеры структурно могут быть подобны кластерам углерода и кремния (фуллерены, алмаз, графит, силикаты). Такое подобие определяется способностью атомов углерода и кремния образовывать по четыре ковалентные связи, а у атома кислорода воды также четыре связи (две ковалентные и 2 водородные). Следует заметить, что углерод – основа всего живого, кремний – основа неживой материи и вода, объединяющая эти два мира, способна образовывать связи тетраэдрической конфигурации.
Имеются квантово-химические расчеты, подтверждающие возможность существования устойчивых водных кластеров, которые, блокируясь друг с другом, могут достичь громадных размеров, включающих в себя 280 и более молекул воды, фактически это полимерные молекулы, построенные из тетраэдрической сетки.
В водных кластерах, как показали квантомеханические расчеты, может происходить миграция протонов по эстафетному механизму, приводящая к делокализации протонов в пределах кластера. Наличие делокализации протонов в пределах кластера способствует стабилизации последнего.
Свойство тетраэдрических сеток водородных связей воды образовывать различные структурные конфигурации проявляется в существовании соединений включения (клатратные гидраты). Это система «гость – хозяин». Простейшая модель – додекаэдр, образованный молекулами воды («хозяин»), в полость которого помещаются небольшие молекулы, например, метан («гость»).
Структура воды позволяет объяснить многочисленные аномальные свойства воды. Резкое увеличение плотности при плавлении льда связано с тем, что сетка водородных связей льда сильно искажается после плавления, углы между связями отклоняются от оптимальных, тетраэдрических, в результате чего уменьшается объем пустого пространства между молекулами воды. Уменьшение плотности при понижении температуры ниже 4 0С определяется перестройкой структуры водной сетки – чем ниже температура, тем ажурнее становится сетка, больше объем пустого пространства. При высоких температурах перестройка структуры сетки мало влияет на плотность, поскольку сетка в этом случае сильно отличается от ажурной, тетраэдрической. Тогда преобладает общее для всех веществ свойство – увеличение расстояния между частицами при нагревании. Аналогично объясняются и другие аномалии воды при низких температурах. Общая причина аномального поведения воды при низких температурах заключается в том, что при этом сетка водородных связей воды не очень искажена по сравнению тетраэдрической конфигурацией и при изменении температуры первостепенное значение имеет перестройка структуры этой сетки, которая и определяет аномальный вклад в поведение наблюдаемого свойства воды. При высоких температурах, когда водная сетка сильно деформирована, ее перестройка оказывает меньшее влияние и вода ведет себя, как все обычные жидкости.
Деформация сетки при изменении температуры требует затрат энергии, что и объясняет аномальный вклад в теплоемкость. Особые свойства сетки водородных связей определяют аномальное поведение не только чистой воды, но и многих ее растворов.



