Порча жиров, или прогоркание, происходит при их хранении и является результатом сложных химических и ферментативных процессов, протекающих в жирах и маслах. Жиры приобретают специфический запах и неприятный вкус, становятся непригодными для употребления. Всю эту гамму процессов можно разделить на два основных направления – гидролиз и окисление. Оба процесса могут иметь как химическую (автокаталитическую), так и ферментативную природу. Ферментативный гидролиз протекает с участием липаз, а ферментативное окисление с участием липооксигеназ. В зависимости от продуктов, образующихся при прогоркании, различают кислотное, альдегидное, кетонное прогоркание и осаливание. Повышение содержания свободных кислот происходит при гидролизе.
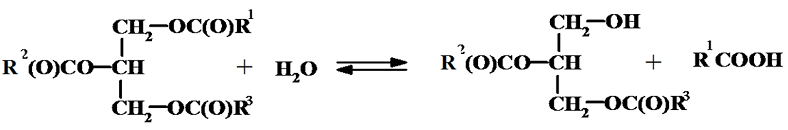
Особенно интенсивно гидролиз протекает в сливочном масле и других животных жирах. Если в состав ацилглицеридов входят ВЖК, то появление этих кислот не сопровождается изменением запаха и вкуса, так как органолептически эти кислоты не отличаются от нейтральных жиров. Если же в состав жиров входят ацилглицериды низших жирных кислот, например таких, как масляная (С4), каприловая (С8), то их образование при гидролизе сопровождается появлением неприятного запаха.
Процессы окисления осуществляются молекулярным кислородом. Глубина и скорость окисления зависит от многих факторов, прежде всего от ненасыщенности жирных кислот. Присутствие в жирах и маслах свободных жирных кислот, особенно ненасыщенных, моно- и диглицеридов ускоряет окисление. Механизм окисления носит гомолитический характер и первоначальными продуктами окисления являются перекисные соединения.
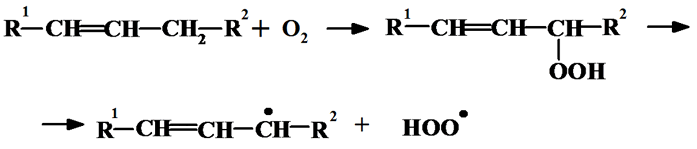
В начале процесса окисления идет медленная химическая реакция (зарождение цепи), с образованием свободных радикалов.
Метиленовая группа, соседняя с двойной связью, более активна в отношении кислорода и легче подвергается окислению с образованием гидроперекисей. Метиленовая группа, находящаяся между двумя изолированными двойными связями, обладает еще большей реакционной способностью в отношении кислорода, чем метиленовая группа, которая находится по соседству с двойной связью мононенасыщенной кислоты. Так, линолевая кислота и ее сложные эфиры поглощают кислород в 10–12 раз быстрее, чем олеиновая кислота и ее сложные эфиры. Линоленовая кислота и ее эфиры примерно в два раза быстрее поглощают кислород, чем линолевая кислота и ее сложные эфиры.
Метиленовые группы насыщенных кислот и их эфиров, хотя и очень медленно, но также способны образовывать гидроперекиси. Окисление начинается с атаки кислородом a- или b-углеродного атома и сопровождается деструкцией углеродной цепи. При комнатной температуре действию кислорода подвергается преимущественно b-углеродный атом. Образующиеся первичные продукты окисления разлагаются по следующей схеме:
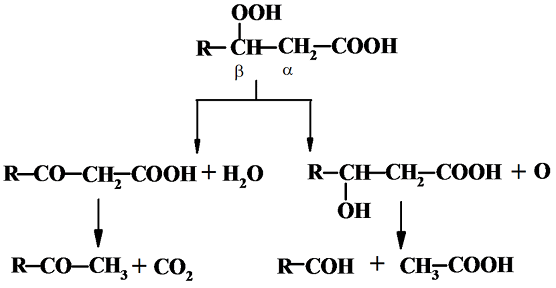
В результате образуются кислоты с меньшим числом углеродных атомов, кетоны и другие кислородсодержащие соединения. Гидропероксиды и свободные радикалы являются высокореакционоспособными соединениями и претерпевают разнообразные сложные превращения с образованием других свободных радикалов и вторичных продуктов окисления, в том числе перекисных радикалов ROO•, эпоксисоединений, а также продуктов полимеризации и поликонденсации.
Для предотвращения окисления жиров и масел требуются ингибиторы, взаимодействующие с перекисными радикалами и прерывающие цепь окисления. Высокой антиокислительной способностью обладают токоферолы. Это природные антиоксиданты. Антиокислительная активность токоферолов определяется главным образом их способностью отдавать фенольный водород свободным радикалам липидов, то есть токоферолы являются донорами водорода. Водородный атом фенольной группы переходит к перекисному (ROO• или оксирадикалам (RO•), которые соответственно превращаются в гидроперекиси или гидроксипроизводные, а токоферолы переходят в стабильные токофероксил-радикалы:
ROO• + Т-OH → ROOH + ТО•
RO• + Т-OH → ROH + ТО•
Токофероксил-радикалы вступают во взаимодействие с другими свободными радикалами с образованием стабильных продуктов:
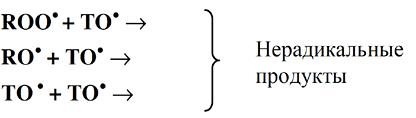
Антиокислительная способность токоферолов убывает в ряду: α > β > γ > δ. α-токоферолы – наиболее реакционноспособный донор водорода.
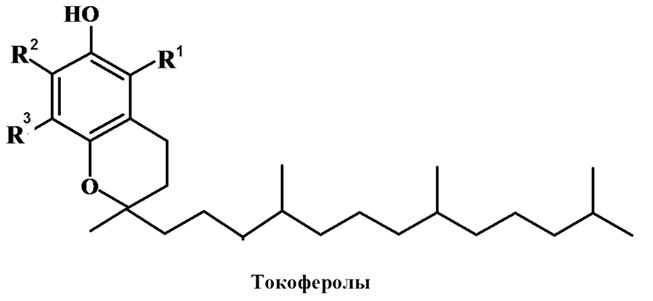
Однако в растительных маслах обычно g-токоферол является более сильным антиоксидантом, чем a-токоферол. Это объясняется тем, что токоферолы могут действовать и как прооксиданты. Так, a-токоферол при взаимодействии с перекисным радикалом ROO• может образовывать перекисный радикал a-токоферол – a-ТОO•, который имеет высокую химическую активность и действует как оксидант. Кроме того, a-ТОO• и g-ТОO• проходят различные пути превращения в стабильные продукты. Превращение a-ТОO• проходит через промежуточное образование алкил-, алкокси- и алкилперекисных радикалов, которые могут действовать как прооксиданты. Превращение g-ТОO• не сопровождается образованием алкил-радикалов, а возникающие при этом продукты не теряют антиоксидантных свойств. Результирующее действие токоферолов определяется суммой разнонаправленных эффектов. На антиокислительные свойства токоферолов влияют: жирнокислотный состав, в том числе степень ненасыщенности ВЖК, структурные свойства, наличие синергистов, температура, свет и другие. Изменение какого-либо параметра может привести к изменению антиокислительных свойств токоферолов.
Состав токоферолов в растительных маслах различен. В подсолнечном масле преобладают a-токоферол (89–94% от суммы токоферолов). В маслах с высокой степенью ненасыщенности (соевое, рапсовое, кукурузное, горчичное и другие) главным компонентом являются g- и d-токоферолы. Е-витаминная активность a-токоферола в 10 раз превышает активность g-токоферола и более чем в 30 раз активность d-токоферола.
К природным антиоксидантам относятся также фосфолипиды. Их антиоксидантная активность обусловлена способностью разрушать гидроперекиси за счет связывания входящего в их состав кислорода, а также металлосвязывающей активностью. Добавление к растительным маслам хорошо высушенных фосфолипидов предохраняет их от окисления и повышает их пищевую ценность. К природным антиоксидантам относят ряд кислот (по убыванию активности): кофейная, феруловая, кумаровая, ванилиновая, коричная. Однако их антиокислительная способность много ниже активности α-токоферолов. В последнее время в качестве антиоксидантов находят применение растительные экстракты, в частности выделенные из зеленого чая, сезамол (из кунжутного масла), госсипол (из хлопкового масла), дегидрокверцетин (из коры лиственницы).
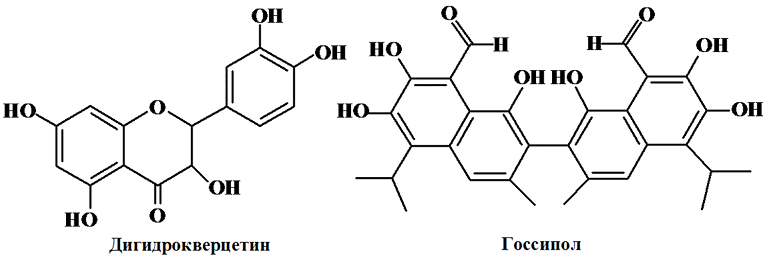
В пищевой промышленности для стабилизации жировой фазы наряду с природными антиокислителями (токоферолы, сезамол, кверцитины и др.) находят применение различные синтетические антиоксиданты, среди которых наибольшее распространение имеют пропил-, октил- и додецилгаллаты (Е310–312), трет-бутилгидрохинон (ТБГХ, Е-319), бутилоксианизол (БОА, Е-320), бутилгидрокситолуол (БОТ, или ионол, Е-321).
Галлаты представляют собой сложные эфиры галловой кислоты и соответствующего спирта с общей формулой:
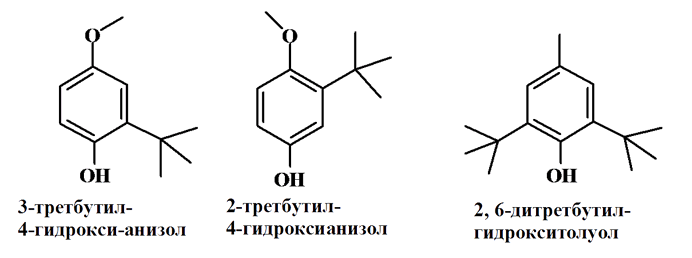
Бутилоксианизол (БОА) – это смесь двух изомеров: 2-третбутил-4-гидроксианизола и 3-третбутил-4-гидроксианизола, последний отличается большей антиокислительной активностью. Бутилгидрокситолуол (2,6-дитретбутилгидрокситолуол, БОТ) – один из самых распространенных синтетических антиоксидантов, используется для стабилизации пищевых жиров.
Перечисленные синтетические антиоксиданты являются производными фенола и обладают токсическими свойствами, поэтому их эффективная концентрация не должна превышать токсический уровень. Токсическая доза (мг/кг веса крысы): для бутилгидроксианизола – 1000, бутилгидрокситолуола – 500, пропилгаллата – 500. Содержание синтетических антиоксидантов в жирах и пищевых продуктах на их основе составляет в среднем 10–20 мг%, предельное содержание индивидуального антиоксиданта не должно быть превышено (табл. 1.5.1).
Таблица 1.5.1. Допустимое содержание антиоксидантов в пищевых продуктах
|
Наименование антиоксиданта |
Максимальное содержание, мг% |
|
Пропилгаллат |
10,0 |
|
Бутилгидроксианизол |
17,5 |
|
Бутилгидрокситолуол |
7,5 |
|
Третбутилгидрохинон |
12,0 |
|
Смесь антиоксидантов |
≤ 20,0 |
В масложировой промышленности используют не индивидуальные антиоксиданты, а смеси, приготовленные таким образом, чтобы действие одного антиоксиданта дополняло или усиливало действие другого. Часто природные антиоксиданты используют в смеси с синтетическими антиоксидантами и с добавлением синергистов, которые не обладают заметными антиокислительными свойствами, но усиливают их ингибирующее действие. В качестве синергистов применяют лимонную и аскорбиновую кислоты и их производные.
АНАЛИТИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ ОКИСЛЕННОСТИ ЖИРОВ
Порча жира при хранении сопровождается сложными химическими изменениями в нем. Жиры приобретают специфический запах и раздражающий вкус. Это связано с накоплением низкомолекулярных летучих, нелетучих соединений (альдегидов, кетонов, низкомолекулярных кислот, оксисоединений, гидроперекисей и пероксидов).
Процессу окисления способствует накопление свободных жирных кислот, которые легче окисляются, чем жиры. Благоприятным условием для гидролиза жиров является присутствие активных липаз и воды. По этой причине особенно интенсивно гидролиз жиров протекает в сливочном масле и различных видах животной жировой ткани. В нерафинированных растительных маслах, полученных холодным прессованием, всегда содержатся липазы, поэтому такие масла легко подвергаются гидролизу при хранении. Липазы и необходимая для гидролиза вода находятся в осадке (нежировом комплексе), который при хранении масла долго присутствует в виде мути и со временем выпадает в осадок. Рафинация масла позволяет повысить устойчивость его к гидролизу.
На первой стадии окисления образуются пероксиды. Содержание пероксидов обычно невысоко, так как они быстро превращаются в продукты, не содержащие пероксидного кислорода. Концентрацию пероксидных соединений в жирах следует контролировать, в связи с их токсичностью. Они способны разрушать жирорастворимые витамины и полиненасыщенные жирные кислоты. Первичные продукты неглубокого окисления липидов образуют плохо усваиваемые организмом комплексные соединения с аминокислотами, снижая тем самым пищевую ценность молочного жира.
Образующиеся на начальной стадии окисления пероксиды в дальнейшем превращаются во вторичные продукты – многочисленные насыщенные и ненасыщенные альдегиды и кетоны, которые являются термостабильными продуктами окисления. Так, например, при извлечении и последующей очистке масел происходит накопление карбонильных соединений.
Для определения степени окисленности жиров согласно ГОСТу 1129–93 (на подсолнечное масло) используют показатель «Перекисное число», характеризующее содержание первичных продуктов окисления, показатель «Анизидиновое число» – вторичных продуктов окисления.
В процессе рафинации перекисное число падает, а анизидиновое растет, поэтому в качестве показателя общей окисленности триацилглицеридов используют показатель totox, учитывающий прекисное и анизидиновое числа. Оптимальной величиной показателей, характеризующих степень окисленности рафинированных дезодорированных подсолнечных масел, обеспечивающих стабильность к окислению, хорошие органолептические свойства и позволяющих отнести данные масла к маслам высокого качества, являются следующие показатели:
§перекисное число – не более 3 ммоль активного кислорода /кг;
§анизидиновое число – не более 7 у. е.;
§totox – не более 15.
§Totox = 2× ПЧ + АЧ.
МЕТОДЫ ОПРЕДЕЛЕНИЯ СТОЙКОСТИ ЖИРОВ К ОКИСЛЕНИЮ
В процессе переработки и хранения пищевые продукты, содержащие в своем составе жиры, подвергаются окислению кислородом воздуха, что ведет к снижению их пищевой ценности, ухудшению органолептических свойств и уменьшению срока годности готовой продукции.
На устойчивость жиров к окислению оказывает существенное влияние не только наличие ПНЖК, но и целый ряд факторов, таких как влажность продукта, термическая обработка, свободный доступ кислорода, присутствие ионов тяжелых металлов, степень очистки от посторонних примесей и других.
Процессы окисления начинаются с образования гидропероксидов, накопление которых идет сначала очень медленно, но со временем скорость их накопления резко возрастает. В некоторых случаях при достижении определенного содержания перекисных соединений наблюдается снижение их количества, что объясняется преобладанием скорости распада перекисей над скоростью их накопления. Скорость накопления перекисных соединений можно увеличить за счет повышения температуры, облучения, продувания воздухом.
Начальный период окисления, в течение которого скорость накопления перекисей очень мала, называется индукционным. Индукционный период – промежуток времени между моментом, когда проба анализируемого жира достигает заданной температуры, и моментом, когда начинает быстро возрастать скорость образования продуктов окисления. По продолжительности индукционного периода, выраженного в единицах времени, судят о стойкости жиров к окислению.
Разработано несколько методов определения устойчивости к окислению жиров. Они основаны на измерении скорости абсорбции кислорода жирами при пропускании воздуха и различаются по способу измерения скорости абсорбции кислорода.
При прямом измерении абсорбции кислорода процесс окисления ведут в два этапа. Первый этап – индукционный период, характеризующийся медленной абсорбцией кислорода и накоплением перекисей. Второй этап характеризуется быстрой абсорбцией, когда перекиси не только образуются, но и диссоциируют под действием высоких температур до вторичных продуктов окисления.
МЕТОДЫ ОПРЕДЕЛЕНИЯ АНТИОКИСЛИТЕЛЕЙ
Для количественного определения антиоксидантов в жирах используют спектрофотометрический и фотоколориметрический методы в водноспиртовой среде.
Экстракция антиоксидантов из жиров основана на различной их растворимости в воде, водном растворе спирта, петролейном эфире, гексане, гептане и циклогексане. Бутилокситолуол выделяют из жиров посредством перегонки с острым паром или хроматографического разделения.

