Характерной особенностью рибофлавина является его высокая фотолабильность. В воде он претерпевает фотохимические превращения в зависимости от рН среды. При УФ-облучении щелочного раствора рибофлавина образуются частично люмихром, а в основном люмифлавин, обладающий флуоресценцией.
В основе люмифлавиного метода лежит реакция фотолиза витамина В2 в щелочной среде по рибитиловой цепи с образование люмифлавина и последующее измерение интенсивности флуоресценции последнего после извлечения его хлороформом.
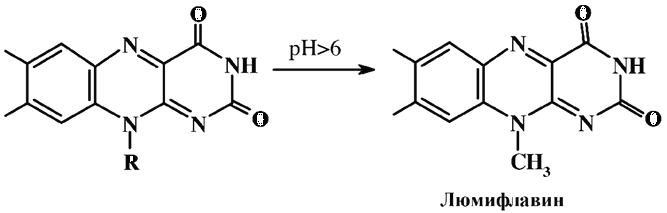
Образующийся люмифлавин имеет желтую окраску и флуоресцирует в той же области, что и рибофлавин, но с большей интенсивностью при 510–650 нм. Но в отличие от рибофлавина люмифлавин хорошо растворим в хлороформе, и его раствор имеет голубую флуоресценцию в области 350–380 нм. Метод анализа витамина В2 стандартизирован (ГОСТ–30627.6–98 «Продукты молочные для детского питания. Методы измерения массовой доли витамина В2 (рибофлавина)»).
Ход анализа. В плоскодонной колбе вместимостью 250 мл растворить навеску анализируемого продукта (около 5 г) в 150 мл 0,1 н раствора соляной кислоты. По окончании кислотного гидролиза провести ферментативный гидролиз по методике, описанной ранее (см. Метод прямого флуорометрирования рибофлавина).
Окисление примесей. В две плоскодонные конические колбы отмерить отфильтрованные гидролизаты: в одну – 100 мл анализируемого образца, в другую – 100 мл холостого опыта (см. Метод прямого флуорометрирования рибофлавина). В каждую прилить по 2 мл 30%-го раствора серной кислоты и по каплям добавить 3%-ный раствор перманганата калия до появления малинового окрашивания, не исчезающего в течение 20 с. Спустя 1 минуту для удаления избытка внесенного перманганата калия, прилить по каплям 3%-ный раствор пероксида водорода до обесцвечивания раствора. Объем, израсходованный на окисление примесей, приплюсовать к первоначально взятому объему фильтратов (объем фильтрата после окисления).
Оба раствора количественно перенести в делительные воронки и к каждому добавить по 30–50 мл хлороформа. Воронки закрыть пробкой, осторожно встряхнуть, избегая образования эмульсии. Продолжить встряхивание в течение 1 минуты. Закрепить делительные воронку в штативе, дождаться расслоения растворов и отделить верхний слой (водный). Нижний слой (хлороформа) не использовать.
Фотолиз. В четыре конические колбы со шлифом (вместимостью 100 мл) отмерить по 20 мл анализируемой пробы после удаления примесей. В две из них добавить по 2 мл рабочего раствора рибофлавина (1 мкг/мл). В пятую колбу отмерить 20 мл холостого опыта. Во все пять колб добавить по 4 мл 28%-го раствора гидроксида натрия, перемешать и закрыть пробками. Полученные растворы облучить светом лампы мощностью 100 Вт с расстояния от источника света 30 см, температура образцов при этом не должна превышать 20 оС.
Сразу после фотолиза смесь нейтрализовать, а образовавшийся люмифлавин экстрагировать хлороформом. Для этого во все колбы добавить по 4 мл ледяной уксусной кислоты, а затем по 20 мл хлороформа. Закрыть колбы пробками и встряхнуть (в течение 2 минут), избегая образования эмульсии. Растворы перенести в делительные воронки, дождаться расслоения жидкостей и отделить нижний слой (хлороформа). Полученные экстракты хлороформа собрать в плоскодонные колбы, добавить к каждому осушитель (20–30 г прокаленного сульфата магния), а спустя час осушитель отфильтровать на воронке Шотта.
Измерение интенсивности флуоресценции люмифлавина. Измерить флуоресценцию во всех пяти экстрактах хлороформа на флуорометре со светофильтрами, используемыми для витамина В2 и имеющими максимум пропускания в области 350–480 нм (В2 – первичный) и 510–650 нм (В2 – вторичный). Длина волны первичного облучения – 369 нм, вторичного излучения – 520 нм. Массовую долю витамина В2 (СВ2, млн–1) рассчитать по формуле
где А – среднеарифметическое значение показаний флуорометра для анализируемого образца без добавления рабочего раствора рибофлавина;
АХ – среднеарифметическое значение показаний флуорометра для холостого опыта на реактивы;
АР – среднеарифметическое значение показаний флуорометра для анализируемого образца с добавлением рабочего раствора рибофлавина;
m – масса навески анализируемого продукта, г;
mД – масса, внесенного витамина В2, в виде рабочего раствора, 2 мкг;
V – общий объем гидролизата, 250 мл;
V1 – объем фильтрата после окисления (с учетом реагентов, использованных на окисление примесей), мл;
V2 – объем гидролизата, взятого на окисление, 20 мл.
V3 – объем гидролизата, взятого на облучение, 20 мл.
Основной раствор рибофлавина (20 мкг/мл). Точную навеску кристаллического рибофлавина (0,02 г) растворить в мерной колбе вместимостью 1000 мл в 750 мл дистиллированной воды и 1 мл ледяной уксусной кислоты при небольшом нагревании на водяной бане. После полного растворения рибофлавина раствор охладить до комнатной температуры и довести объем до метки дистиллированной водой. Полученный раствор перелить в склянку из темного стекла. Срок хранения раствора в холодильнике не более двух месяцев.
Рабочий раствор рибофлавина (1 мкг/мл). В мерную колбу вместимостью 100 мл отмерить 5 мл основного раствора рибофлавина и довести объем раствора до метки дистиллированной водой.
Насыщенный раствор уксуснокислого натрия. В мерной колбе вместимостью 500 мл растворить 20 г уксуснокислого натрия (СН3СООNa× 3Н2О) в 200 мл дистиллированной воды и довести объем до метки.
3%-ный раствор пероксида водорода. В мерную колбу вместимостью 100 мл отмерить 10 мл 30%-го раствора пероксида водорода и довести объем раствора до метки дистиллированной водой.
30%-ный раствор серной кислоты. В фарфоровом стакане растворить 170 мл концентрированной серной кислоты (r=1,84 г/мл) в 500 мл дистиллированной воды при перемешивании. Раствор охладить до комнатной температуры и количественно перенести в мерную колбу вместимостью 1000 мл. Довести объем раствора до метки дистиллированной водой.

