Ранее используемые биологические методы со временем были вытеснены химическими вследствие простоты, большей чувствительности, селективности и воспроизводимости последних. Многие успешно используемые сегодня методы анализа основаны на применении высокоэффективной жидкостной хроматографии. Однако возможности этих методов применения ограничены относительно низкой чувствительностью обнаружения дегидроаскорбиновой кислоты в присутствии L-аскорбиновой кислоты, что значительно затрудняет количественное определение дегидроаскорбиновой кислоты в животных и растительных тканях.
Витамина С встречается в животных и растительных тканях, как в свободной, так и окисленной формах – в виде обратимо окисленной формы дегидро-L-аскорбиновой кислоты, обладающей витаминной активностью. Лактоновое кольцо ДАК легко гидролизуется с образованием кислоты с открытой цепью – ДКГК, не обладающей витаминной активностью.
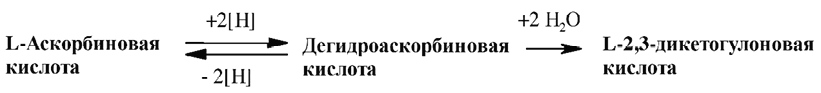
Соотношение между окисленной и восстановленной формами лежит в широких пределах. Например, в крови присутствует только L-аскорбиновая кислота, в то время как в печени содержится 27%, а в мышцах 50% ДАК от общего количества витамина С. В растениях до 70% АК находится в связанном состоянии.
ДАК в отличие от АК не дает качественной реакции с 2, 6-дихлорфенолиндофенолом, поэтому результаты анализа получаются заниженными. В процессе технологической обработки доля ДАК в пищевых продуктах возрастает. Соотношение АК:ДАК в пищевых продуктах, подвергнутых измельчению, длительной тепловой обработке и хранению, в среднем составляет 1:1, в консервированных продуктах – 1:2.
Арбитражный метод определения витамина С (ГОСТ 7047–55. – Витамины А, С, Д, В1, В2 и РР. Отбор проб, методы определения витаминов и испытания качества витаминных препаратов»), предполагающий стадию восстановление ДАК сероводородом до АК, сложен в исполнении и требует специального оборудования. В литературе описаны и другие методы, например, для восстановления ДАК до АК применяют гомоцистеин (2-амино-4-меркапто-бутановая кислота). Метод основан на способности гомоцистеина восстанавливать ДАК до АК при рН 7. Присутствие гомоцистеина не мешает использованию 2, 6-дихлорфенол-индофенола.
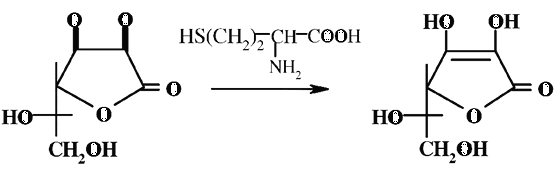
Содержание ДАК определяют по разности между определениями аскорбиновой кислоты с добавлением и без добавления гомоцистеина.
Ход анализа. Точную навеску (5–10 г) анализируемого продукта растереть в фарфоровой ступке с 10 мл 3%-го раствора метафосфорной кислоты. Полученную смесь без потерь перенести в мерную колбу вместимостью 100 мл, несколько раз омыв ступку раствором метафосфорной кислотой. Довести объем экстракта до метки 3%-ным раствором метафосфорной кислоты. Полученную смесь выдержать 5–10 минут, тщательно перемешать и отфильтровать через бумажный фильтр. Фильтрат в дальнейшем использовать для определения аскорбиновой кислоты.
Определение восстановленной формы витамина С. В пробирку отобрать 3 мл отфильтрованного экстракта, добавить 3 мл дистиллированной воды, 4 мл фосфатно-цитратного буферного раствора и 4 мл раствора 2, 6-дихлорфенолиндофенола (титр 0,02 мг по аскорбиновой кислоте). Раствор перемешать и колориметрировать при длине волны 530 нм в кювете с длиной оптического пути 10 мм. В качестве раствора сравнения использовать раствор, приготовленный по выше описанной схеме, заменив экстракт на 3%-ный раствор метафосфорной кислоты. Концентрацию АК (САК, мкг/мл) в анализируемом образце без восстановления ДАК найти по калибровочному графику. Массовую долю восстановленной формы витамина С (САК, мг %) рассчитать по формуле
где 0,02 – титр раствора 2, 6-дихлорфенолиндофенола по аскорбиновой кислоте, мг/мл;
V1 – объем раствора 2, 6-дихлорфенолиндофенола, 4 мл;
V2 – общий объем экстракта, 100 мл;
V3 – объем экстракта, взятого на восстановление гомоцистеином, 3 мл;
m – масса навески исследуемого материала, г.
Определение окисленной формы витамина С. Отмерить в пробирку 3 мл отфильтрованного экстракта, 2 мл 0,2%-го (2 мг/мл) раствора гомоцистеина. Для нейтрализации экстракта медленно прилить заранее определенный объем 45% раствора двузамещенного фосфата калия до достижения рН 6,8. Пробирку с раствором термостатировать при температуре 37 0С. Через 20–25 минут нейтрализованный экстракт быстро охладить до комнатной температуры, прилить 4 мл фосфатно-цитратного буфера (рН 2,3) и 4 мл раствора 2, 6-дихлорфенолиндофенола (титр 0,02 мг по аскорбиновой кислоте). Окрашенный раствор колориметрировать при длине волны 530 нм в кювете с длиной оптического пути 10 мм относительно раствора сравнения.
По величине оптической плотности анализируемого раствора с использованием калибровочного графика найти суммарную концентрацию АК и ДАК. Массовую долю суммы кислот, обладающих С витаминной активностью (САК+ДАК, мг %), рассчитать по формуле
где 0,02 – титр раствора 2, 6-дихлорфенолиндофенола по аскорбиновой кислоте, мг/мл;
V1 – объем раствора 2, 6-дихлорфенолиндофенола, мл;
V2 – общий объем экстракта, 100 мл;
V3 – объем экстракта, взятого на восстановление гомоцистеином, мл;
m – масса навески исследуемого материала, г;
2 – коэффициент, учитывающий разбавление анализируемого раствора в процессе восстановления ДАК до АК.
Массовую долю дегидроаскорбиновой кислоты (СДАК, мг %) определить по разности:
СДАК= САК+ДАК – САК .
Построение калибровочного графика. На основе рабочего раствора аскорбиновой кислоты (0,1 мг/мл) путем последовательных разбавлений приготовить растворы с концентрацией 1–10 мкг/мл (табл. 2.2.3). В градуированные пробирки отобрать по 3 мл калибровочных растворов, добавить в каждую по 3 мл дистиллированной воды, 4 мл фосфатно-цитратного буферного раствора и 4 мл раствора 2, 6-дихлорфенол-индофенола (титр 0,02 мг по аскорбиновой кислоте). Растворы перемешать и колориметрировать при длине волны 530 нм в кювете с длиной оптического пути 10 мм.
В качестве раствора сравнения использовать раствор, приготовленный аналогичным образом, заменив раствор аскорбиновой кислоты на раствор метафосфорной кислоты. Для этого к 3 мл 3%-го раствора метафосфорной кислоты добавить 3 мл дистиллированной воды, 4 мл фосфатно-цитратного буферного раствора и 4 мл раствора 2, 6-дихлор-фенолиндофенола (титр 0,02 мг по аскорбиновой кислоте).
На основе полученных данных построить калибровочный график в координатах: оптическая плотность (А530) – содержание аскорбиновой кислоты (СС, мкг/мл).
|
Необходимые реактивы, посуда, оборудование: §0,2%-ный раствор гомоцистеина (С4Н9О2NS), раствор 2,6-дихлорфенол-индофенола (титр 0,02 мг по АК), фосфатно-цитратный буферный раствор с рН 2,3; 3%-ный раствор метофосфорной кислоты, 45%-ный раствор двузамещенного фосфата калия (К2НРО4), стандартный раствор аскорбиновой кислоты (0,1%), 0,02% спиртовой раствор бромтиомолового синего (на 20%-ном растворе этилового спирта); §фарфоровые ступки с пестиком, мерные колбы вместимостью 100 мл, воронки, пробирки, фотоколориметрические кюветы с длиной оптического пути 10 мм; §аналитические весы, термостат (с температурой 37 оС), ледяная баня, фотоколориметр (λ=530 нм). |
Фосфатно-цитратный буфер рН 2,3. Смешать 8,2 мл 0,2 М раствора двузамещенного фосфата натрия (Na2HPO4· 2H2O) с 191,2 мл 0,1 М раствора лимонной кислоты (С6Н8О7·Н2О).
Раствор 2,6-дихлорфенолиндофенола (титр 0,02 мг АК). Разбавить раствор 2,6-дихлорфенолиндофенола с титром 0,088 мг АК (0,01 н) в 4,4 раза. Для этого 23 мл 0,01 н раствора 2,6-дихлорфенолиндофенола внести в мерную колбу вместимостью 100 мл и довести объем до метки дистиллированной водой.
Определение объема 45%-го раствора фосфата калия для нейтрализации кислого экстракта. К 3 мл экстракта, приготовленного на 3%-ном растворе метафосфорной кислоты, в присутствии 0,02%-го спиртового раствора бромтимолового синего, добавить по каплям 45%-ный раствор фосфата калия до появления синего окрашивания. Полученный объем насыщенного раствора фосфата калия добавить к экстракту витамина С в анализируемой пробе для создания рН 6,8 при восстановлении ДАК до АК с помощью цистеина.

