Перекисное число служит количественным показателем присутствия первичных продуктов окисления перекисей и гидроперекисей, то есть окислительных изменений, происходящих в жирах. По величине перекисного числа можно судить только о начальной стадии окисления липидов, на которой образуются пероксиды и гидропероксиды, существенно не влияющие на органолептические свойства жира. По величине перекисного числа можно судить о свежести жира задолго до появления неприятного вкуса и запаха.
Для определения перекисного числа используют различные методы анализа: физические, например полярографический, или химические (йодометрический, железороданидный). Наибольшее распространение получил йодометрический метод, основанный на взаимодействии активного перекисного или гидроперекисного кислорода с йодистоводородной кислотой:
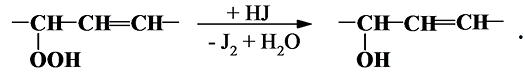
Содержание перекисей, или так называемое перекисное число, принято выражать количеством миллиграмм йода, выделенного перекисями из 100 г жира (в процентах) или в миллимолях активного кислорода на килограмм жира (ммоль активного кислорода/кг). В табл. 1.5.2 приведены коэффициенты перевода перекисного числа, выраженного в процентах, в другие единицы.
Таблица 1.5.2. Единицы измерения перекисных чисел
|
Единица измерения перекисного числа |
Коэффициент пересчета ПЧ, выраженного в процентах |
|
Процент йода (на 100 г жира) |
1 |
|
Миллиэквивалент активного кислорода перекисей (на 1000 г жира) |
78 |
|
Миллимоль активного кислорода перекисей (на 1000 г жира) |
39 |
Перекисное число не должно превышать 10 ммоль активного кислорода/кг для пищевых нерафинированных растительных масел и 2 ммоль активного кислорода/кг для рафинированных дезодорированных масел марки премиум, высшего сорта и предназначенных для детского питания (ГОСТ Р 52465–2005. Масло подсолнечное. Технические условия). Согласно международным стандартам ISO3960–1977 перекисное число в дезодорированном масле сразу после дезодорации не должно превышать 0,5 ммоль активного кислорода/кг. В табл. 1.5.3 приведены данные зависимости степени окисленности жира от величины перекисного числа.
Таблица 1.5.3. Зависимость степени окислительной порчи жира от перекисного числа
|
Перекисное число |
Степень порчи жира |
|
|
мг I2/100 г |
ммоль активного кислорода /кг |
|
|
до 0,03 |
3 |
Свежий |
|
0,03–0,06 |
3–5 |
Свежий, но не подлежит хранению |
|
0,06–0,10 |
5–8 |
Сомнительной свежести |
|
более 0,10 |
8 |
Испорченный |
Жир от охлажденных и замороженных тушек всех видов птицы считают свежим, если значение перекисного числа не превышает 0,01 мг I2/100 г; куриный жир от охлажденных тушек с перекисным числом 0,01–0,04 мг I2/100 г, гусиный, утиный, индюшиный – 0,01–0,10 мг I2/100 г; жир от замороженных тушек всех видов птицы с перекисным числом 0,01–0,03 мг I2/100 г считают сомнительной свежести, при превышении указанных значений жир птицы считается несвежим.
Титриметрический метод
Титриметрический метод определения перекисного числа основан на способности пероксидов окислять йодистоводородную кислоту с выделением свободного йода. Йодистоводородная кислота образуется в результате реакции йодида калия и уксусной кислоты:
KJ + CH3COOH → HJ + CH3COOK.
Если жир не содержит перекисных соединений, то свободный йод не выделяется в течение 3–5 минут. По истечении этого времени выделение свободного йода становится заметным вследствие окисления йодистоводородной кислоты кислородом воздуха. Выделившийся йод оттитровывают тиосульфатом натрия:
4 HJ + O2 → 2J2 + 2H2O
Если выделение свободного йода происходит сразу же после добавления к раствору жира уксусной кислоты и йодида калия, то это свидетельствует о присутствии перекисных соединений в жире.
Ход анализа. На аналитических весах в колбу с пришлифованной пробкой взвесить навеску жира на аналитических весах. Масса навески исследуемого жира зависит от степени его окисленности (табл. 1.5.4).
Таблица 1.5.4. Зависимость массы навески исследуемого жира от величины перекисного числа
|
Значение перекисного числа |
Масса навески, г |
|
|
ммоль активного кислорода/кг |
мг I2/100 г |
|
|
до 6,0 6,0–10,0 10,0–15,0 15,0–25,0 25,0–40,0 |
до 0,07 0,07–0,13 0,13–0,20 0,20–0,32 0,32–0,50 |
2,0–5,0 1,2–2,0 0,6–1,2 0,5–0,6 0,3–0,5 |
Твердый жир расплавить на водяной бане. По стенке, смывая следы жира, прилить 10 мл спирта этилового (или 10 мл хлороформа) и 15 мл ледяной уксусной кислоты. Затем внести 1 мл свежеприготовленного 50%-го раствора йодида калия. Смесь тщательно перемешать, закрыть пробкой и оставить в темном месте при температуре 15–25 оС. В случае расслоения реакционной смеси необходимо добавить растворителя.
Спустя 3 минуты в колбу влить 75 мл дистиллированной воды, в которую заранее добавить 5 капель 1%-го раствора крахмала, до появления фиолетово-синей окраски. Выделившийся йод оттитровать 0,01 н раствором тиосульфата натрия до молочно-белой окраски, устойчивой в течение 5 с (опыт).
Контрольный опыт проводят параллельно, вместо жира внести 1 мл воды. К 10 мл спирта (или 10 мл хлороформа) и 15 мл ледяной уксусной кислоты добавить 1 мл 50%-го раствора йодида калия, 75 мл воды, в которую заранее добавить 5 капель 1%-го раствора крахмала, и оттитровать полученную смесь 0,01 н раствором тиосульфата натрия. Если на контрольное измерение идет более 0,1 мл 0,01 н раствора тиосульфата натрия, то необходимо проверить реактив.
Перекисное число (ПЧ, г/100 г) анализируемого жира рассчитать по формуле:
где Vо – объем 0,01 н раствора тиосульфата натрия, израсходованного на титрование опытного образца, мл;
Vк – объем 0,01 н раствора тиосульфата натрия, израсходованного на титрование контрольного образца, мл;
0,001269 – титр 0,01 н раствора тиосульфата натрия, г/мл;
100 – коэффициент пересчета на 100 г анализируемого жира;
m – масса исследуемого жира, г.
Перекисное число (ПЧ, ммоль ½О/кг) жира рассчитать по формуле:
где 0,01 – концентрация раствора тиосульфата натрия, ммоль/мл;
1000 – коэффициент пересчета на килограмм.
Для пересчета перекисного числа в единицах ммоль активного кислорода/кг (ПЧО) необходимо величину перекисного числа, выраженную в процентах (ПЧI), умножить на коэффициент – 78.
ПЧО = 78×ПЧI
|
Необходимые реактивы, посуда, оборудование: §1%-ный раствор крахмала (индикатор), 0,1 н раствор йода, 0,1 н, 0,01 н растворы тиосульфата натрия, хлороформ, ледяная уксусная кислота, диэтиловый эфир, 50%-ный раствор йодида калия; §колбы для титрования с пришлифованными пробками (250 мл); пипетки, бюретки, мерные цилиндры; §водяная баня, аналитические весы. |
Раствор йодида калия (50%) для определения перекисного числа. В мерном стаканчике на 150 мл взвесить 50–55 г йодида калия и добавить 50–55 мл дистиллированной воды. Использовать свежеприготовленный раствор, хранить в темной посуде. Для проверки перед анализом к 0,5 мл раствора йодида калия добавить 30 мл уксусной кислоты и хлороформа в соотношении 3:2 и две капли 0,5%-го раствора крахмала. В случае появления голубой окраски, которая обесцвечивается при добавлении более чем одной капли 0,01 н раствора тиосульфата натрия, раствор йодида калия готовят заново.
Раствор крахмала (индикатор). Навеску растворимого крахмала (0,5 г) развести в 5 мл воды и добавить к 100 мл кипящей воды. Кипятить в течение 3 минут. Полученный раствор должен быть прозрачным, слегка опалисцирующим. Раствор крахмала хранить в холодильнике, перед употреблением прогреть на кипящей водяной бане.
Колориметрический метод
Колориметрический метод определения пероксидов в окисленных органических соединениях основан на восстанавливающей способности роданида железа (II) в кислой среде с последующим измерением интенсивности окраски образующегося роданида железа (III):
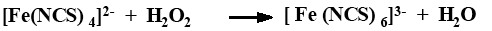
Максимум поглощения кроваво-красного комплекса роданида железа (III) лежит при 500 нм. Интенсивность окраски комплекса зависит от его координации, поэтому химическую реакцию ведут в избытке роданида аммония, а для подавления гидролиза раствор подкисляют. Из-за неустойчивости окраски необходимо строго выдерживать время фотоколориметрирования.
Метод стандартизирован (ГОСТ Р 51453–99. «Жир молочный. Метод определения перекисного числа в безводном жире») и рекомендован для анализа образцов, содержащих малые количества пероксидов. Для анализа веществ, содержащих значительное количество пероксидов, более пригодным и точным является йодометрический метод.
Колориметрический метод определения перекисного числа применяют для оценки качества безводного молочного жира, коровьего масла (сливочное и топленое) и безводного молочного жира других животных, перекисное число которых не превышает 2,0 ммоль активного кислорода/кг. Метод неприемлем для масел, содержащих соли галловой кислоты и другие антиокислители.
Ход анализа. Пробу анализируемого продукта (навеска – 0,5 г) взвесить на аналитических весах в закрытом бюксе и осторожно расплавить ее на плитке. Расплавленную пробу растворить в смеси растворителей хлороформ–метанол (7:3), количественно перенести в мерную колбу вместимостью 10 мл и довести объем раствора до метки тем же растворителем. Отобрать пипеткой 9,6 мл полученного раствора в фотометрическую кювету с длиной оптического пути 15 мл, пипеткой добавить 0,05 мл раствора роданистого аммония, смесь перемешать. Измерить оптическую плотность (А0) при длине волны 500 нм, используя в качестве раствора сравнения смесь растворителей хлороформ–метанол.
Затем в кювету добавить 0,05 мл раствора хлористого железа, перемешать и через 5 минут вновь измерить оптическую плотность смеси (А2) при длине волны 500 нм относительно растворителя (смесь хлороформ–метанол). С момента взвешивания пробы до измерения оптической плотности должно пройти не более 10 минут.
Контрольный опыт провести с теми же реагентами, заменив раствор анализируемого жира на смесь хлороформ–метанол. Для этого в фотометрическую кювету (с длиной оптического пути 15 мм) внести пипеткой 9,9 мл смеси хлороформ–метанол (7:3), пипеткой добавить 0,05 мл раствора роданистого аммония, 0,05 мл раствора хлористого железа и перемешать. Через 5 минут измерить оптическую плотность контрольного раствора при длине волны 500 нм относительно смеси хлороформ–метанол (А1).
По разности найти оптическую плотность анализируемой пробы (А500 , ед. оптической плотности):
А500 = А2 – (Ао-А1),
где А2 – оптическая плотность опытного раствора после добавления раствора хлористого железа;
А1 – оптическая плотность опытного раствора без добавления раствора хлористого железа;
Ао – оптическая плотность контрольного опыта.
Исходя из величины оптической плотности (А500) по калибровочному графику найти массовую долю железа (m, мкг). Перекисное число жира (ПЧ, ммоль активного кислорода/кг ) рассчитать по формуле:
где mо – массовая доля железа (III), найденная по калибровочному графику, мкг;
m – масса навески молочного жира, г;
55,84 – молекулярная масса железа, г/моль.
Калибровочная кривая. На основе рабочего раствора хлорида железа приготовить калибровочные растворы. В четыре фотометрические кюветы (с длиной оптического пути 15 мм) внести реактивы в количествах и последовательности, указанных в табл. 1.5.5.
Таблица 1.5.5. Схема приготовления калибровочных растворов
|
Рабочий раствор |
Смесь хлороформ– |
Масса железа (III), мкг |
|
0,25 0,50 1,00 2,00 |
9,65 9,40 8,90 7,90 |
12,5 25,0 50,0 100,0 |
К каждому калибровочному раствору добавить по 0,05 мл раствора роданистого аммония и 0,05 мл 0,2 н соляной кислоты. Для каждого калибровочного раствора отмерить по 5 минут и измерить оптическую плотность при длине волны 500 нм относительно смеси хлороформ–метанол. Построить калибровочный график в координатах: оптической плотности раствора (А500) – массовая доля железа (СFe, мкг).
|
Необходимые реактивы, посуда, оборудование: §хлорид бария, железо сернокислое, железный порошок, раствор роданистого аммония, стандартный раствор хлорного железа, раствор хлористого железа, хлороформ, метанол, железный порошок, соляная кислота (r20 = 1,18 г/мл), 0,2 н раствор соляной кислоты, раствор перекиси водорода; §бюксы с крышками, мерные колбы вместимостью 10 мл, 100 мл, пипетки, мерные цилиндры, стаканы вместимостью 100 мл, кюветы с длиной оптического пути 15 мм; §аналитические весы, фотоэлектроколориметр. |
0,2 н раствор соляной кислоты. В мерную колбу вместимостью 1 л внести 20 мл концентрированной соляной кислоты (r20 = 1,18 г/ мл) и довести объем дистиллированной водой до метки.
Раствор хлористого железа (II). Раствор готовить при непрямом рассеянном свете. В лабораторный стакан вместимостью 100 мл взвесить на аналитических весах 0,4 г хлорида бария (ВаС12 × 2Н2О), добавить 50 мл дистиллированной воды при перемешивании до полного растворения соли. В другой лабораторный стакан вместимостью 100 мл взвесить 0,5 г железа сернокислого (FeSO4 × 7H2O), добавить 50 мл дистиллированной воды при перемешивании до полного растворения.
Смешать приготовленные растворы, прилив к раствору сернокислого железа (II) раствор хлорида бария при постоянном перемешивании. К полученному раствору хлористого железа (II) прилить 2 мл раствора концентрированной соляной кислоты (r20 = 1,18 г/мл).
Смесь растворов хлороформа и метанола. Мерным цилиндром отмеряют 70 мл хлороформа и 30 мл метанола. Реактив хранить в посуде из темного стекла.
Раствор роданистого аммония (NH4SCN). В мерную колбу вместимостью 250 мл внести 30 г роданистого аммония, добавить 100 мл дистиллированной воды и перемешать до полного растворения соли. Для обесцвечивания раствор роданистого аммония перелить делительную воронку и экстрагировать изоамиловым спиртом порциями по 5 мл до полного обесцвечивания раствора. Бесцветный раствор роданистого аммония перелить из делительной в мерную колбу вместимостью 250 мл и довести объем до метки.
Стандартный раствор хлористого железа для построения калибровочного графика. В коническую колбу из термостойкого стекла вместимостью 100 мл взвесить 0,5 г железного порошка, добавить 50 мл раствора концентрированной соляной кислоты (r20 = 1,18 г/мл) и 1–2 мл раствора пероксида водорода и довести объем до метки дистиллированной водой.
Рабочий раствор хлористого железа. В мерную колбу вместимостью 100 мл отобрать 1 мл стандартного раствора хлористого железа и довести объем до метки дистиллированной водой.

