* * *
Витамин С (аскорбиновая кислота, гексуроновая кислота) отличается от всех других витаминов как по химии и биохимии, так и своей широкой распространенностью, он вездесущ – присутствует как в животном, так и в растительном мире, причем его роль до сих пор окончательно не выяснена.
Витамин С производится в больших количествах, чем все остальные витамины, вместе взятые. Это одно из немногих чистых химических веществ, которое потребляется человеком в граммовых количествах (больше потребляют только сахар). Казалось, что после установления структуры витамина, эта простая молекула ничем не может удивить. Тем не менее витамин С является предметом многочисленных дискуссий. Причем он был предметом дискуссий задолго до того, как была установлена его структура. Его роль в лечении и профилактике цинги дебатировалась на протяжении столетий, и даже само существование витамина С подвергалось сомнению. Драматична история открытия и установления структуры витамина С. Спорны рекомендуемые дозы витамина С для человека – от 30 мг до 10 г в день. Биохимия витамина С очень далека от понимания, хотя интенсивно исследуется.
Открытие витамина С является одной из интереснейших страниц в истории науки. Прежде всего, это было связано с таким распространенным до XIX века заболеванием, как цинга. Это заболевание поражало, как правило, мореплавателей, особенно в длительных морских экспедициях. Сегодня известно, что цинга – болезнь, вызванная недостатком витаминов, и она сопутствовала человечеству на протяжении всей его истории. Однако длительные морские путешествия привлекли к ней особое внимание. Эта болезнь вызывает кровотечение в тканях, ломкость кровеносных сосудов, кровоточивость десен, потерю зубов, анемию, общую слабость. Цинга сопровождает любые бедствия, связанные со снабжением продовольствием (длительные неурожаи, осады). Давно было известно, что цингу можно предупредить потреблением цитрусовых и на флоте она была побеждена после того, как стали вводить в рацион моряков в обязательном порядке лимонный сок. Однако выделить витамин С длительное время не удавалось. Настоящая гонка за неуловимым витамином С началась после Первой мировой войны. С. Цильва пытался выделить витамин из концентрированных соков цитрусовых. И хотя выделенный им препарат обладал сильным антискорбутным (противоцинготным) действием, выделить чистое кристаллическое вещество не удалось. Основным препятствием явился тот факт, что витамин, будучи углеводоподобным веществом, трудно очищался от других углеводов, присутствующих во фруктовых соках. Выделить витамин С в кристаллическом виде удалось А. Сент-Дьердьи, а окончательно установил его структуру Н. Хеуорс, за что им в 1937 году была присуждена Нобелевская премия.
Аскорбиновая кислота – производное моносахарида ряда L, ее эмпирическая формула указывает на родство с гексозами.
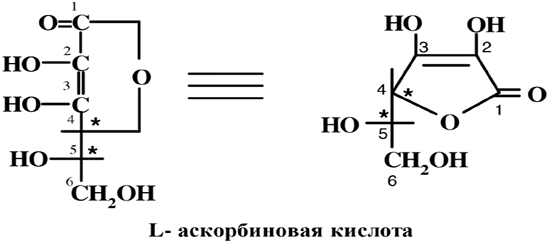
Аскорбиновая кислота (АК) является γ-лактоном, имеет L-конфигурацию С5 (содержит два-асимметричный центр при С4 и С5). Кислотные свойства АК такой же силы, и у карбоновых кислот, она титруется щелочами и образует соли. Однако кислотные свойства обусловлены не наличием карбоксильной группы, а енольными НО-группами: рК1 (С3 -ОН) равна 4,25 и рК2 (С2 -ОН) равна 11,79. Енольные гидроксилы (при С3 и С2), способные к ионизации, стабилизированы за счет находящейся в цикле карбонильной группой, при этом происходит делокализация отрицательного заряда и формирование анионной системы:
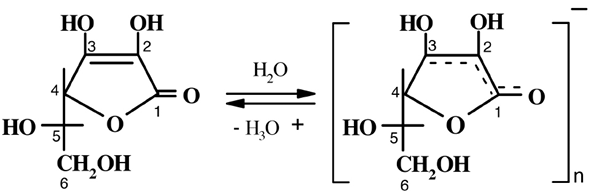
Данная структура и определяет каталитические функции витамина С – способность к обратимым окислительно-восстановительным превращениям, сопровождающимся переносом атомов водорода на акцептор.
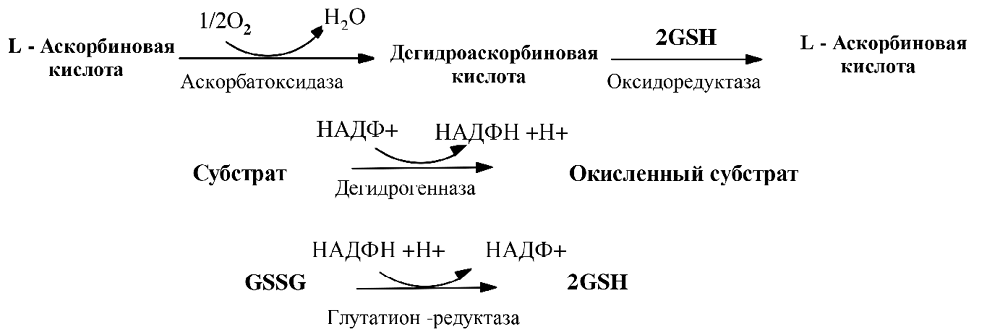
В природе витамин С существует в двух формах: аскорбиновая кислота и дегидроаскорбиновая кислота (ДАК), которые обладают одинаковой С-витаминной активностью. АК является самым сильным восстановительным агентом и выступает переносчиком водорода во многих ферментативных реакциях, протекающих в клетке. Она легко окисляется такими ферментами, как пероксидаза, в присутствии перекиси водорода и некоторых флавоноидов (флаванов, флавонолов), фенолоксидаза, цитохромоксидаза. Восстанавливая различные окисленные формы ферментов, АК окисляется до ДАК. Последняя легко и обратимо регенерируется в L-аскорбиновую кислоту при участии глутатиона за счет сульфогидрильной группы при воздействии оксидоредуктазы.
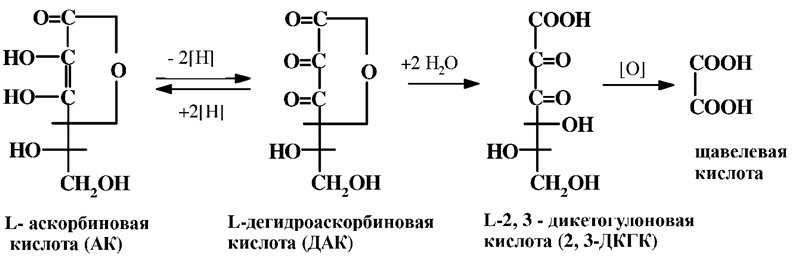
ДАК – это нейтральный лактон, который легко гидратируется, а затем гидролизуется с раскрытием лактонного кольца и образованием 2, 3- дикетогулоновой кислоты (ДКГК). Дальнейшее окисление ведет необратимо к образованию щавелевой кислоте. В этом ряду окисления аскорбиновой кислоты: АК ↔ ДАК → ДКГК → щавелевая кислота, ДАК еще сохраняет антискорбутное свойство, однако дальнейшие продукты окисления теряют эту способность.
Аскорбиновая кислота имеет два асимметрических атома углерода (в положении С4 и С5) и образует четыре оптических изомера, из которых две эпимерные формы дают по два оптических изомера – D- и L-аскорбиновой кислоты и их диастереоизомеры – D- и L-изоаскор-иновой кислоты. Из них витаминную активность проявляет изомер с L-конфигурацией гидроксила при С5, и изомер, имеющий лактонное кольцо, образованное по гидроксильной группе D-конфигурации при С4. Антискорбутную активность проявляет еще только D-изоаскорбиновая кислота (в 20 раз ниже, чем L-аскорбиновая).
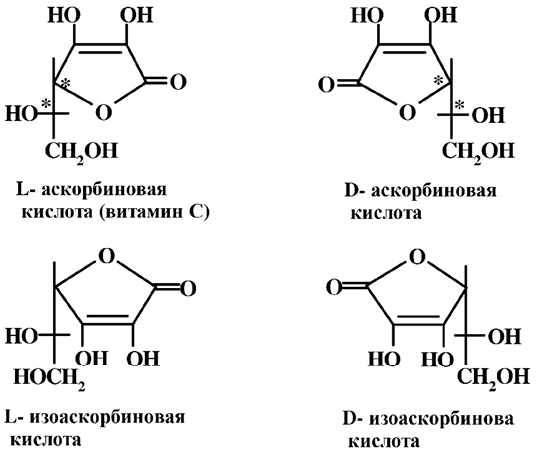
D-аскорбиновая кислота не обладает таковыми свойствами и является антивитамином. D-аскорбиновая кислота и D-, L-изоаскорбиновые кислоты в природе не встречаются, они получены синтетическим путем. Все четыре изомера находят применение в пищевой промышленности в качестве антиокислителей, аскорбиновая кислота – Е300–Е305, соли изоаскорбиновой кислоты Е316–Е318.
Многие растения содержат еще одну очень устойчивую форму витамина С – аскорбиген, который синтезируется в листьях растений. Это растительная форма, в которой аскорбиновая кислота связана с белками, нуклеиновыми кислотами, биофлавоноидами. По структуре он представляет собой индольное производное L-аскорбиновой кислоты (А и В формы). Природной форме отвечает аскорбиген А.
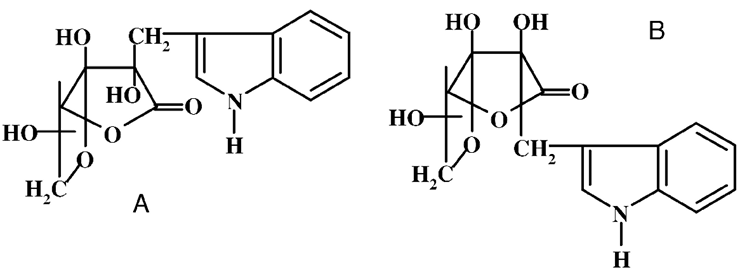
Особенно богаты аскорбигеном овощи из семейства крестоцветных. Он почти не обладает антискорбутными свойствами. Однако в организме человека он превращается в аскорбиновую кислоту, что обусловливает способность капусты длительное время сохранять витамин С.
Витамин С широко распространен в природе. Большинство представителей земной фауны способны биосинтезировать витамин из D-глюкозы, при этом одной из обязательных стадий является инверсия из D-конфигурации в L. Исключение составляют приматы, в том числе Homo sapiens, и некоторые другие млекопитающие, а также рыбы, отдельные насекомые и виды птиц, которые утратили эту способность примерно 25 миллионов лет назад. Считается, что эта ошибка природы произошла за счет утраты одного из ферментов, необходимого для биосинтеза аскорбиновой кислоты. У животных, способных к самообеспечению витамином С, биосинтез АК осуществляется в печени (млекопитающие) или почках (птицы, рептилии).
Все хлорофиллсодержащие растения и прорастающие семена синтезируют аскорбиновую кислоту из D-глюкозы или D-галактозы. Окисление аскорбиновой кислоты до дегидроаскорбиновой кислоты в растениях катализирует фермент – аскорбатоксидаза, от активности которого зависит содержание витамина в растительном сырье: чем выше активность фермента, тем ниже содержание витамина. Самыми богатыми источниками витамина С являются шиповник и черная смородина, все виды капусты, цитрусовые, томаты и зеленый перец, печеный картофель и листовые овощи (табл. 2.2.1). Данные о содержании витамина С в растительных продуктах колеблются в широких пределах в зависимости от множества параметров: места произрастания, характеристики почвы, погодных условий и т. д. В животных продуктах в достаточном количестве витамин С содержится (мг%): в печени – 30, почках – 10, сердце – 4, молоке – 1–4.
Таблица 2.2.1. Содержание витамина С во фруктах и овощах
|
Наименование продукта |
Массовая доля, мг% |
|
Плоды шиповника |
1000 |
|
Красный перец |
250 |
|
Черная смородина |
200 |
|
Облепиха |
200 |
|
Киви |
180 |
|
Петрушка |
150 |
|
Зеленый перец |
128 |
|
Хрен |
120 |
|
Капуста брокколи |
113 |
|
Брюссельская капуста |
109 |
|
Укроп |
100 |
|
Черемша |
100 |
|
Кресс-салат |
79 |
|
Цветная капуста |
78 |
|
Апельсины |
60 |
|
Земляника |
60 |
|
Лимоны |
50 |
|
Мандарины |
40 |
|
Капуста листовая |
47 |
|
Капуста белокочанная |
45 |
|
Лук порей |
35 |
|
Квашеная капуста |
30 |
|
Молодой картофель |
30 |
|
Томаты |
25 |
|
Зеленый горошек |
25 |
|
Печеный картофель |
17 |
|
Старый картофель |
8 |
|
Морковь |
6 |
|
Яблоки |
6 |
|
Сливы |
3 |
Биохимия витамина С в основном исследована на животных и эта проблема далеко не раскрыта, особенно не ясна роль витамина в растениях. Витамин С принимает участие в многочисленных биологических явлениях: окислительно-восстановительных процессах, входит в состав ферментов, обеспечивающих клеточное дыхание, участвует в углеводном и белковом обмене, особенно метаболизме аминокислот, повышает сопротивляемость организма инфекциям, регулирует холестериновый обмен, участвует в работе желудочно-кишечного тракта, поджелудочной железы, совместно с витамином Р обеспечивает эластичность кровеносных сосудов, обезвреживает действие ряда токсинов (мышьяк, свинец).
Все известные реакции с участием витамина С можно разбить на три группы: окислительные (гидроксилирование), восстановительные (например, устранение потенциально опасных окислительных свободных радикалов) и окислительно-восстановительные (имеющие отношение к переносу электронов и мембранному потенциалу через установление протонного градиента). Сама аскорбиновая кислота является восстановителем и, следовательно, не может непосредственно способствовать окислению. Но внутри живой клетки витамин может существовать в различных формах, которые образуют окислительно-восстановительные пары. Эти пары способны осуществлять как окисление, так и восстановление компонентов других окислительно-восстановительных пар.
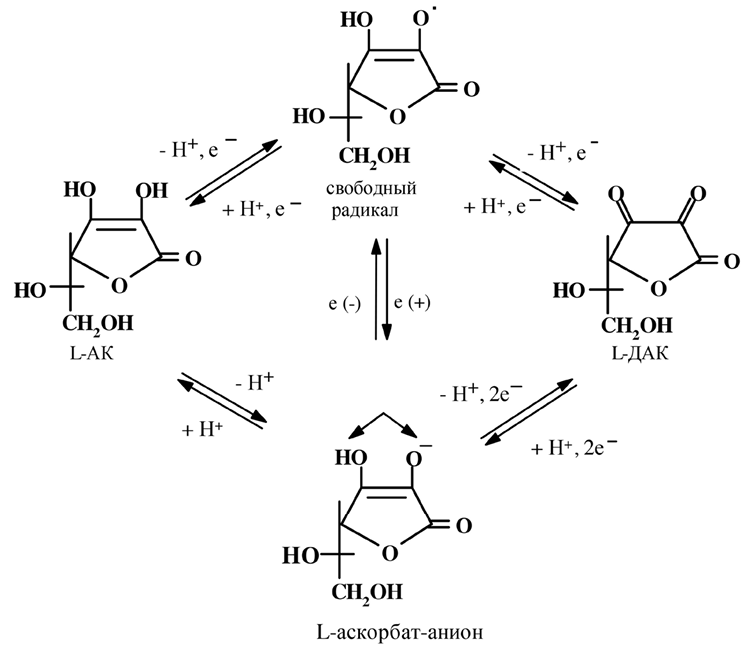
Рис. 22. Схема взаимопревращений физиологически активных
окислительно-восстановительных пар витамина С
Различные физиологически активные формы витамина С представлены на рис. 22 Эти формы взаимозаменяемы и позволяют объяснить многие свойства витамина. Участие витамина С в реакциях окисления и гидроксилирования объясняется наличием окислительно-восстановительной пары АК/ДАК.
Примером подобных процессов является участие аскорбиновой кислоты в метаболизме некоторых аминокислот: превращение пролина и лизина в гидроксипролин и гидроксилизин, превращение триптофана в серотонин и превращение фенилаланина и тирозина в гомогентизиновую кислоту.
Превращения пролина и лизина имеет большое значение и объясняет антискорбутное действие витамина С. Гидроксипролин и гидроксилизин содержатся в животных тканях практически только в составе коллагена, на долю которого приходится около 1/3 всех белков организма млекопитающих. Волокна коллагена входят в состав сухожилий, кожи, хрящей, кровеносных сосудов, сердечных клапанов, костей, зубов, межпозвонковых дисков и т.д. Коллаген обеспечивает внеклеточный каркас у всех многоклеточных. Формирование физиологически активного коллагена с четвертичной структурой возможно только при наличии гидроксилированных остатков пролина и лизина. Роль аскорбиновой кислоты заключается в том, что она сохраняет в восстановленном состоянии ион железа (II), который является кофактором гидроксилазы, катализирующей гидроксилирование пролина и лизина. Коллаген, синтезированный при недостатке витамина С, не способен к образованию полноценных волокон, что является причиной ломкости сосудов, поражения кожи и других признаков цинги.
Восстановительные свойства витамина С проявляются в их антиоксидантной способности гасить чрезвычайно реакционноспособные окислительные радикалы, например, гидроксильный и пероксидный радикалы. В растениях защиту от супероксидных радикалов обеспечивает система, в которую входят аскорбат, глутатион и кофермент – НАДФН2.
Витамин С выступает кофактором многих монооксигеназ. Предполагается участие витамина С в переносе электронов в дыхательной цепи и окислительном фосфорилировании, вероятно, он выступает донором электронов для восстановления цитохрома С. Окислительно-восстановительная пара АК/ДАК осуществляет перенос электронов между метаболитами и кислородом, претерпевая циклические изменения и переходя от окисленной формы к восстановленной.
Витамин С обеспечивает защиту витамина Е на границе раздела липидно/водной фазы. Восстановительная способность АК обеспечивает восстановление фолиевой кислоты (В9). Известна способность витамина С образовывать комплексы с ионами металлов, которые могут восстанавливаться, например ионы Fe (III), Cu (II), Ni (II), Mn (II) и др. Координационные связи в подобных комплексах, как правило, формируются за счет атомов кислорода гидроксильных групп при С2 и С3. Для комплекса L-аскорбата железа предложена следующая структуры.
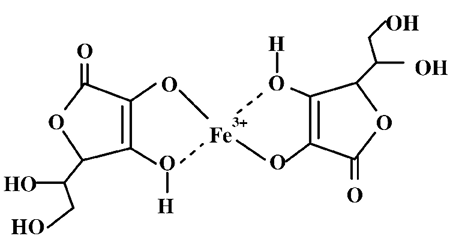
Считается, что основная роль витамина С в метаболизме заключается в том, что он является оптимальным, хотя и не единственным фактором, необходимым для поддержания медь- и железосодержащих ферментов в восстановленном состоянии, в котором они наиболее активны.
АК оказывает разностороннее влияние на процессы обмена веществ у здоровых людей, а при различных патологических состояниях благоприятствует нормальному течению обмена веществ и функционированию различных органов и систем организма. Гиповитаминоз витамина С проявляется в потере аппетита, анемии, быстрой утомляемости, весенней усталости, склонности к кровоточивости, инфекционным заболеваниям и других симптомах.
Суточная потребность человека в витамине С зависит от возраста, пола, типа выполняемой работы, состояния беременности или лактации, климатических условий, вредных привычек (табл. 2.2.2). Средневзвешенная норма физиологической потребности составляет 60–100 мг/сут. Обычная терапевтическая доза составляет 500–1500 мг/сут. Активно пропагандируемые, мега-дозы, рекомендуемые Л. Полингом, 1–10 г/сут., оспариваются медиками.
Производство витамина С во всем мире является многотоннажным. К концу ХХ столетия, по некоторым оценкам, ежегодное мировое производство составляло свыше 40 тыс. тонн. Разработано довольно много методов синтеза аскорбиновой кислоты из пентоз и гексоз (ксилоза, арабиноза, D-галактоза и т. д.), но самым удобным и самым распространенным в промышленном производстве является метод, разработанный Рейхштейном – получение из D-глюкозы.
Таблица 2.2.2. Рекомендуемая потребность в витамине С, мг/сут
|
Категория |
Возраст, годы |
Россия |
США |
|
Грудные дети |
0–½ |
30 |
40 |
|
½–1 |
35 |
50 |
|
|
Дети |
1–3 |
40 |
15 |
|
4–8 |
45 |
25 |
|
|
9–13 |
45 |
45 |
|
|
Мужчины |
11–14 |
50 |
45 |
|
15–18 |
60 |
45 |
|
|
19–24 |
60 |
95 |
|
|
25–50 |
60 |
95 |
|
|
>50 |
60 |
95 |
|
|
Женщины |
11–14 |
50 |
45 |
|
15–18 |
60 |
45 |
|
|
19–24 |
60 |
75 |
|
|
25–50 |
60 |
75 |
|
|
>50 |
60 |
75 |
|
|
Беременные |
≤18 |
70 |
80 |
|
≥19 |
70 |
85 |
|
|
Кормящие матери |
≤18 |
95 |
115 |
|
≥19 |
95 |
120 |
Этот метод с некоторыми модификациями до сих пор составляет основу промышленного производства аскорбиновой кислоты. Метод включает пять стадий:
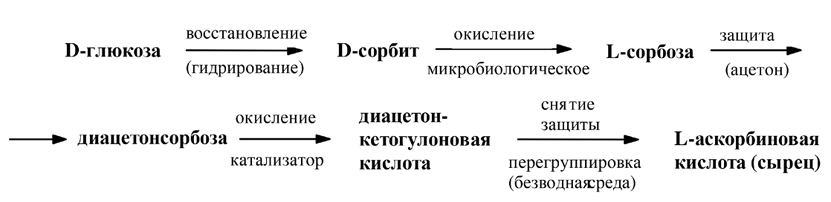
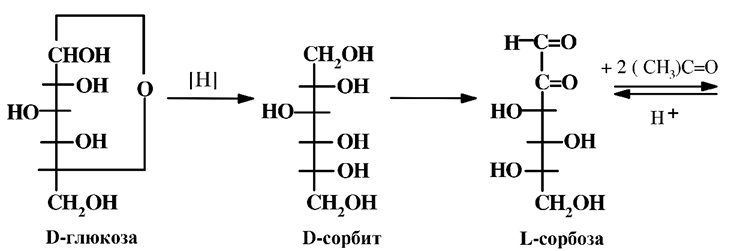
1. Восстановление D-глюкозы до D-сорбита (путем электролитического либо каталитического гидрирования).
2. Ферментативное окисление до L-сорбозы (с использованием бактерий Acetobacter suboxydans).
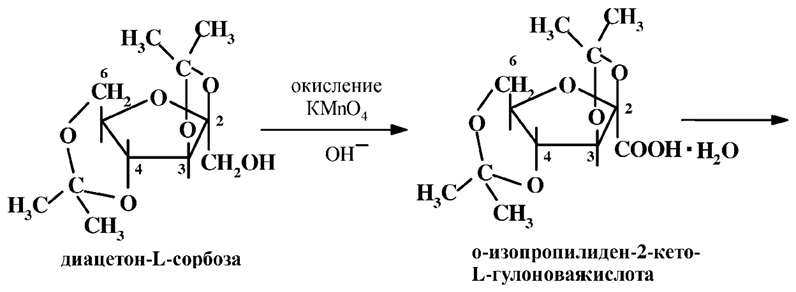
3. Ацетонирование сорбозы в кислой среде для защиты гидроксильных групп при С2, С3, С4, С6. Наилучший выход достигается при температуре –5 оС.
4. Окисление защищенной сорбозы в диацетонкетогулоновую кислоту.
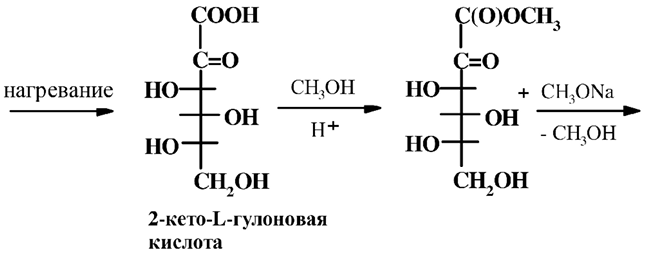
5. Снятие защиты и перегруппировка в L-аскорбиновую кислоту.
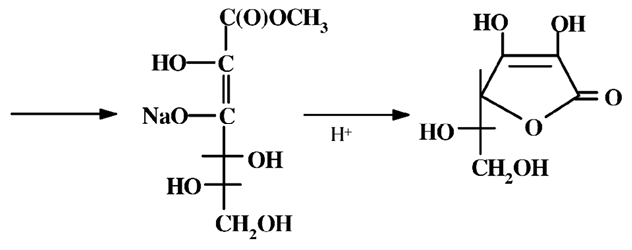
В результате многолетних модификаций удалось достичь суммарного выхода в пересчете на исходную глюкозу более 50%.
Витамин С – один из витаминов, потребность в котором не покрывается за счет пищевых продуктов. Это связано с тем, что аскорбиновая кислота легко разрушается при технологической обработке, а также сезонностью свежих овощей и фруктов. Потребление мяса, рыбы, консервированных продуктов, в которых содержание витамина С понижено, способствует увеличению недостаточности. Поэтому аскорбиновая кислота используется в пищевой промышленности для обогащения продуктов питания (фруктовые соки, сокосодержащие напитки, фруктовые и овощные пюре, мармелад, жевательная резинка, кисломолочные напитки и другие); для стандартизации содержания витамина (фруктовые и овощные консервы); для стабилизации в качестве антиоксиданта, обеспечивая сохранность вкуса, запаха и пищевой ценности (в соки и напитки); в качестве улучшителей муки и теста (2–5 г/100 кг муки), сокращая время созревания муки после помола; для стабилизации цвета мяса и мясных продуктов, снижения образования нитрозаминов из нитритов, в мясной промышленности. Рекомендуемый уровень обогащения 30–100% от суточной потребности организма на порцию. Добавление 150–200 мг/л в яблочный сок позволяет сохранить цвет, вкус и аромат сока после пастеризации. В жиры и масла витамин С вводится в виде эфира – аскорбилпальмитат (1 мг витамина С соответствует 2,36 мг аскорбилпальмитата).
В процессе технологической обработки пищевых продуктов основные потери витамина С связаны в первую очередь с его высокой растворимостью в воде. Кроме того, убыль витамина обусловлена ферментативным и неферментативным окислением витамина молекулярным кислородом при измельчении и хранении растительного сырья. Разрушение клеточной стенки ведет к высвобождению аскорбатоксидазы и фенолаз. Аскорбатоксидаза инициирует окисление до ДАК, которая легко гидролизуется до 2, 3-ДКГК. Фенолазы вызывают потемнение фруктов и овощей, катализируя окисление полифенольных соединений кислородом воздуха до хинонов. В присутствии АК фенолазы восстанавливают о-хиноны до о-дифенолов с образованием ДАК.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ВИТАМИНА С
|
Показатель |
Характеристика |
|
|
Аскорбиновая кислота |
Дегидроскорбиновая кислота |
|
|
Формула |
С6 Н8 О6 |
С6Н6О |
|
Молекулярная масса |
176,1 |
174,1 |
|
Температура плавления, о С |
192 |
237–240 (с разл.) |
|
Растворимость |
легко растворим в воде, метиловом спирте, но в высших спиртах почти нерастворим. умеренно растворим в ацетоне и совсем нерастворим в диэтиловом и петролейном эфирах |
|
|
Водный раствор, рН |
около 3 |
близкое к нейтральному |
|
Удельное вращение |
[a]D 20 = +23 |
[a]D 20 = +55 |
|
Биологическая активность |
1 МЕ = 0,05 мкг |
|
|
Максимум поглощения, |
265 (7000) в кислой и 245 (12200) в нейтральной средах |
отсутствует селективное поглощение в УФ-области |
|
Удельный показатель, |
695 |
|
АК легко окисляется до ДАК под воздействием различных окислителей – йода, брома, хлора, хинонов в кислой среде, молекулярного кислорода в присутствии солей меди (II) при рН 5 и других окислителей. Обратное восстановление до аскорбиновой кислоты может протекать при действии сероводорода, йодноватистой кислоты, цистеина, гомоцистеина и др.
Высокая окислительная способность АК осложняют количественный анализ витамина в пищевых продуктах. Кроме того, витамин нестабилен в нейтральной и щелочной средах, поэтому экстракцию при подготовке анализируемой пробы ведут с использованием кислот, обеспечивающих необходимую кислотность и денатурацию ферментов.
Наиболее эффективным экстрагентом витамина С является метафосфорная кислота, которая не только инактивирует аскорбатоксидазы, но и способствует осаждению белков. Однако метафосфорная кислота извлекает только свободную аскорбиновую кислоту, при необходимости определения и свободной, и связанной формы витамина экстракцию ведут в два этапа. На первом этапе с помощью соляной кислоты извлекают как свободную, так и связанную аскорбиновую кислоту. На втором этапе для инактивации ферментов и стабилизации аскорбиновой кислоты к экстракту добавляют метафосфорную или более дешевую щавелевую кислоту.
Присутствие в экстрактах посторонних редуцирующих веществ (танинов, ионов металлов, восстанавливающих сахаров и др.), мешающих определению витамина С, и тем самым завышающих результаты анализа, определяют путем добавления раствора сульфата меди. При нагревании экстракта с сульфатом меди при температуре 110 0С в течение 10 минут происходит практически полное окисление АК.
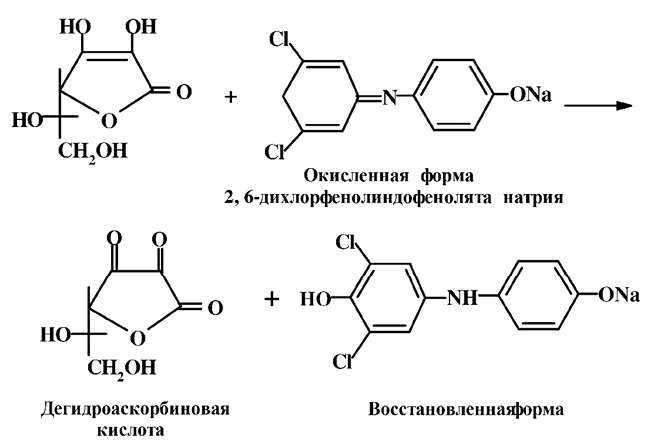
В основу известных химических методов определения витамина С положена его способность легко вступать в окислительно-восстановительные реакции и восстанавливать метиленовую синь, гексацианоферрат (III) калия, нитрат калия, 2, 6-дихлорфенолиндофенолят натрия. Среди названных доступным и широко применяемым для анализа всех видов пищевых продуктов является метод с использованием 2, 6-дихлорфенол-индофенолята натрия, который обычно называют, 2, 6-дихлорфенолиндофенол, или краска Тельмана. Краска Тельмана окисляет аскорбиновую кислоту до дегидроаскорбиновой. Данная реакция лежит в основе титриметрического и колориметрического методов.
Витамин В1 (тиамин, анейрин, аневрин). Водорастворимый витамин группы В, широко распространен в природе, входит в состав всех растительных и животных клеток, но синтезируется только растительными клетками и некоторыми видами микроорганизмов, в том числе микрофлорой толстого кишечника человека.
Впервые витамин В1 выделил из рисовых отрубей голландский врач Эйкман в 1906 году, установив, что болезнь бери-бери стала распространяться после внедрения машин для полировки риса, и население, для которого рис является основным пищевым продуктом, стало использовать исключительно полированный рис. В 1929 году за это открытие Эйкман получил Нобелевскую премию. Строение витамина установил в 1936 году американский химик Уильямс, он же осуществил его химический синтез.
По химической структуре тиамин представляет собой систему из двух гетероциклов – пиримидина и тиазола. Азот тиазольного цикла находится в аммонийном состоянии.
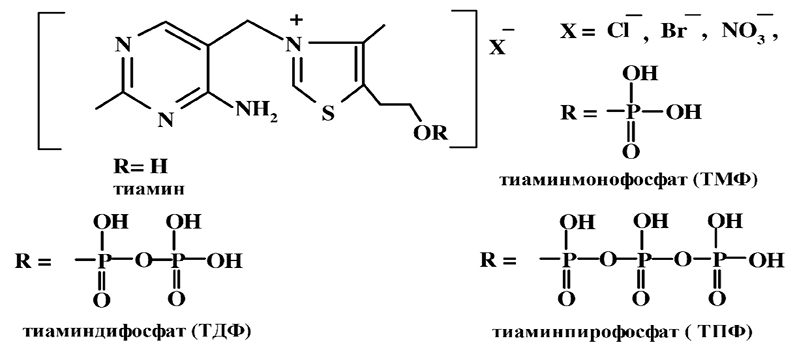
В природе тиамин присутствует либо в свободном виде, либо в виде моно-, ди- и трифосфатов с подавляющей долей дифосфата, который и является основной действующей формой витамина В1 в организме. Природный витамин представляет собой хлористо-водородную аммонийную соль, а синтетический – аналогичную по активности бромистоводородную. Тиамин обладает высокой специфичностью и даже небольшие изменения в молекуле приводят к падению биологической активности.
Таблица 2.2.6. Содержание витамина В1 в продуктах питания
|
Наименование продукта |
Массовая доля, мг% |
|
Семена подсолнечника |
1,84 |
|
Горох лущеный |
0,90 |
|
Мука соевая Обезжиренная |
0,85 |
|
Горох (зерно) |
0,81 |
|
Арахис |
0,74 |
|
Дрожжи прессованные |
0,60 |
|
Икра зернистая кеты |
0,55 |
|
Свинина мясная |
0,52 |
|
Фасоль |
0,50 |
|
Крупа овсяная |
0,49 |
|
Овес (зерно продовольственное) |
0,48 |
|
Рожь (зерно) |
0,44 |
|
Крупа гречневая (ядрица) |
0,43 |
|
Мука ржаная обойная |
0,42 |
|
Крупа пшеничная |
0,42 |
|
Мука пшеничная обойная |
0,41 |
|
Свинина жирная |
0,40 |
|
Почки говяжьи |
0,39 |
|
Орехи грецкие |
0,38 |
|
Пшеница твердая (зерно) |
0,37 |
|
Сердце говяжье |
0,36 |
|
Зеленый горошек |
0,34 |
|
Рис (зерно продовольственное) |
0,34 |
|
Фундук |
0,30 |
|
Печень говяжья |
0,30 |
|
Тунец |
0,28 |
|
Крупа ячневая |
0,27 |
|
Мука пшеничная, 1 сорт |
0,25 |
|
Мука пшеничная, в/с |
0,17 |
|
Ставрида океаническая |
0,17 |
|
Масло сливочное |
0,15 |
|
Картофель |
0,12 |
|
Мозги говяжьи |
0,12 |
|
Мясо кролика |
0,12 |
|
Картофель отварной |
0,10 |
|
Крупа рисовая |
0,08 |
Главными пищевыми источниками витамина В1 для человека является ржаной и пшеничный цельный хлеб, крупы (овсяная и гречневая). Богаты витамином В1 бобовые, дрожжи, печень, нежирная свинина, а также зерновые продукты, особенно грубого помола (табл. 2.2.6).
Основной биохимической формой витамина В1 является тиаминдифосфат, который в виде простетической группы входит в состав тиаминовых ферментов. Его биохимическая функция заключается в участии в процессах углеводного обмена, в частности, окислительного декарбоксилирования пировиноградной кислоты и расщеплении углеродных связей других α-кетокислот и α-кетоспиртов. Излишнее накопление α-кетокислот, особенно пировиноградной, крайне вредно для организма и ведет к поражению нервной системы и сердечной мышцы.
Авитаминоз витамина В1 является причиной тяжелых заболеваний – полиневритов. Кроме того, установлено участие витамина В1 в процессах водного обмена и кроветворения. В настоящее время витамин В1 применяется для лечения нервных и психических расстройств, радикулитов, неврозов, сердечно-сосудистых заболеваний и болезней пищеварительной системы. При отсутствии или недостаточности тиамина развивается тяжелое заболевание – бери-бери, распространенное в ряде стран, где основным продуктом питания является рис. Недостаточность витамина B1 встречается и в европейских странах, где она известна как симптом Вернике, или синдром Вейса. Специфические симптомы связаны с преимущественными нарушениями деятельности сердечно-сосудистой и нервной систем, а также пищеварительного тракта. В настоящее время пересматривается точка зрения, что бери-бери у человека является следствием недостаточности только витамина В1. Более вероятно, что это заболевание представляет собой комбинированный авитаминоз или полиавитаминоз, при котором организм испытывает недостаток также в витаминах В2, В5, В6, С и др.
Несмотря на то, что витамин В1 синтезируется микрофлорой кишечника, организм человека нуждается в постоянном поступлении его с пищей, при этом подавляющее большинство людей нуждается в дополнительном приеме витамина, особенно если основная часть рациона составляет вареная пища или рафинированные мучные продукты. Суточные нормы потребления витамина В1 в России для взрослых составляет 1,2 мг (табл. 2.2.7).
Таблица 2.2.7. Рекомендуемая потребность в витамине В1, мг/сут
|
Возраст, годы |
Россия |
Великобритания |
США |
|
Грудные дети |
|||
|
0-½ |
0,4 |
0,3 |
0,3 |
|
½-1 |
0,5 |
0,4 |
|
|
Дети |
|||
|
1–3 |
0,8 |
0,3 |
0,7 |
|
4–6 |
0,9 |
0,4 |
0,9 |
|
7–10 |
1,2 |
0,4 |
1,0 |
|
Мужчины |
|||
|
11–14 |
1,4 |
0,4 |
1,3 |
|
15–18 |
1,5 |
0,4 |
1,5 |
|
19–59 |
1,2 |
0,4 |
1,5* |
|
60–74 |
1,2 |
0,4 |
1,2** |
|
>75 |
1,2 |
0,4 |
1,2 |
|
Женщины |
|||
|
11–14 |
1,3 |
0,4 |
1,1 |
|
15–18 |
1,3 |
0,4 |
1,1 |
|
19–59 |
1,1 |
0,4 |
1,1* |
|
60–74 |
1,3 |
0,4 |
1,0** |
|
>75 |
1,1 |
0,4 |
1,0 |
* – до 51 года; * * – старше 51 года.
Потребность в витамине увеличивается во время болезни и в период беременности и кормления. Возрастает потребность в витамине и с возрастом, так как у пожилых людей снижается способность его усваивать и метаболизировать. Терапевтические дозы могут быть в десятки раз выше.
В промышленности тиамин получают синтетическим путем из соответствующих производных тиазола и пиримидина. Существует несколько методов получения тиамина. Самый распространенный предполагает раздельное получение тиазолина и пиримидина с последующей конденсацией и образованием витамина В1.
В пищевой промышленности широко используют концентраты витамина В1 из природных источников, главным образом из дрожжей, рисовых отрубей и зародышей пшеницы и ячменя. Витамин В1 совместно с В2 и В5 применяют для витаминизации хлебобулочных изделий из пшеничной муки. Обычно для витаминизации пищевых продуктов используют тиамин-мононитрат, как наиболее устойчивую и менее гигроскопичную форму, или с тиамин-хлорид-гидрохлорид. Тиамин-хлорид и тиамин-бромид отличает более высокая растворимость, они обладают слабым специфическим запахом дрожжей или орехов.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ВИТАМИНА В1
|
Показатель |
Характеристика витамина В1 |
|
|
Тиамин гидрохлорида |
Бромид гидробромида |
|
|
Формула |
(С12Н17ОN4S)+ Cl– ×НCl × ½H2O |
(С12Н17ОN4S)+Br–×НBr × × ½H2O |
|
Молекулярная масса |
337,3 |
436,2 |
|
Температура плавления (разл.), оС |
247–248 (разл.) |
210–215 |
|
Растворимость |
Хорошо растворимы в воде, этиловом спирте; умеренно растворимы в низших спиртах; нерастворимы в высших спиртах, бензоле, эфире, ацетоне, хлороформе |
|
|
Биологическая активность |
1 г кристаллического витамина В1 – 333000 ИЕ41 |
|
|
Максимум поглощения, λmax, нм (ε) |
235 (11300); |
|
|
Удельный показатель, поглощения, |
442 |
|
|
рН (1%-го водного раствора) |
3,13 |
|
Витамин В1 устойчив в сильно кислой среде, не окисляется под действием многих окислителей: пероксида водорода, марганцовокислого калия, озона. При рН 3,5 тиамин выдерживает нагрев 120 оС без заметных признаков разложения, но разрушается в течение одного часа на 25% при температуре 97 оС и рН 4,3. 1
В нейтральной и особенно в щелочной среде витамин B1 быстро разрушается при нагревании. Этим объясняется частичное или полное разрушение тиамина при кулинарной обработке пищи с добавлением гидрокарбоната натрия или карбоната аммония. В щелочной среде тиазоловый цикл тиамина легко расщепляется с образованием открытой тиольной формы тиамина, которая обладает высокой реакционной способностью и склонна к окислению:
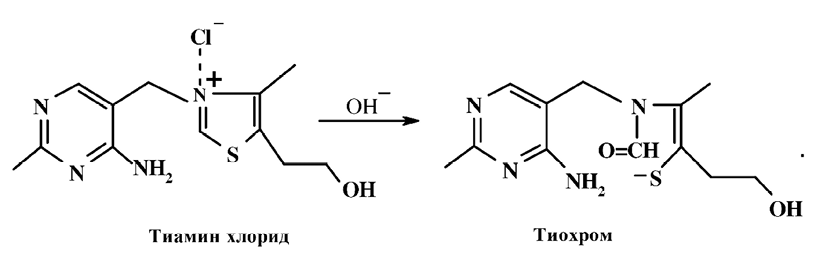
В отличие от тиамина образующийся при этом в щелочной среде тиохром обладает флуоресценцией, что используется в аналитических целях. В нейтральной или слабощелочной средах тиамин реагирует с солями диазония с образованием окрашенных в красный цвет триазенов:
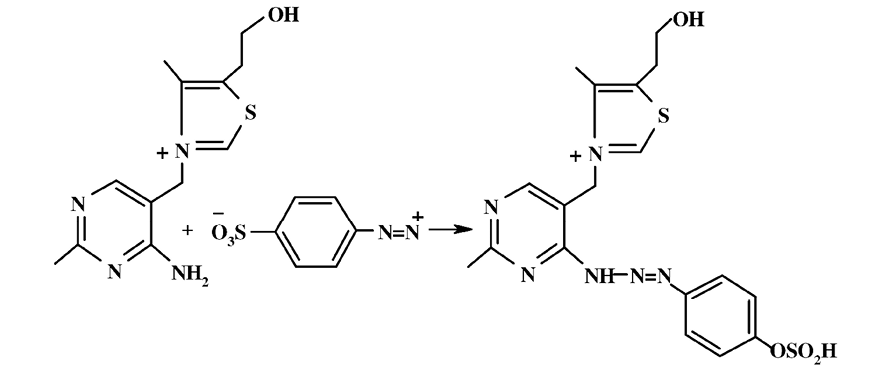
Проведению данной реакции мешает присутствие ароматических аминов и фенолов. Она лежит в основе спектрофотометрического метода анализа тиамина в растворах.
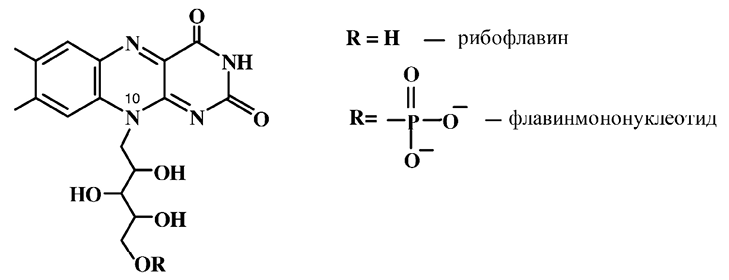
Витамин В2 впервые описан в 1879 году как желтый пигмент коровьего молока. Строение установили одновременно в 1935 году П. Каррер и Р. Кун. По химической структуре витамин В2 (рибофлавин) состоит из изомеров флавинового производного люмихрома с характерным заместителем (производное спирта рибита) у десятого атома азота. Этот сильно гидроксилированный заместитель выполняет роль связующего звена при формировании коферментов. Замена рибита на другой пяти-, шестиатомный спирт ведет к снижению или полному падению витаминной активности.
При ультрафиолетовом воздействии рибофлавин подвержен фотолитическому дезалкилированиюю с образованием биологически неактивных форм: в щелочной среде – люмифлавина, в кислой и нейтральной средах – люмихрома.
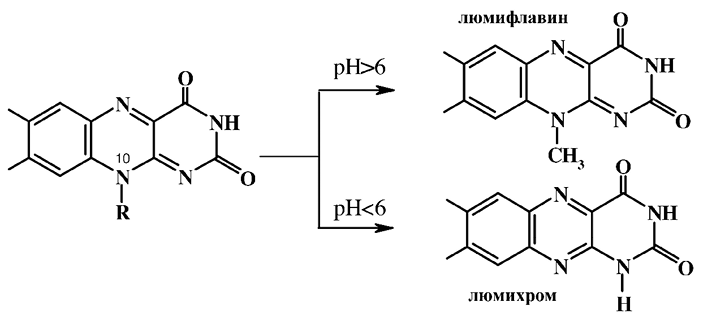
Таблица 2.2.8. Содержание витамина В2 в пищевых продуктах
|
Наименование продукта |
Массовая доля, мг% |
|
Печень говяжья |
2,19 |
|
Почки говяжьи |
1,80 |
|
Яйцо перепелиное |
0,65 |
|
Миндаль |
0,65 |
|
Сыр Сулугуни |
0,50 |
|
Яйцо куриное |
0,44 |
|
Грибы белые свежие |
0,30 |
|
Сыр Российский |
0,30 |
|
Мозги свиные |
0,28 |
|
Творог, 4% жирн. |
0,26 |
|
Шпинат |
0,25 |
|
Лосось атлантический |
0,25 |
|
Телятина 1 категории |
0,23 |
|
Тунец |
0,23 |
|
Крупа гречневая (ядрица) |
0,20 |
|
Капуста брюссельская |
0,20 |
|
Мясо кролика |
0,18 |
|
Кефир, 3,2% жирн. |
0,17 |
|
Молоко пастеризованное, 3,2% жирн. |
0,15 |
|
Мука ржаная обойная |
0,15 |
|
Куры 1 категории |
0,15 |
|
Горох лущеный |
0,15 |
|
Баранина 1 категории |
0,14 |
|
Молоко стерилизованное, 3,2% жирн. |
0,13 |
|
Грецкий орех |
0,12 |
|
Крупа овсяная |
0,11 |
|
Лук зеленый |
0,10 |
|
Мука пшеничная 1 сорта |
0,08 |
|
Хлеб столовый подовый (из обойной муки) |
0,08 |
|
Хлеб бородинский (из муки 2 сорта) |
0,08 |
|
Крупа перловая |
0,06 |
|
Мука пшеничная, в/с |
0,03 |
Витамин В2 широко распространен в природе – в растительных, животных клетках и микроорганизмах. Животные не способны к самостоятельному синтезу витамина и получают его с пищей или в результате действия микрофлоры желудочно-кишечного тракта. Главным пищевым источником рибофлавина являются молочные продукты, яйца, печень, почки, дрожжи, основным растительным – бобовые (табл. 2.2.8).
В свободном виде рибофлавин найден лишь в молоке, моче и пигментном слое сетчатки. Основной природной формой рибофлавина является коферментная форма, ковалентно связанная с белком. Первый флавиновый кофермент – флавинмононуклеотид (ФМН) – был выделен А. Сент-Дьердьи из сердечной мышцы. Второй важнейший флавиновый кофермент – флавинадениндинуклеотид (ФАД).
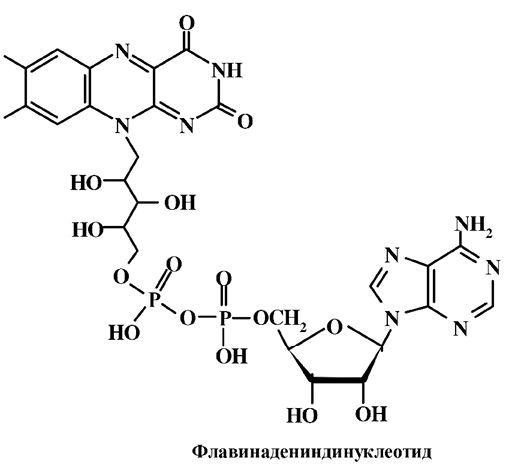
Флавиновые коферменты осуществляют окислительно-восстанови-тельные реакции в составе многих важнейших ферментных систем – оксидаз и дегидрогеназ (флавинзависимые ферменты) – в качестве простетической группой. При этом флавины легко и обратимо восстанавливаются, принимая два атома водорода. В результате нарушается сопряженная система связей, что сопровождается исчезновением окраски (образованием лейкоформы).
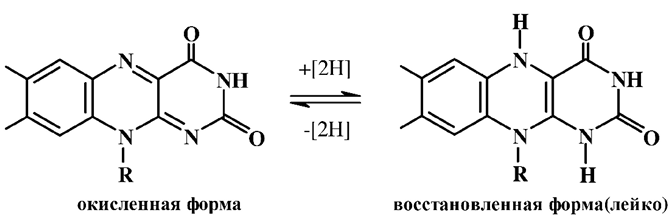
Лейкоформа в свое время легко окисляется до рибофлавина в организме под действием кофермента НАД+. Эта способность отдавать и присоединять водород по азометиновой группировке лежит в основе биологической активности рибофлавинов.
Так как флавиновые ферменты присутствуют в различных органах и почти во всех аэробных клетках, то недостаток витамина В2 приводит к падению интенсивности тканевого дыхания и обмена веществ в целом, а следовательно, и к замедлению роста молодого организма. При дефиците витамина В2 (арибофлавиноз) развиваются заболевания кожи, воспаления слизистых, поражения сетчатки и роговой оболочки глаз, в дальнейшем проявляются заболевания кроветворной системы и желудочно-кишечного тракта. Рибофлавин играет важную роль в механизме зрения, благодаря светочувствительности он выполняет роль сенсибилизатора зрения, осуществляя батохромный сдвиг и превращая фиолетовые и синие лучи в более длинноволновые, к которым чувствительность человеческого глаза выше.
Суточная потребность в рибофлавине зависит от суммарных энергозатрат и составляет для мужчин – 1,3 мг, возрастая с увеличением физической активности, для женщин – 1,1 мг (табл. 2.2.9). Терапевтические дозы могут быть более высокими. Несмотря на распространенность витамина В2, обычный пищевой рацион недостаточен по рибофлавину, при кулинарной обработке потери витамина составляют 15–30%. Наряду с тиамином и никотиновой кислотой рибофлавин применяют для витаминизации хлебобулочных изделий из пшеничной муки. В животноводстве его используют для витаминизации комбикормов – 5–8 г/т. Так, например, высокая яйценоскость бройлерных кур невозможна без витаминизации кормов.
Таблица 2.2.9. Рекомендуемая потребность в витамине В2, мг/сут
|
Категория |
Возраст, годы |
Россия |
Великобритания |
США |
|
Грудные дети |
0–½ |
0,5 |
0,4 |
0,6 |
|
½–1 |
0,6 |
0,4 |
0,5 |
|
|
Дети |
1–3 |
0,9 |
0,6 |
0,8 |
|
4–6 |
1,0 |
0,8 |
1,1 |
|
|
7–10 |
1,4 |
1,0 |
1,2 |
|
|
Мужчины |
11–14 |
1,7 |
1,2 |
1,5 |
|
15–18 |
1,8 |
1,3 |
1,8 |
|
|
19–59 |
1,5 |
1,3 |
1,7* |
|
|
60–74 |
1,6 |
1,3 |
1,4** |
|
|
>75 |
1,4 |
1,3 |
||
|
Женщины |
11–18 |
1,5 |
1,1 |
1,3 |
|
19–59 |
1,3 |
1,1 |
1,3* |
|
|
60–74 |
1,5 |
1,1 |
1,2 |
|
|
>75 |
1,3 |
1,1 |
1,2 |
|
|
Беременные |
+0,3 |
1,4 |
1,6 |
|
|
Кормящие |
+0,5 |
1,6 |
1,8 |
* – с 19 до 50 лет, ** – после 50 лет.
В промышленности рибофлавин получают в основном путем микробиологического или химического синтеза. Широко применяют и естественные источники витамина, для получения рибофлавина в виде экстрактов и концентратов используют дрожжи, сырую печень, солодовый экстракт и молочную сыворотку.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ВИТАМИНА В2
|
Показатель |
Характеристика рибофлавина |
|
Состояние вещества |
Желто-оранжевые кристаллы (из спирта) |
|
Формула |
С17Н20ОNО6 |
|
Молекулярная масса |
376,4 |
|
Температура плавления, о С |
около 280 (разл.) |
|
Растворимость |
В воде (0,01 г/100 мл), этиловом спирте, диэтиловом эфире, бензоле, в хлороформе не растворим |
|
Биологическая активность |
1 г кристаллического витамина 4×105 ИЕ |
|
Максимум поглощения λmax, нм (ε): |
266 (32500); 373 (10600); 445 (12500) в воде при рН 7 |
|
Удельный показатель поглощения, |
830, 275, 310 |
|
Флуоресценция, нм |
360, 465 (первичное); 521(вторичное) |
|
Абсорбционный максимум флуоресценции, нм |
515–645 (желтовато-зеленая) |
Рибофлавин мало растворим в воде, его насыщенный раствор имеет рН 6, в щелочной среде растворимость витамина В2 повышается, но при этом он легко разрушается. В кислой среде рибофлавин устойчив при нагревании, в 30%-ной соляной кислоте растворимость рибофлавина составляет 18%, в ледяной уксусной кислоте – 1%. Водный раствор рибофлавина обладает желто-зеленой флуоресценцией.
В природных объектах витамин В2 присутствует в четырех формах: свободный рибофлавин, ФМН, ФАД и в связанной с белком форме. Для определения суммарного содержания рибофлавина и его коферментных форм в биологических объектах используют микробиологические методы, основанные на измерении скорости размножения Lactobacillus casei или продуцировании ими молочной кислоты. Чувствительность метода 0,02 мкг/мл. Чувствительность метода с использованием в качестве тест-объекта Leuconostoc mesenteroides составляет 10–4 мкг/мл.
В относительно концентрированных растворах содержание рибофлавина, ФМН и ФАД определяют спектрофотометрически и флуорометрически по интенсивности свечения рибофлавина либо продукта фотолиза люмифлавина. Чувствительность флуориметрического метода в 100 раз превосходит чувствительность спектрофотометрического и его используют для определения рибофлавина, ФАД, ФМН в жидкостях (крови, моче), тканях организма и пищевых продуктах.
Витамин В3 (пантотеновая кислота) впервые был выделен Р. Уильямсом в 1938 году из дрожжей и назван «пантотеновый» (вездесущий). Его называют также «универсальным витамином» или антидерматитным фактором. Вскоре было установлено его строение витамина и осуществлен химический синтез.
По своему химическому строению витамин В3 представляет собой амид пантоевой кислоты и β-аланина:
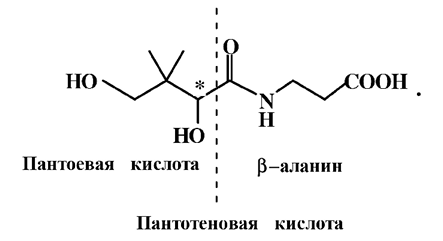
Пантотеновая кислота (3–(2, 4–дигидроксид–3, 3–диметил–1–бутирил–β–амино) пропионовая кислота или пантоил–β–аланин) содержит в своем составе один асимметрический атом углерода и имеет два оптических изомера, из которых только D(+)-изомер обладает биологической активностью, L-изомер не активен.
Как типичная оксикислота пантотеновая кислота образует производные как по карбоксильной группе – амиды и сложные эфиры, так и по спиртовым группам – простые и сложные эфиры. Сложные эфиры пантотеновой кислоты, образованные по гидроксильной группе, не активны, потому что биологическая активностью проявляется только при наличии обеих свободных гидроксильных групп. Биологической активностью обладают соли и сложные эфиры, образованные по карбоксильной группе, например, этиловый эфир. Замещение карбоксильной группы на оксиметильную в пантотеновой кислоте ведет к полному сохранению витаминной активности, а образующийся D-пантотенол применяется при различных кожных повреждениях.
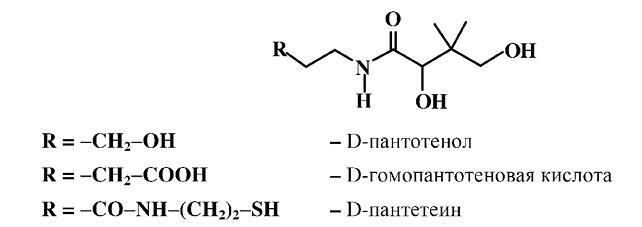
Природным гомологом пантотеновой кислоты является D-гомопантотеновая кислота, представляющая собой соединение, в котором β-аланин заменен на γ-аминомасляную кислоту. D-гомопантотеновая кислота широко распространена в природе и используется в медицине для лечения нервных и психических заболеваний. Ее комплекс с холином обладает витаминной активностью и витамина В3, и холина (витамин В4).
Наиболее важную биологическую активность витамин В3 проявляет в составе коферментных систем. Простейшим биологически активным производным витамина В3 является пантетеин, в который пантотеновая кислота превращается, попадая в организм человека. Пантетеин – продукт конденсации пантотеновой кислоты с β-меркаптоэтиламином, он входит в состав кофермента А.
Кофермент А (КоА, КоА–SH) играет важную роль во многих биохимических процессах, являясь составной частью ферментов биологического ацилирования, он занимает центральное место в процессах жирового и углеводного обмена. В коферменте А первичный гидроксил пантотеновой кислоты фосфорилирован трифосфоаденозином, а карбоксил амидирован β-меркаптоэтилаланином.
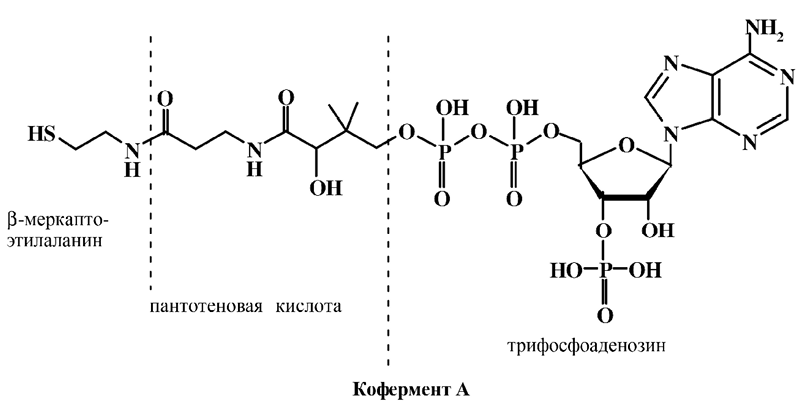
Среди производных кофермента А, участвующих в обмене веществ, наибольшее значение имеет ацетил-КоА, поскольку он объединяет пути обмена жиров, углеводов и некоторых аминокислот. С одной стороны, связанный с коферментом А остаток уксусной кислоты превращается в цикле трикарбоновых кислот в конечные продукты окисления с оптимальным энергетическим выходом. С другой стороны, ацетил-КоА является исходным субстратом при биосинтезе большого числа разнообразных соединений – ВЖК, стероидов, гистамина, ацетилхолина, гемоглобина, каротиноидов и гиббереллинов, принимает участие в построении корринового остова витамина В12.
В свободной форме пантотеновая кислота встречается редко, но как составная часть кофермента А широко распространена. Витамин В3 синтезируется зелеными растениями и некоторыми микроорганизмами, в том числе, и микрофлорой млекопитающих и человека. Наиболее богатые источники витамина – это дрожжи, горох, овес, яйцо, печень, почки (табл. 2.2.11). Кулинарная обработка не вызывает заметного разрушения пантотеновой кислоты, однако до 30% ее теряется при варке из-за перехода в воду.
Таблица 2.2.11. Содержание витамина В3 в продуктах питания
|
Наименование продукта |
Массовая доля, мг% |
|
Куриная печень |
9,70 |
|
Печень говяжья |
6,80 |
|
Печень свиная |
5,80 |
|
Пивные дрожжи |
4,20 |
|
Желток куриного яйца |
3,80 |
|
Почки свиные |
3,00 |
|
Пшеничные отруби |
2,90 |
|
Арахис |
2,80 |
|
Грибы |
2,10 |
|
Соя |
1,75 |
|
Чечевица |
1,40 |
|
Фасоль |
1,20 |
|
Авокадо |
1,10 |
|
Рис нешлифованный |
1,10 |
|
Цветная капуста |
1,00 |
|
Крупа овсяная |
0,90 |
|
Горошек зеленый |
0,80 |
|
Говядина |
0,50 |
|
Крупа рисовая |
0,40 |
|
Молоко жирное |
0,38 |
|
Картофель |
0,30 |
|
Творог жирный |
0,28 |
|
Морковь |
0,26 |
|
Томаты |
0,25 |
|
Апельсины |
0,25 |
|
Бананы |
0,25 |
|
Белок куриного яйца |
0,24 |
|
Лимон |
0,20 |
|
Лук репчатый |
0,10 |
|
Яблоки |
0,10 |
При дефиците витамина В3 у животных возникает дерматит, наблюдается выпадение шерсти и ряд других осложнений, в том числе нарушение функций спинного мозга. У человека дефицит витамина В3 бывает редко, так как кишечная палочка (микрофлора) вырабатывает достаточное количество витамина В3. Гиповитаминоз возникает лишь при длительном неполноценном питании (чаще всего при очень низком содержании в пище белков, жиров, витамина С и витаминов группы В). Пантотеновая кислота необходима для нормального усвоения и обмена фолиевой кислоты и биотина, влияет на обмен аскорбиновой кислоты. Суточная потребность в витамине В3 для взрослого человека составляет 4–7 мг/сут. (табл. 2.2.12).
Таблица 2.2.12. Рекомендуемая потребность в витамине В3, мг/сут
|
Категория |
Возраст, года |
Россия |
США |
|
Грудные дети |
0–½ |
2 |
2 |
|
½–1 |
3 |
3 |
|
|
Дети |
1–3 |
3 |
3–4 |
|
4–6 |
4 |
3–4 |
|
|
7–10 |
5 |
4–5 |
|
|
Мужчины |
11–14 |
4–7 |
4–7 |
|
15–18 |
4–7 |
4–7 |
|
|
19–24 |
4–7 |
4–7 |
|
|
25–50 |
4–7 |
4–7 |
|
|
>51 |
4–7 |
4–7 |
|
|
Женщины |
11–14 |
4–7 |
4–7 |
|
15–18 |
4–7 |
4–7 |
|
|
19–24 |
4–7 |
4–7 |
|
|
25–50 |
4–7 |
4–7 |
|
|
>51 |
4–7 |
4–7 |
|
|
Беременные и кормящие матери |
4–7 |
4–7 |
В промышленности пантотеновую кислоту получают путем химического синтеза. Выпускают витамин В3 в виде кальциевой соли – кальция пантотената. Кальциевые и натриевые соли пантотеновой кислоты хорошо растворимы в воде. Устойчивы, особенно в кислой среде, водные растворы D-пантенола.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ВИТАМИНА В3
|
Показатель |
Характеристика |
|
|
Пантотеновая кислота |
Пантотенат калия |
|
|
Формула |
С9Н17О5N |
(С9Н16О5N)2Са |
|
Молекулярная масса |
219,2 |
476,53 |
|
Температура плавления, о С |
Гигроскопичное масло |
196 (с разл.) |
|
Состояние вещества |
Бледно-желтое масло |
Бесцветные кристаллы |
|
Растворимость |
В воде, этаноле, этилацетате, диоксане |
В воде (14,5 г/100 мл), этаноле, этилацетате, диоксане |
|
Удельное вращение, |
+37,5 (вода) |
28, 4 (вода) |
|
Биологическая активность, % |
100 |
100 |
|
Максимум поглощения, нм |
550 |
|
В свободном виде пантотеновая кислота химически нестойкая и представляет собой гигроскопичное масло, легко гидролизующееся в кислой или щелочной среде до пантолактона и β-аланина.
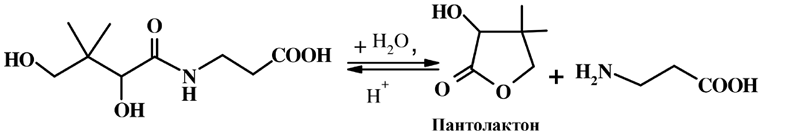
Образующийся при щелочном или кислотном гидролизе пантотеновой кислоты пантолактон легко переходит в пантоевую кислоту, которая способна взаимодействовать с 2-, 7-дигидрокси-нафталином в присутствии концентрированной серной кислоты с образованием окрашенного в зелено-желтый цвет соединения. Данную реакцию используют для количественного спектрофотометрического определения пантотеновой кислоты (λmax = 464 нм).
Витамин В5, также называется витамином РР (от англ. Pellagra preventing factor – антипеллагрический фактор), ниацином. Ниацин или никотиновая кислота и его амид-ниацинамид обладают одинаковой витаминной активностью.
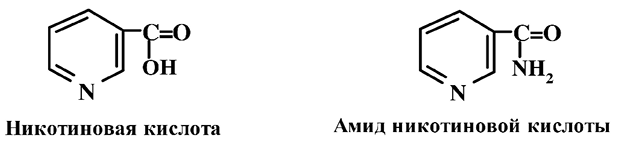
Никотиновая кислота впервые была выделена из дрожжей и рисовых отрубей в 1911–1912 годах К. Фуком. Собственно противопеллагрическим витамином является никотинамид, он входит в виде кофермента в состав ферментативных систем. А никотиновую кислоту можно рассматривать как провитамин, превращающийся в никотинамид в процессе обмена в организме человека. Для никотиновой кислоты и никотинамида характерна способность к образованию четвертичных аммониевых солей, в которых водородные атомы в a- и g-положениях пиридинового кольца обладают повышенной подвижностью. Этим и объясняются восстановительные свойства четвертичных солей никотинамида, определяющие механизм ферментативного действия никотинамидных коферментов.
Никотиновая кислота относится к витаминам, широко распространенным в растительных и животных организмах. Много витамина В5 содержится в кукурузе, сорго, дрожжах, грибах, мясе, печени, почках и рыбе (табл. 2.2.13). Однако в зерне кукурузы и других зерновых никотиновая кислота частично находится в неусвояемой связанной форме.
Таблица 2.2.13. Содержание витамина В5 в продуктах питания
|
Наименование продукта |
Массовая доля, мг% |
|
Арахис |
18,9 |
|
Кофе в зернах |
17,0 |
|
Печень свиная |
12,0 |
|
Дрожжи прессованные |
11,4 |
|
Печень говяжья |
9,0 |
|
Ставрида океаническая |
7,3 |
|
Мясо кролика |
6,2 |
|
Почки говяжьи |
5,7 |
|
Пшеница (зерно), мягкие сорта |
5,3 |
|
Пшеница (зерно), твердые сорта |
4,9 |
|
Говядина |
4,7 |
|
Рис (зерно) |
4,7 |
|
Крупа гречневая ядрица |
4,2 |
|
Гречиха, зерно |
3,9 |
|
Мозги говяжьи |
3,0 |
|
Кальмар (мясо) |
2,5 |
|
Горох лущеный |
2,4 |
|
Треска |
2,3 |
|
Кукуруза (зерно) |
2,3 |
|
Горох (зерно) |
2,2 |
|
Фасоль |
2,1 |
|
Крупа перловая |
2,0 |
|
Крупа рисовая |
1,6 |
|
Крупа пшеничная |
1,4 |
|
Мука пшеничная, в/с |
1,2 |
|
Чеснок |
1,2 |
|
Картофель отварной |
1,1 |
|
Грецкие орехи |
1,0 |
|
Хлеб ржаной формовой |
1,0 |
|
Капуста белокочанная |
0,7 |
|
Шиповник |
0,6 |
|
Помидоры грунтовые |
0,5 |
|
Сыр домашний жирностью 4% |
0,5 |
|
Тыква |
0,5 |
|
Творог нежирный |
0,4 |
|
Масло сливочное |
0,1 |
Биохимическую роль витамин В5 выполняет в виде коферментов: никотинамидадениндинуклеотида (НАД+) и никотинамидадениндинук-леотида фосфата (НАДФ+).
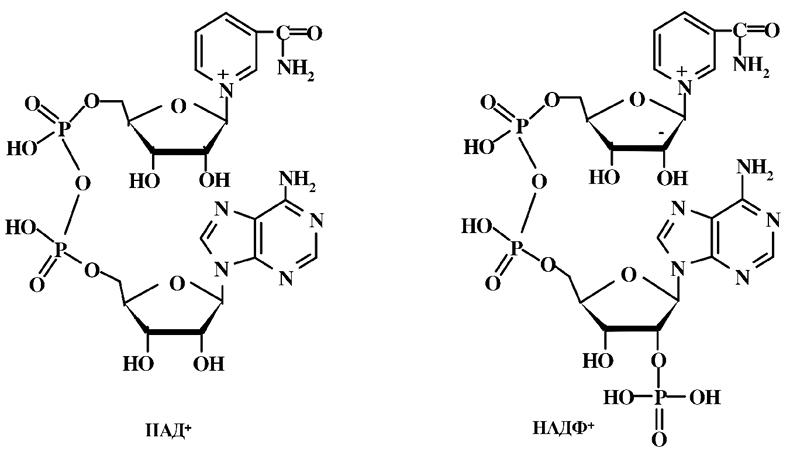
Коферменты НАД+ и НАДФ+ входят в состав многочисленной группы оксидоредуктаз (дегидрогеназ), принимающих участие в различных биохимических процессах: дегидрирования, окисления, N-алкилирования, фотосинтеза, дыхания, энергетическом обмене и других процессах. Функция данных коферментов заключается в обратимом присоединении водорода:

и передаче его промежуточному акцептору, как правило, флавиновым ферментам. В ходе окислительно-восстановительных реакций НАД+ и НАДФ+ реагируют в составе ферментов стереоспецифически, отнимая от органического субстрата гидрид-ион и переходя в восстановленную форму (НАДН+Н+) и (НАДФН+Н+). При этом происходит восстановление пиридинового кольца с нарушением ароматической системы, и азот теряет положительный заряд. Обратная реакция также стереоспецифична.
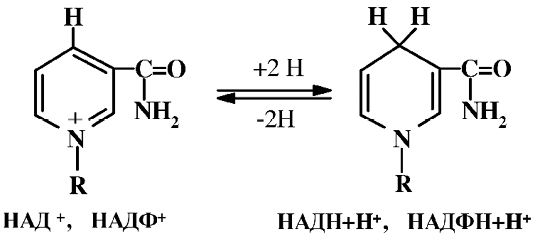
НАД+ и НАДФ+ выполняют в организме разные функции. Восстановленная форма кофермента (НАДН+Н+) чаще всего отдает свой водород ферментам дыхательной цепи, при этом взаимодействие с кислородом до образования воды сопряжено с синтезом АТФ. (НАДФН+Н+) служит для доставки «восстановленных эквивалентов» в процессах биосинтеза, который сопряжен с распадом АТФ.
Биосинтез никотиновой кислоты в организме человека и многих животных может совершаться при наличии в пище значительного количества незаменимой аминокислоты – триптофана и при участии пиридоксалевых ферментов (предшественник кофермента – витамин В6). Выход данной реакции небольшой, в организме человека он составляет 1 мг никотиновой кислоты из 60 мг триптофана. В соответствии с этим потребность человека в витамине В5 принято выражать в ниациновых эквивалентах (НЭ):
1 НЭ =1 мг никотиновой кислоты или 60 мг L-триптофана.
Дефицит витамина В5 вызывает снижение жизненного тонуса, вялость, быструю утомляемость, депрессию, расстройства желудка и пониженную сопротивляемость инфекциям. Длительный дефицит витамина В5 в диете вызывает тяжелое заболевание пеллагра, которая проявляется в своеобразной шершавости кожи и изъязвлении языка. Заболевание сопряжено с поражением желудочно-кишечного тракта, нарушениями функций сердечно-сосудистой системы, в тяжелых случаях авитаминоза поражается центральная нервная система. Наиболее распространена недостаточность в витамине В5 у беременных женщин. Рекомендуемые суточные нормы для мужчин 14 мг, для женщин – 11 мг. Терапевтические дозы могут быть более высокими (табл. 2.2.14).
Таблица 2.2.14. Рекомендуемая суточная потребность в витамине В5
|
Категория |
Возраст, года |
Суточная потребность, мг/сут |
|
Грудные дети |
0–½ |
5 |
|
½–1 |
6 |
|
|
Дети |
1–3 |
9 |
|
4–6 |
12 |
|
|
7–10 |
7 |
|
|
Мужчины |
11–14 |
17 |
|
15–18 |
20 |
|
|
19–24 |
19 |
|
|
25–50 |
19 |
|
|
>51 |
15 |
|
|
Женщины |
11–14 |
15 |
|
15–18 |
15 |
|
|
19–24 |
15 |
|
|
25–50 |
15 |
|
|
>51 |
13 |
|
|
Беременные |
16 |
|
|
Кормящие матери |
19 |
Никотиновая кислота находит широкое применение для витаминизации хлеба, муки, макаронных изделий и других пищевых продуктов с целью повышения их питательной ценности. Кроме того, сама никотиновая кислота и некоторые ее производные применяются в качестве лекарственных средств. Никотиновая кислота снимает токсические явления, возникающие при приеме сульфаниламидных препаратов и наркотиков, применяется при желудочно-кишечных заболеваниях, болезнях сердца и печени. Никотиновый спирт является сосудорасширяющим средством, оксиниациновая кислота – гиперлипо-протеинемик, кордиамин – аналептик (стимулирует центральную нервную систему) и обладает низкой витаминной активностью (менее 10%).
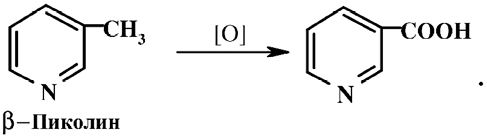
По своей химической структуре витамин В5 – это самый простой и синтетически доступный витамин среди всех витаминов, поэтому выделение никотиновой кислоты из природных источников или продуктов микробиологического синтеза не представляет практического интереса. В промышленности его получают химическим синтезом через производные, содержащие пиридиновое кольцо. Наиболее легкий путь с использованием b-пиколина, который получают из каменноугольной смолы и легко окисляется в никотиновую кислоту:
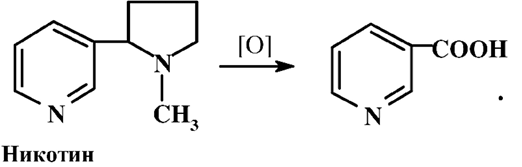
Часто используют метод получения никотиновой кислоты из никотина – отхода табачной продукции, используя в качестве окислителя перманганат калия.
Существуют методы получения никотиновой кислоты из пиридина.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ВИТАМИНА В5
|
Показатель |
Характеристика |
|
|
Никотиновая кислота |
Никотинамид |
|
|
Формула |
C6H5O2N |
C6H6ON2 |
|
Молекулярный вес |
123,11 |
122,12 |
|
Температура плавления, оС |
235,5–236,6 |
128–131 |
|
Растворимость |
растворим в воде (1,7 г/100 мл), этаноле, мало растворим в диэтиловом эфире |
растворим в воде (100 г/100 мл), этаноле (66 г/100 мл), плохо растворим в диэтиловом эфире |
|
рН 1%-го раствора |
3,0 |
6,0 |
|
Максимум поглощения, lmax, нм (ε) |
260 (2800) |
261 (5800) |
|
Удельный показатель поглощения |
227 |
478 |
Никотиновая кислота и ее амид представляют собой бесцветные кристаллические порошки, растворимые в воде. Оба соединения и в твердом виде, и в водных растворах устойчивы к действию кислорода воздуха, света и повышенных температур. Никотиновая кислота стабильна при нагревании в разбавленных растворах кислот и щелочей. В сильнокислых и щелочных растворах при нагревании амид гидролизуется с образованием кислоты.
Для количественного определения ниацина используют химический (качественная реакция с роданбромидом) метод и микробиологический с тест-организмом Lactobacillus arabinosus АТСС 8014. Микробиологический метод прост в исполнении, специфичен, позволяет определять ниацин во всех продуктах без исключения, но длителен, требует соблюдения условий асептики и специальной подготовки исполнителя.
Роданобромидный метод применяют для анализа обогащенных витамином В5 пищевых продуктов, мясных, рыбных, молочных и зерновых продуктов. Он не пригоден для исследования объектов с низким содержанием ниацина и продуктов с высоким содержанием сахаров в связи с недостаточной чувствительностью по сравнению с микробиологическим методом. Метод определения никотиновой кислоты основан на реакции пиридинового кольца с роданбромидом (BrCNS), а затем с ароматическим амином с образованием окрашенного в желтый цвет производного глутаконового альдегида (полиметинового красителя). Интенсивность окраски образующего соединения измеряется колориметрически.
Витамин В6 (адермин) по химической структуре представляет собой три производные пиридина, обладающих витаминной активностью:
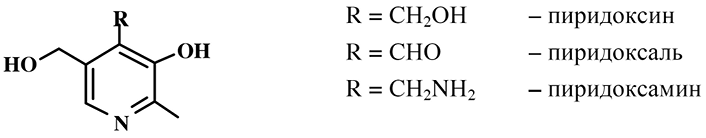
Взаимные превращения пиридоксина, пиридоксаля и пиридоксамина, происходящие в организме и осуществленные химическим путем, можно представить следующей схемой:
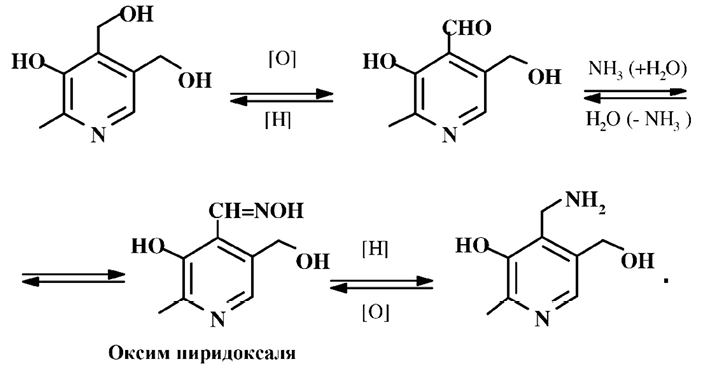
Пиридоксаль является наиболее активной формой витамина, его альдегидная группа обеспечивает разнообразную и высокую химическую активность. Пиридоксин следует рассматривать как провитамин, так как он проявляет витаминные свойства не непосредственно, а превращаясь в организме в пиридоксаль или пиридоксамин. Пиридоксамин образуется при каталитическом гидрировании из оксим пиридоксаля.
Витамин В6 продуцируется разнообразными микроорганизмами и растениями. Богаты витамином В6 дрожжи, субпродукты, зерна пшеницы (табл. 2.2.15). Из трех витамеров витамина В6, находящихся в животных и растительных продуктах на долю пиридоксаля и пиридоксамина приходится более 80%, где они встречаются, как правило, в химически связанным с белками виде, на долю пиридоксина приходится около 20%.
Таблица 2.2.15. Содержание витамина В6 в продуктах питания
|
Наименование продукта |
Массовая доля, мг% |
|
Фасоль |
0,90 |
|
Грецкий орех |
0,80 |
|
Печень говяжья |
0,70 |
|
Фундук |
0,70 |
|
Сардина |
0,70 |
|
Петрушка (корень) |
0,60 |
|
Чеснок (луковица) |
0,60 |
|
Дрожжи прессованные |
0,58 |
|
Рис нешлифованный |
0,55 |
|
Мука пшеничная (обойная) |
0,55 |
|
Крупа ячневая |
0,54 |
|
Рис (зерно) |
0,54 |
|
Мясо птицы |
0,52 |
|
Пшено (крупа) |
0,52 |
|
Почки говяжьи |
0,50 |
|
Сердце говяжье |
0,50 |
|
Перец сладкий красный |
0,50 |
|
Тунец |
0,43 |
|
Рожь (зерно) |
0,41 |
|
Арахис |
0,40 |
|
Говядина, 1 категории |
0,37 |
|
Мука ржаная обойная |
0,35 |
|
Баранина, 1 категории |
0,32 |
|
Свинина жирная |
0,30 |
|
Изюм |
0,27 |
|
Картофель |
0,25 |
|
Мука ржаная, обдирная |
0,25 |
|
Бифидолакт |
0,24 |
|
Цветная капуста |
0,21 |
|
Творог нежирный |
0,19 |
|
Кальмар |
0,18 |
|
Мозги говяжьи |
0,18 |
|
Петрушка (зелень) |
0,18 |
|
Мука пшеничная, в/с |
0,17 |
|
Капуста |
0,16 |
|
Сыр «Рокфор» |
0,15 |
|
Яйцо куриное (белок) |
0,14 |
|
Лук репчатый |
0,12 |
Витамин В6, являясь водорастворимым витамином, играет ключевую роль в качестве кофермента в различных метаболических процессах. Коферментной формой витамина В6 выступает пиридоксальфосфат:
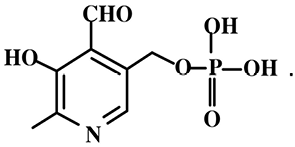
Известно более 20 пиридоксалиевых ферментов, катализирующих ключевые реакции азотистого метаболизма во всех живых организмах. Фосфаты пиридоксаля и пиридоксамина входят в виде простетической группы в состав аминотрансфераз (обратимый перенос аминогруппы от аминокислот на α-кетокислоту), и декарбоксилаз аминокислот (необратимое отщепление СО2 от карбоксильной группы аминокислот с образованием биогенных аминов). Установлена коферментная роль пиридоксальфосфата в ферментативных реакциях неокислительного дезаминирования серина и треонина, превращения серосодержащих аминокислот, взаимопревращения серина и глицина. Важную роль витамин В6 играет в реакции превращения L-триптофана в никотиновую кислоту. Пиридоксальфосфат участвует в метаболизме жирных кислот, стероидных гормонов, утилизации ненасыщенных жирных кислот.
Вследствие широкого участия пиридоксальфосфата в процессах обмена при недостаточности витамина В6 отмечаются разнообразные нарушения метаболизма аминокислот. Дефицит витамина у животных вызывает дерматиты, судороги, анемию и задержку роста, особенно молодого организма. У взрослых людей авитаминоз обычно возникает редко, так как в организм человека значительная часть витамина В6 поступает за счет деятельности кишечной микрофлоры. Авитаминоз характерен для алкоголиков и больных туберкулезом. У детей при неполноценном вскармливании может возникнуть дефицит витамина В6, который сопровождается конвульсиями.
Суточная потребность в пиридоксине для человека точно не установлена в связи с тем, что он синтезируется микрофлорой кишечника в количествах, частично покрывающих потребности организма в нем. Суточная норма витамина В6 составляет 1,2–2,2 мг (табл. 2.2.16), терапевтические дозы могут быть выше.
Таблица 2.2.16. Рекомендуемая потребность в витамине В6 , мг/сут
|
Категория |
Возраст, года |
Россия |
Великобритания |
США |
|
Грудные дети |
0–½ |
0,5 |
0,2 |
0,3 |
|
½–1 |
0,6 |
0,3–0,4 |
0,6 |
|
|
Дети |
1–3 |
0,9 |
0,7 |
1,0 |
|
4–6 |
1,3 |
0,91 |
1,1 |
|
|
7–10 |
1,6 |
1,0 |
1,4 |
|
|
Мужчины |
11–14 |
1,8 |
1,2 |
1,7 |
|
15–18 |
2,0 |
1,5 |
2,0 |
|
|
19–59 |
2,0 |
1,4 |
2,0 |
|
|
60–74 |
2,2 |
1,4 |
2,0 |
|
|
>75 |
2,2 |
1,4 |
2,0 |
|
|
Женщины |
11–14 |
1,6 |
1,0 |
1,5 |
|
15–18 |
1,6 |
1,2 |
1,6 |
|
|
19–59 |
1,8 |
1,2 |
1,6 |
|
|
60–74 |
1,8 |
1,2 |
1,6 |
|
|
>75 |
2,0 |
1,2 |
1,6 |
|
|
Беременные |
+0,3 |
>доза |
2,2 |
|
|
Кормящие |
+0,5 |
>доза |
2,1 |
Пиридоксин и пиридоксальфосфат применяют в медицинской практике для лечения кожных и неврологических заболеваний, а также в гинекологии и гематологии. Для некоторых микроорганизмов (молочнокислых бактерий) и растений (томатов, подсолнечника, хлопчатника, корнеплодов) пиридоксин является ростовым фактором.
В промышленности витамин В6 и его коферментные формы получают химическим синтезом. Разработаны разнообразные методы химического синтеза пиридоксин гидрохлорида.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ВИТАМИНА В6
|
Показатель |
Характеристика |
|
|
Пиридоксин |
Пиридоксин гидрохлорид |
|
|
Формула |
С8Н11О3N |
С8Н11О3N×HCl |
|
Молекулярный вес |
169,2 |
203,6 |
|
Температура плавления, оС |
160 |
203–206 (с разл.) |
|
Растворимость |
Хорошо растворим в воде, этиловом спирте, хуже в диэтиловом эфире, хлороформе |
Хорошо растворим в воде (22 г/100 мл), менее в спирте, мало в ацетоне, нерастворим в диэтиловом эфире |
|
рН 1%-го раствора |
3,0–3,2 |
|
|
Максимум абсорбции |
390(200) |
270–370 (в 0,01 н НСl) |
|
Удельный показатель |
399 |
9,8 |
Пиридоксин, пиридоксаль, пиридоксамин устойчивы к действию концентрированной соляной кислоты и нагреванию в щелочных растворах. Они нестабильны к окислителям (перекись водорода, марганцевокислый калий), их растворы неустойчивы к свету при нейтральном рН среды. Все три формы витамина В6 как производные пиридина способны образовывать соли, легко растворимые в воде. В качестве аптечного препарата выступает пиридоксин гидрохлорид, он стабилен при действии повышенных температур и кислорода воздуха. На свету пиридоксин разрушается в щелочных, нейтральных или слабокислых растворах.
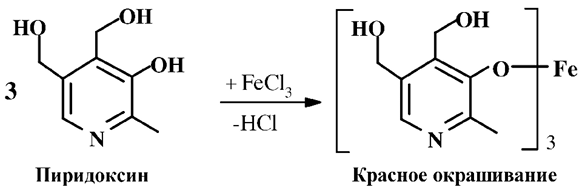
Для количественного определения витамина В6 широкое распространение в последнее время получили микробиологические методы, использующие микроорганизмы, для которых витамин является фактором роста (например, L. casei, St. faecalis.). В основе химического метода анализа лежит общая для фенолов и всех представителей витамина В6 реакция подлинности с хлорным железом (III) с образованием соли красного цвета.
Витамеры также легко вступают в реакцию электрофильного замещения по свободному в пара-положении фенольному гидроксилу. При взаимодействии пиридоксина с 2,6-дихлорхинон-N-хлоримидом в щелочной среде образуется окрашенный в синий цвет индофенольный краситель, растворимый в бутиловом спирте:
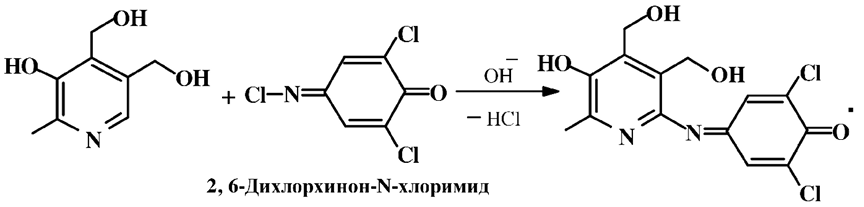
Пиридоксин легко вступает в реакцию с солями диазония с образованием окрашенных в красный цвет азокрасителей:
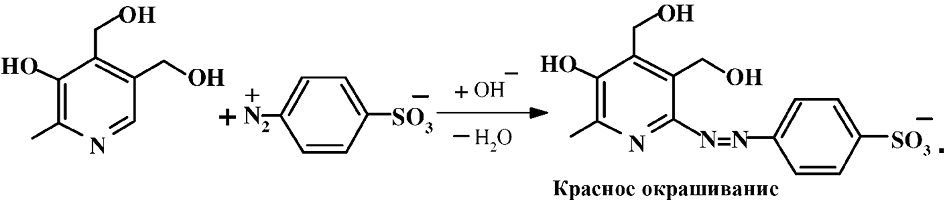
Последняя реакция лежит в основе колориметрического метода анализа витаминов группы В6. В качестве реактива используют соль диазония, полученную из сульфаниловой кислоты.
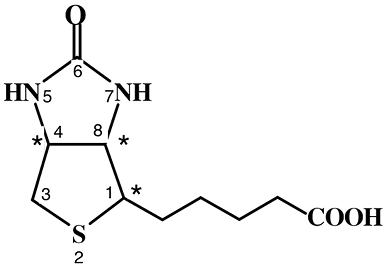
Витамин В7 (биотин, витамин Н). Биотин – циклическое производное мочевины, содержащее конденсированную гетероциклическую систему имидазолового и тиофенового колец и остаток н-валериановой кислоты. Благодаря наличию трех асимметрических атомов углерода (С1, С4, С8), для биотина возможны восемь оптических изомеров и четыре рацемата. Биологической активностью обладает только природный D(+)-биотин, остальные изомеры витаминными свойствами не обладают.
Биологически активной формой витамина Н выступает коферментная форма – N5-карбоксибиотин, связанный через ε-аминогруппу лизина с рядом ферментов.
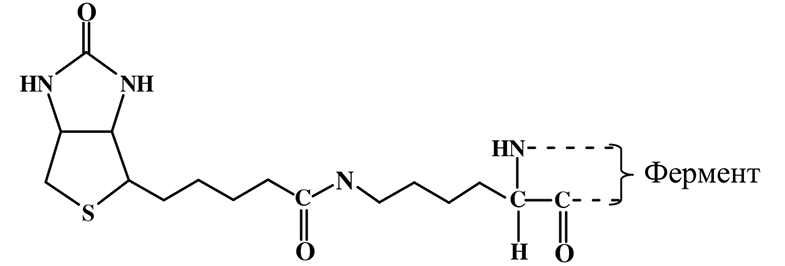
В форме конъюгата «активного карбоксила» биотин переносит карбоксильную группу (НСО3) в обратимых реакциях карбокси- лирования-декарбоксилирования и транскарбоксилирования в процессах глюконеогенеза, биосинтеза жирных кислот, метаболизма аминокислот.
Основными источниками биотина являются продукты животного происхождения. В органах животных (печени, почках), дрожжах, семенах растений биотин присутствует в связанной с белком форме, в то время, как, в овощах, фруктах, рисовых отрубях, молоке – в свободном виде (табл. 2.2.17).
Таблица 2.2.17. Содержание витамина В7 в продуктах питания
|
Наименование продукта |
Массовая доля, мкг% |
|
Патока |
108,0 |
|
Печень говяжья |
98,0 |
|
Почки говяжьи |
88,0 |
|
Арахис |
40,0 |
|
Пшеничные отруби |
36,0 |
|
Яичный желток |
30,0 |
|
Дрожжи прессованные |
30,0 |
|
Капуста белокочанная |
24,0 |
|
Кукуруза |
21,0 |
|
Яйцо куриное |
20,2 |
|
Крупа овсяная |
20,0 |
|
Горох лущеный |
19,5 |
|
Цветная капуста |
17,0 |
|
Треска |
10,0 |
|
Шпинат |
7,0 |
|
Моги говяжьи |
6,1 |
|
Сыр камамбер |
5,6 |
|
Горошек зеленый |
5,3 |
|
Мука пшеничная 2 cорта |
4,8 |
|
Творог жирный |
5,1 |
|
Сливки, 20% жирности |
4,0 |
|
Лук |
4,0 |
|
Кефир |
3,5 |
|
Козье молоко |
3,1 |
|
Капуста краснокочанная |
2,9 |
|
Макароны, высш.сорта |
2,0 |
|
Персики |
2,0 |
|
Хлеб подовой |
1,9 |
|
Томаты |
1,2 |
|
Апельсины |
1,0 |
|
Сок яблочный |
1,0 |
|
Лук репчатый |
0,9 |
|
Лук зеленый |
0,9 |
|
Огурцы |
0,9 |
|
Морковь |
0,6 |
|
Яблоки |
0,3 |
|
Абрикосы |
0,3 |
|
Капуста белокочанная |
0,1 |
Биотин – важный фактор питания и играет существенную роль в метаболизме человека. Дефицит биотина приводит к депигментации кожи и развитию специфического дерматита, а также торможению роста и нервным расстройствам. В тяжелых случаях возникают поражения сосудов и печени, нарушается процесс утилизации глюкозы в организме, повышается уровень холестерола.
Установлена связь биотина с другими витаминами: аскорбиновой кислотой, тиамином, пантотеновой кислотой, оксикобаламином и особенно фолиевой кислотой. При недостаточности биотина нарушается утилизация организмом фолиевой кислоты и превращение ее в активные коферментные формы. Универсальным ингибитором биотина является яичный белок авидин, он стехиометрически связывает эквимолярные количества биотина, образуя прочный комплекс, который не расщепляется ферментами пищеварительного тракта. Содержится авидин в яичном белке курицы, гуся, утки, индейки. Поэтому при высоком содержании в рационе данных продуктов может возникнуть недостаток биотина. Комплекс авидина с биотином термически устойчив и полностью диссоциируется при нагревании до температуры 120 °С в течение 15 минут.
Потребность в биотине у человека трудно оценить, так как он продуцируется микрофлорой кишечника, однако если микрофлора нарушена, необходим дополнительный прием, лечебная доза достигает 5–10 мг/сут. Минимальная суточная потребность витамина Н составляет 150–200 мкг/сут. (табл. 2.2.18). В период беременности и лактации потребность в биотине у женщин повышается до 250–300 мкг/сут. Получают биотин в промышленности путем химического синтеза.
Таблица 2.2.18. Рекомендуемая суточная потребность в витамине В7
|
Категория |
Возраст, года |
Потребность в витамине В7, мкг/сут |
|
Грудные дети |
0–½ |
10 |
|
½–1 |
15 |
|
|
Дети |
1–3 |
20 |
|
4–6 |
25 |
|
|
7–10 |
30 |
|
|
Мужчины |
11–75 |
30–100 |
|
Женщины |
11–75 |
30–100 |
МЕТОДЫ ОПРЕДЕЛЕНИЯ ВИТАМИНА В7
|
Показатель |
Характеристика |
|
Формула |
С10Н16О3N2S |
|
Молекулярный вес |
214 проверить 244,3 |
|
Температура плавления, оС |
232,5 |
|
Растворимость |
Растворимость в воде 0,02 г/100 мл, хорошо растворим в разбавленных щелочах |
|
Оптическая активность |
[α]D20 +92 ( в 0,1 н растворе NaOH) |
|
Максимум абсорбции λmax, нм |
204 |
Слабокислые и слабощелочные растворы витамина относительно стабильны, однако он разрушается в растворах концентрированных кислот и щелочей. Биотин термоустойчив, при действии УФ-света постепенно разрушается. Специфических полос поглощения биотина в УФ-области не обнаружено.
Для количественного определения биотина предложены колориметрические методы, основанные на аналитических реакциях с характерными для него функциональными группами. Один из них основан на цветной реакции нингидрина с диаминокарбоновой кислотой, образующейся при кислотном гидролизе биотина. Второй – на специфической цветной реакции уреидного цикла биотина с п-диметиламино-циннамальдегидом. Чувствительность данных методов невелика – 10–100 мкг/мл.
Большей чувствительностью (0,025–0,5 нг/мл) отличаются микробиологические методы, основанные на ростовой реакции микроорганизмов на биотин и различаемые по виду используемых тест- организмов. Интенсивность роста микроорганизмов определяют нефелометрическим методом.
В связи с тем, что большое число микроорганизмов требуют для своего роста биотин, многие из них могут быть использованы в качестве тест-организмов. Наибольшее применение нашли: Lactobacillum planetarium 8014 ATCC, Saccharomyces cerevisiae 7754 ATCC, Neurospora crassa и др. Недостатком микробиологического метода является способность тест-микроорганизмов использовать не только биотин, но и его биологически неактивные аналоги и метаболиты. В этой связи в последнее время для анализа биотина большее применение нашел иммуноферментный метод анализа.
Витамин В9 (Вс, фолиевая кислота, фолиум-лист) – группа витаминов, основу структуры которых составляет фолиевая (птероилглутаминовая) кислота. Молекула фолиевой кислоты состоит из трех фрагментов. Это птеридин – бициклическая конденсированная система пиримидинового и пиразинового колец, п-аминобензойная кислота и L-глутаминовая кислота.
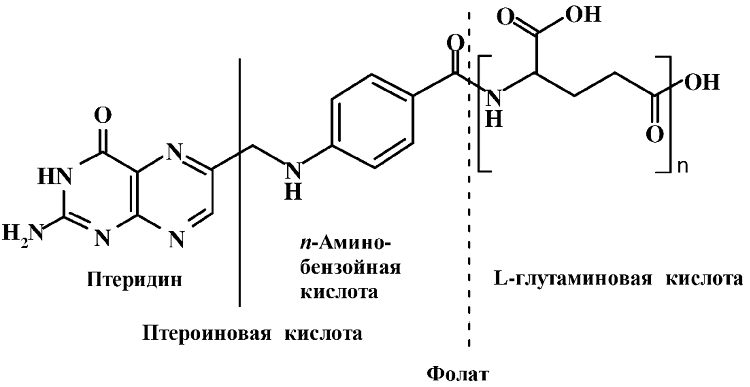
n=1 – витамин В9 (фолиевая кислота, птероилглутаминовая кислота);
n= 2–7 – его конъюгаты.
Большинство природных птеридиновых соединений являются производными 2–амино-4-оксиптеридина, называемого птерин и имеющего лактамную таутомерную форму:
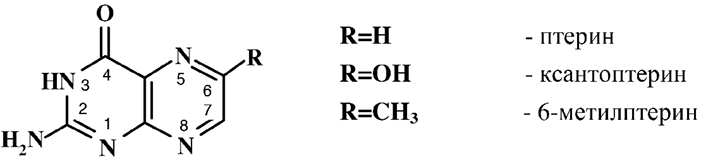
Птериновые соединения были известны как природные красящие вещества, выделенные из крыльев бабочек.
Помимо фолиевой кислоты, содержащей один остаток глутаминовой кислоты, известны различные конъюгированные формы (конъюгаты) с 2–7 остатками глутаминовой кислоты и ее эфиры, имеющие общее название фолаты. Фолаты широко распространены в растительных и животных тканях.
Таблица 2.2.19. Содержание витамина В9 в продуктах питания
|
Наименование продукта |
Массовая доля, мкг% |
|
Дрожжи прессованные |
550 |
|
Печень говяжья |
240,0 |
|
Соя |
200,0 |
|
Печень трески |
110,0 |
|
Петрушка (зелень) |
110,0 |
|
Шпинат |
80,0 |
|
Грецкие орехи |
77,0 |
|
Фундук |
68,0 |
|
Почки |
56,0 |
|
Почки говяжьи |
56,0 |
|
Мука ржаная, обойная |
55,0 |
|
Мука ржаная, обдирная |
50,0 |
|
Салат |
48,0 |
|
Мука пшеничная, обойная |
40,0 |
|
Пшено (крупа) |
40,0 |
|
Грибы белые (свежие) |
40,0 |
|
Рис (зерно) |
35,0 |
|
Творог жирный |
35,0 |
|
Капуста брюссельская |
31,0 |
|
Шпик свиной |
30,0 |
|
Крупа овсяная |
29,0 |
|
Крупа перловая |
24,0 |
|
Сыр «Российский» |
23,5 |
|
Крупа «Геркулес» |
23,0 |
|
Капуста цветная |
23,0 |
|
Мука пшеничная, в/с |
27,1 |
|
Крупа рисовая |
19,0 |
|
Баклажаны |
18,5 |
|
Лук зеленый |
18,0 |
|
Перец сладкий красный |
17,0 |
|
Тыква |
14,0 |
|
Свекла |
13,0 |
|
Зеленый горошек |
12,0 |
|
Треска |
11,3 |
|
Кефир жирный |
7,8 |
|
Яйцо куриное (желток) |
1,1 |
В связи с тем, что птеридиновое кольцо в организме человека не синтезируется, то основным источником витамина В9 в организме человека является пища. В пищевых продуктах основная часть фолатов представлена полиглутаматами, которыми богаты печень, почки, мышцы, бобовые, сырой картофель и зародыш пшеницы (табл. 2.2.19). Доля «свободных» фолатов (моно-, ди-, и триглутаматы) в продуктах питания не более 30%. Свободная фолиевая кислота встречается в листовых овощах, особенно богат шпинат.
Метаболической активностью обладает не сама фолиевая кислота, она лишь выступает предшественником коферментой восстановленной формы – 5, 6, 7, 8-тетрагидрофолиевой кислоты (ТГФК, фолиновой кислоты), которая принимает участие во многих основных метаболических реакциях. По активности фолиновая кислота в 100 раз сильнее фолиевой кислоты. Восстановление фолиевой кислоты протекает путем присоединения по двум двойным связям четырех атомов водорода в положениях 5–8 пиразинового цикла под действием НАДФ-зависимых дегидрогеназ.
|
R1 , R2 =H |
– тетрагидрофолиевая кислота (фолиновая кислота); |
|
R1=CHO; R2=H |
– 5-формил-ТГФК; |
|
R1=H; R2=CHO |
– 10-формил-ТГФК; |
|
R1= – CH=NH; R2=H |
– 5-формимино-ТГФК; |
|
R1=CH2OH; R2=H |
– 5-оксиметил-ТГФК; |
|
R1+ R2= –CH2– |
– 5, 10-метилен-ТГФК; |
|
R1+ R2= –CH= |
– 5, 10-метенил-ТГФК. |
Общее название соединений с биологической активностью ТГФК – фолацины. Биологическая роль фолацинов определяется наличием в молекуле активных центров N5 и N10, способных связывать и переносить одноуглеродные радикалы на подходящие акцепторы. В разнообразных биохимических превращениях, включаясь в состав ТГФК, участвуют шесть одноуглеродных групп: формильная (–СНО), метильная (–СН3), метиленовая (–СН2–), метенильная (–СН=), оксиметильная (–СН2ОН) и формиминовая (–CH=NH). В составе ферментных систем витамин В9, например, участвует в метаболизме некоторых аминокислот (серина, метионина, глицина), синтезе пуриновых и пиримидиновых оснований, холина. В результате активируются деление клеток и регенеративные процессы.
Интерес к витамину В9 в последнее время резко возрос в связи с распространением гомоцистеиновой теории возникновения атеросклероза. Согласно последней, гомоцистеин – промежуточный продукт обмена аминокислоты метионина – является токсичным и поражает внутреннюю стенку артерий, а организм с помощью холестерола пытается это повреждение заживить. Уровень гомоцистеина повышается при недостатке витамином группы В, прежде всего В9, а также В6 и В12. Эти витамины, являются коферментами, необходимыми для метаболизма гомоцистеина и витамину В9 в этом отношении отводится наиболее важная роль.
Антагонистами фолиевой кислоты (антивитамины В9) являются аминоптерин и аметоптерин:
Аминоптерин и аметоптерин обладают способностью тормозить развитие злокачественных опухолей и применяются при лечении острой лейкемии у детей.
При полноценном и разнообразном питании суточная потребность в витамине В9 – 0,1–0,2 мг/сут. (табл. 2.2.20) полностью удовлетворяется. Кроме того витамин вырабатывается кишечной микрофлорой человека. Однако дефицит фолиевой кислоты является одним из наиболее распространенных гиповитаминозов, особенно у пожилых людей.
Таблица 2.2.20. Рекомендуемая потребность в витамине В9 , мкг/сут
|
Категория |
Возраст, года |
Россия |
Великобритания |
США |
|
Грудные дети |
0–½ |
40 |
50 |
25 |
|
½–1 |
60 |
50 |
35 |
|
|
Дети |
1–3 |
100 |
70 |
50 |
|
4–6 |
200 |
100 |
75 |
|
|
7–10 |
200 |
150 |
100 |
|
|
Мужчины |
11–14 |
200 |
200 |
150 |
|
15–18 |
200 |
200 |
200 |
|
|
19–59 |
200 |
200 |
200 |
|
|
60–74 |
200 |
200 |
200 |
|
|
>75 |
200 |
200 |
200 |
|
|
Женщины |
11–14 |
200 |
200 |
150 |
|
15–18 |
200 |
200 |
180 |
|
|
19–59 |
200 |
200 |
180 |
|
|
60–74 |
200 |
200 |
180 |
|
|
>75 |
200 |
200 |
180 |
|
|
Беременные |
200 |
>доза |
400 |
|
|
Кормящие |
300 |
> доза |
280 |
Причиной гиповитаминоза несколько. Первой причиной является то, что фолаты пищи представлены главным образом в виде полиглутаматов, а всасывание происходит в основном в виде собственно фолиевой кислоты и в меньшей степени – ее диглутамата. Поэтому необходимым условием нормального всасывания витамина В9 является высокая активность фермента, присутствующего в желчи, соке поджелудочной железы и стенке тонкого кишечника и осуществляющего предварительный гидролиз фолатов до фолиевой кислоты. В кишечнике фолиевая кислота восстанавливается до ТГФК и метилируется. Нарушение гидролиза и восстановления фолатов в кишечнике вызывают некоторые заболевания желудочно-кишечного тракта, что ведет к нарушению всасывания витамина.
С другой стороны, эффективность использования фолатов пищи зависит от обеспеченности рациона человека полноценным белком, особенно животного происхождения, и витаминами В12 и С. Определенная роль в удовлетворении потребности в витамине принадлежит кишечной микрофлоре. Интенсивность биосинтеза ей фолатов напрямую зависит от качества пищи, особо благоприятное действие оказывает растительная пища, содержащая значительное количество клетчатки.
И наконец, причиной дефицита витамина В9 является высокая термолабильность фолиевой кислоты. Тепловая обработка продуктов животного происхождения вызывает незначительную потерю фолатов. В то время как длительная кулинарная обработка овощей и особенно круп, ведет к значительным потерям витамина и может достигать 95%. Введение аскорбиновой кислоты предупреждает разрушение фолатов.
Недостаточность фолиевой кислоты в организме человека вызывает нарушение функций кроветворения, уменьшается количество эритроцитов, поэтому витамин В9 необходим для предупреждения малокровия. Он применяется при лечении тяжелых форм малокровия и лучевой болезни. Помимо антианемического действия фолиевая и фолиновая кислоты участвуют в биосинтезе белков и нуклеиновых кислот, в обмене холина, в образовании ряда компонентов нервной ткани и поддерживают иммунную систему. Витамин В9 играет важную роль при беременности, регулирует формирование нервных клеток эмбриона, предотвращает преждевременные роды, рождение недоношенных детей. Поэтому фолиевую кислоту называют главным «женским» витамином.
Фолиевая кислота необходима для обеспечения нормального роста и развития млекопитающих и птиц и широко используется в животноводстве для витаминизации комбикормов. Она устраняет анемию у цыплят, отсюда название Вс (от англ. chiken). Получают фолиевую кислоту в промышленности путем химического синтеза.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ВИТАМИНА В9
|
Показатель |
Характеристика |
|
Формула |
С19Н19О6N7 |
|
Молекулярный вес |
441,1 (оранжево-желтые кристаллы) |
|
Температура плавления, оС |
250°С (разл.) |
|
Растворимость |
В 0,1М раствор NaOH; растворимость в кипящей воде 0,05 г/100 мл |
|
Оптическая активность |
[α]D20 +23 |
|
Максимум абсорбции λmax нм, (ε) при рН 7 |
282, (27000); 350, (7000) |
|
Удельный показатель, поглощения , мл/мкг×см |
612; 159 |
|
Флуоресценция, нм (рН>7) |
363 (первичное); 450–460(вторичное) |
Фолиевая кислота представляет собой желтый или оранжевый порошок, слаборастворимый в воде, 95%-ном спирте, ацетоне, бензоле, эфире и хлороформе. Она мало растворима в разбавленных кислотах, хорошо растворима в щелочах, разрушается в присутствии, окислителей или восстановителей и под действием УФ света. Фолиевая кислота обладает амфотерными свойствами. Для фолиевой кислоты характерны спектры поглощения в УФ-области спектра.
Количественное определение витамина В9 в пищевых продуктах связано со значительными трудностями, так как фолаты обычно присутствуют в связанной форме в виде полиглутаматов. В процессе экстракции для освобождения связанных фолатов используют гидролазы. Образующиеся при этом свободные фолаты склонны к окислению и расщеплению и могут значительно отличаться от исходных фолатов. Большинство активных форм фолатов весьма чувствительны к воздействию кислорода воздуха, света и температуры и легко окисляются с разрывом связей и образованием птеридина и п-аминобензоил-глутаминовой кислоты. Поэтому экстракцию проводят в присутствии антиокислителя – аскорбиновой кислоты. Жесткие условия экстракции могут вызвать изомеризацию некоторых восстановленных фолатов. Из всех производных фолиевой кислоты только 5–формил–ТГФК достаточно стабильна и не подвержена изменениям в процессе выделения.
Для определения фолатов в пищевых продуктах применяют физико-химические и микробиологические методы. Из химических методов получили распространение флуорометрический и спектро-фотометрический, последний используют для анализа лекарственных форм.
В основе спектрофотометрического метода лежат реакции окисления фолиевой кислоты перманганатом калия, диазотирования образующейся пара-аминобензоилглутаминовой кислоты, а затем превращения ее в соль диазония с N-(1-нафтил)-этилендиамином:
Однако ввиду недостаточной специфичности и низкой чувствительности (5 до 20 мкг/мл) этот метод не используют для определения фолатов в пищевых продуктах.
Птерин и его производные, в том числе и фолиевая кислота, образуют нерастворимые в воде окрашенные комплексные соединения с ионами двухвалентных тяжелых металлов (Сu2+, Fe2+, Co2+ и т.д.):
Для количественного определения фолиевой кислоты в пищевых продуктах используют способность птериновой кислоты к флуоресценции.
Витамины группы В12 (кобаламины, антианемический витамин, фактор кроветворения) являются наиболее сложными с химической точки зрения. Строение их было установлено в 1955–1956 годах. Основу структуры витамина В12 составляет коррин-макроцикл с четырьмя атомами азота.
Это планарное ядро, стабилизированное центральным атомом кобальта, связанным с атомами азота четырех восстановленных пиррольных колец, образующих порфириноподобное корриновое ядро. По своему строению коррин близок к порфирину, который составляет основу таких важнейших порфириновых коферментов, как гемм гемоглобина, хлорофилла и цитохромов.
Перпендикулярно корриновому ядру располагается «нуклеотидная» часть, состоящая из бензимидазола, рибозы и остатка фосфата при третьем углеродном атоме, связанная ковалентно с одним из пиррольных циклов и донорно-акцепторной связью с ионами кобальта. Данная структура получила название кобаламин. В различных положениях макроцикла находятся алкильные, амидные и другие заместители. Анионная часть, связанная с кобальтом, располагается по другую сторону корринового ядра.
Многообразие факторов, связанных с активностью витамина В12, определяется тем, что могут варьироваться как анионы при ионе кобальта, так и «нуклеотидная» часть. В качестве анионной группы кобальта в природе встречается оксигруппа (OH–) в оксикобаламине. Для синтетических производных витамина В12 известны кобаламины с другими анион-группами: циананион (CN–) в цианокобаламине, хлоранион (Cl–) в хлоркобаламине, нитританион (NO2–) в нитритокобаламине, сульфитанион (SO22–) в сульфитокобаламине. В качестве «нуклеотидной» части в природных производных помимо 5,6-диметилбензимидазола обнаружены 5-оксибензимидазол или аденин, 2-метиладенин, гипоксантин и метилгипоксантин. Все названные производные обладают меньшей биологической активностью, чем кобаламин.
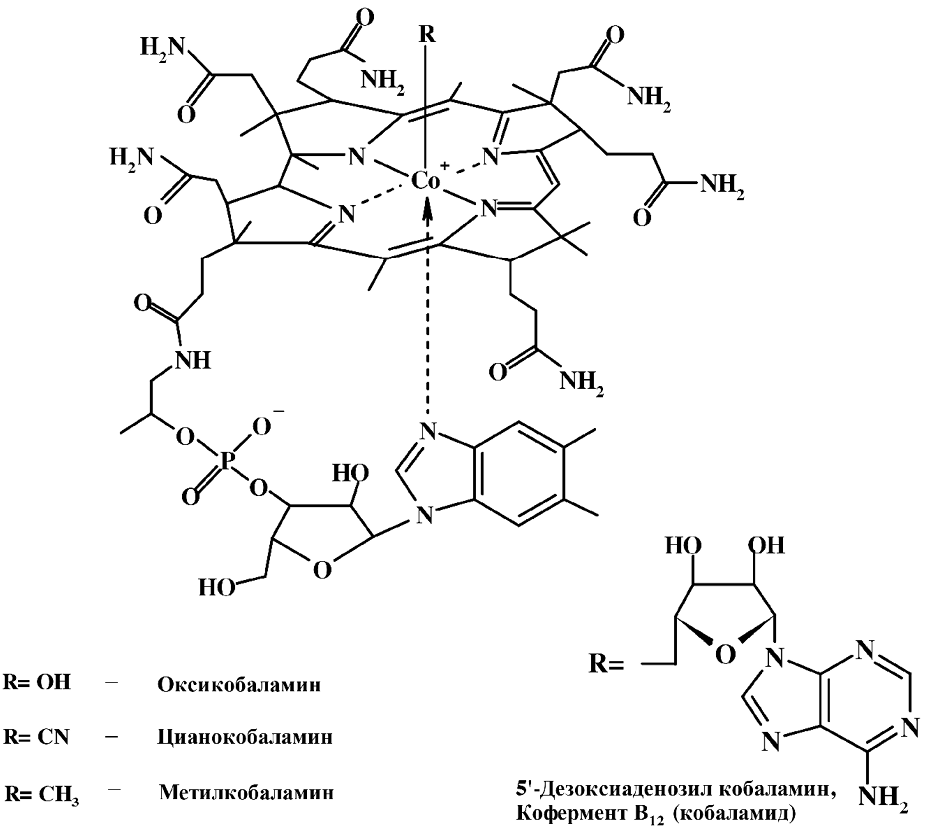
Оксикобаламин является основной природной формой витамина В12, в которой он транспортируется белками крови и депонируется в организме. Он легко обменивает гидроксил на метильную группу с образованием коферментной формы – метилкобаламина, которая выполняет функцию донора метильных групп в некоторых процессах биосинтеза. Например, совместно с витамином В9 катализирует ресинтез метионина из гомоцистеина.
Другая коферментная форма витамина В12 – кобаламид, который в качестве анионной группы содержит нуклеозид – 5’-дезоксиаденозил. Основные биохимические функции кобаламида связаны с метаболизмом аминокислот – диассимиляция избытка незаменимых аминокислот – метионина, валина, изолейцина и лизина. Кобаламид функционирует в реакции изомеризации метилмалоновой кислоты в янтарную. Эта реакция является заключительной стадией окисления жирных кислот с нечетным числом атомов углерода или с разветвленной структурой, боковой цепи холестерола, углеродного скелета некоторых аминокислот (например, валина и треонина).
Цианокобаламин – это метаболически неактивная форма витамина В12, в организме человека цианогруппа замещается на гидроксильную. Цианокобаламин используют при лечении малокровия и некоторых форм рака.
Синтез кобаламина в природе осуществляют только микроорганизмы. Потребность в витамине В12 высока у жвачных животных, при наличии в организме кобальта, витамин синтезируется в рубце жвачных животных его микрофлорой. В продуктах растительного происхождения витамин В12 отсутствует за исключением некоторых видов водорослей и бобовых, у которых он продуцируется клубеньковыми бактериями на корневой системе. Основными пищевыми источниками витамина для человека являются продукты животного происхождения, где он находится в виде комплекса с белком, и продукты обмена микроорганизмов. Наибольшее количество витамина В12 содержится во внутренних органах – почках, печени, кишечнике рыб, печени кита и мясе моллюсков. Богаты витамином В12 желток яиц, пивные дрожжи, рыба, сыр (табл. 2.2.22).
Таблица 2.2.22. Содержание витамина В12 в продуктах питания
|
Наименование продукта |
Массовая доля, мкг% |
|
Печень говяжья |
60,0 |
|
Почки говяжьи |
25,0 |
|
Куриная печень |
24,1 |
|
Устрицы |
21,2 |
|
Сердце говяжье |
10,0 |
|
Яичный желток |
9,26 |
|
Форель |
7,8 |
|
Язык говяжий |
4,7 |
|
Сельдь |
4,3 |
|
Мясо кролика |
4,3 |
|
Мозги |
3,7 |
|
Легкое |
3,3 |
|
Лосось |
3,2 |
|
Говядина, 2 категории |
2,8 |
|
Тунец |
2,8 |
|
Говядина 1 категории |
2,60 |
|
Креветки |
1,90 |
|
Треска |
1,60 |
|
Сыр «Российский» |
1,5 |
|
Сыр «Пошехонский» |
1,4 |
|
Яйцо куриное |
1,26 |
|
Творог |
1,00 |
|
Язык свиной |
0,80 |
|
Курица 1 кат. |
0,55 |
|
Свинина |
0,55 |
|
Сливки |
0,45 |
|
Молоко, жирн. 3,6% |
0,40 |
|
Простокваша |
0,34 |
|
Яичный белок |
0,09 |
|
Сливочное масло |
0,07 |
В отличие от других водорастворимых витаминов кобаламин может накапливаться в организме, главным образом, в печени. Дефицит витамина В12 возникает не только вследствие низкого содержания его в пище, но и из-за нарушения процесса всасывания в тонкой кишке, который очень сложен. Для активного всасывания необходимо присутствие в желудочном соке особого белка, специфически связывающего витамин. Нарушение синтеза данного белка (внутреннего фактора) в слизистой оболочке желудка приводит к развитию гиповитаминоза В12 даже при наличии в пище достаточного количества кобаламина. Процесс всасывания витамина ухудшается с возрастом, поэтому недостаточность витамина В12 характерна для пожилых людей. Норма витамина В12 составляет 1,5–2,4 мкг/сут. (табл. 2.2.23).
Таблица 2.2.23. Рекомендуемая потребность в витамине В12 в мкг/сут
|
Категория |
Возраст, года |
Россия |
Велико- британия |
США |
|
Грудные дети |
0–½ |
0,4 |
0,3 |
0,3 |
|
½–1 |
0,5 |
0,4 |
0,5 |
|
|
Дети |
1–3 |
1,0 |
0,5 |
0,7 |
|
4–6 |
1,5 |
0,8 |
1,0 |
|
|
7–10 |
2,0 |
1,0 |
1,4 |
|
|
Мужчины |
11–14 |
3,0 |
1,2 |
2,0 |
|
15–18 |
3,0 |
1,5 |
2,0 |
|
|
19–59 |
3,0 |
1,5 |
2,0 |
|
|
60–74 |
3,0 |
1,5 |
2,0 |
|
|
>75 |
3,0 |
1,5 |
2,0 |
|
|
Женщины |
11–14 |
3,0 |
1,2 |
2,0 |
|
15–18 |
3,0 |
1,5 |
2,0 |
|
|
19–59 |
3,0 |
1,5 |
2,0 |
|
|
60–74 |
3,0 |
1,5 |
2,0 |
|
|
>75 |
3,0 |
1,5 |
2,0 |
|
|
Беременные |
4,0 |
1,5 |
2,2 |
|
|
Кормящие |
4,0 |
2,0 |
2,1 |
Витамин В12 является фактором роста, необходим для нормального кроветворения, активирует обмен углеводов, липидов и аминокислот. Он влияет на систему свертывания крови, снижает уровень холестерола в ней. Совместно с холином и метионином витамин В12 проявляет липотропное действие (гипатопротекторные свойства). Дефицит В12 ведет к упадку сил, депрессии, спутанности сознания и провалам памяти, резкому снижению кислотности желудочного сока. Более глубокий дефицит витамина В12 вызывает развитие пернициозной анемии – это тяжелое заболевание, при котором наблюдается недостаток гемоглобина и эритроцитов, нарушение деятельности центральной нервной системы.
В промышленности витамин В12 получают микробиологическим синтезом. Потенциальными источниками витамина В12 являются обезвоженный болотный ил, отходы микробиологической промышленности (мицелий грибов актиномицетов), «активный ил» водоочистных сооружений.
МетодЫ ОПРЕДЕЛЕНИЯ ВИТАМИНА В12
|
Показатель |
Характеристика |
|
|
Оксикобаламин |
Цианокобаламин |
|
|
Формула |
С62Н89О15N13PCo |
С63Н88О14N14PCo |
|
Молекулярный вес |
1346,4 |
1355,4 |
|
Температура плавления, оС |
300 оС (разл.) |
Выше 200 оС, постепенно разлагаясь, и не плавится до 320 оС |
|
Растворимость |
В воде, в органических растворителях не растворим |
В воде (1,2 г/100 мл), низших спиртах, алифатических кислотах, феноле, ДМСО |
|
Оптическая |
[a] |
[a] |
|
Максимум абсорбции, λmax нм, (ε) |
279 (19000), 325 (11400), 359 (20600), 516 (8900), 537 (9500) |
278 (8700); 261 (27600); 551 (8700) |
|
Удельный показатель поглощения , мл/мкг×см |
141, 85, 153, 66, 71 |
115, 204, 64 |
Витамин В12 легко разрушается под действием окислителей, восстановителей и света, его водные растворы устойчивы при рН 4–4,7. Цианогруппа легко может быть замещена на другие группы: OH–, NO2–, SO22–.
Цианокобаламин представляет собой темно-красный кристаллический продукт, слабо растворимый в воде. При нагревании кристаллического цианокобаламина до 100 0С происходит очень медленное разложение. Его нейтральные или слабокислые растворы относительно стабильны при действии повышенных температур и кислорода воздуха. Нагревание его водных растворов в пределах рН 4–7 практически не вызывает разложения; в очень малых концентрациях (0,2–10 мг/мл) при рН 2 происходит медленная потеря активности, а в щелочной среде при рН 9 – быстрое расщепление (около 90% за сутки). Уже при хроматографировании на бумаге наблюдается частичное отщепление циангруппы с образованием пятна оксикобаламина. Растворы цианокобаламина неустойчивы на свету, фотолиз сопровождается отщеплением циан-иона.
Количественное определение цианкобаламина основано на аналитических реакциях с характерными для него функциональными группами: ионом кобальта, цианидной группой и группировкой 5-, 6-диметилбензимидазола. Гравиметрическое определение (по кобальту) проводят после минерализации образца в присутствии концентрированной кислоты и сильного окислителя. Для получения окрашенных растворов в качестве реагента на ион кобальта (III) применяют роданид аммония, α-нитрозо-β-нафтол и нитрозо-R-соль.
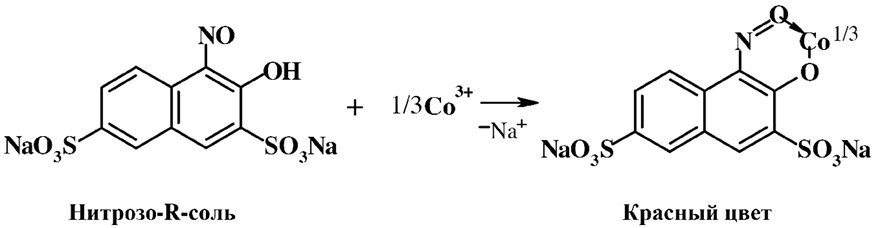
Количественная оценка цианкобаламина по группировке нуклеотидного основания – 5-, 6-диметилбензимидазола – связана с выделением нуклеотидного основания путем кислотного гидролиза в жестких условиях. На следующем этапе осуществляют бензилирование диметилбензимидазола, выделение диметилфенилендиамина и перевод последнего в окрашенный комплекс. Концентрацию окрашенного раствора определяют фотометрическим или флуоресцентным методами, чувствительность которых составляет 20–100 мкг/мл.
Для количественного определения витамина В12 в пищевых продуктах широко применяют микробиологические методы. Относительно высокой избирательностью в отношении некоторых форм кобаламинов характеризуются ферментативные методы анализа, основанные на селективной чувствительности ферментативных аналитических реакций в отношении отдельных кобаламинов. Недостаток метода – сложность и длительность проведения аналитических операций.
В последнее время получил признание метод иммуноферментного анализа (ИФА) витаминов, позволяющий оперативно и с достаточной точностью определять содержание витаминов в пищевых продуктах. В основе методы ИФА лежит обработка исследуемого продукта специфическим для каждого витамина набором реагентов, включающим в себя фермент, субстрат для данного фермента и реактивы для перевода витамина в коферментную форму. В результате специфической ферментативной реакция с участием кофермента, образовавшегося из витамина, скорость, которой пропорциональна активности фермента, оценивается концентрация витамина. Контроль за ходом реакции осуществляют спектральным методом. Для экспресс-ИФА витаминов в различных жидких объектах выпускают тест-полоски, обработанные необходимыми реагентами, по которым содержание витамина оценивают по интенсивности окраски, развивающейся на ней.
1 Интернациональная (международная) единица активности.


 = –15–20 оС
= –15–20 оС