§ 1.3.1. Строение ацилглицеридов
Более половины липидов, встречающихся в природе, относятся к производным глицерина, которые называются глицеридами, или глицеролипидами. В ацилглицеридах гидрофобная часть представлена высшими жирными кислотами, соединенными сложноэфирными связями с глицерином. В зависимости от количества сложноэфирных связей различают триацилглицериды, диацилглицериды и монацилглицериды.
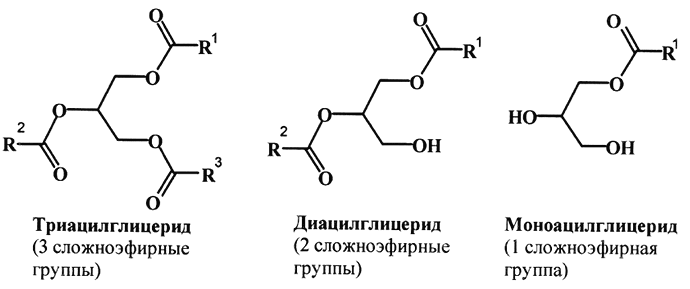
R – остаток жирной кислоты
К производным глицерина относятся также соединения, в которых глицерин образует две сложноэфирные связи и одну простую эфирную связь – алкилдиацилглицериды.
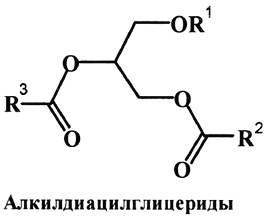
Такие липиды встречаются в различных органах животных (костный и головной мозг, плазма крови), в яичном желтке и молочном жире, но более всего их в морских организмах (иглокожие, моллюски, звезды и некоторые виды рыб).
Ацилглицериды, в которых сложноэфирная связь образована одной кислотой и все три радикала (R1, R2, R3) одинаковые, называют простыми или однокислотными.
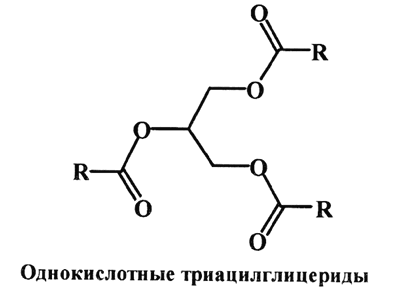
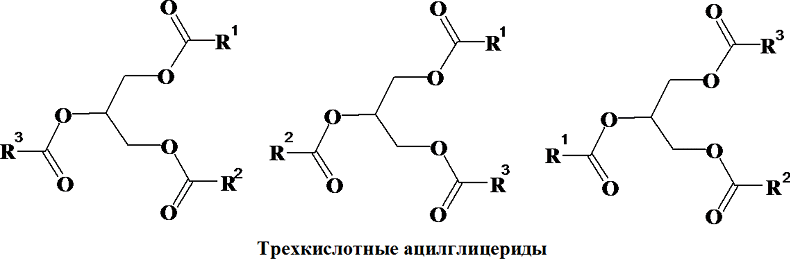
Разнокислотные ацилглицериды (или смешанные) бывают трехкислотные и двухкислотные, когда сложноэфирная связь образована соответственно тремя или двумя разными жирными кислотами. Трех- и двухкислотные триацилглицериды могут иметь изомеры по положению жирнокислотных остатков в молекуле: трехкислотные имеют три изомера, двухкислотные имеют два изомера, однокислотные изомеров не имеют.
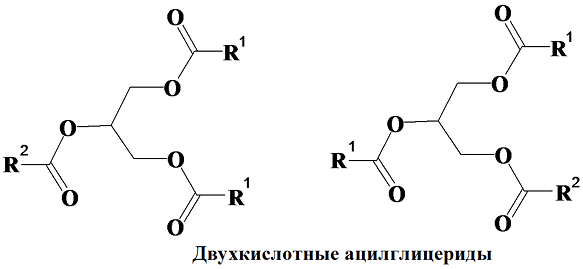
Диацилглицериды могут быть одно- и двухкислотные. Для различия изомерных ацилглицеридов углеродные атомы глицерина обозначают греческими буквами. В соответствии с таким обозначением двухкислотные диацилглицериды имеют три изомера: ab, aa1, ba.
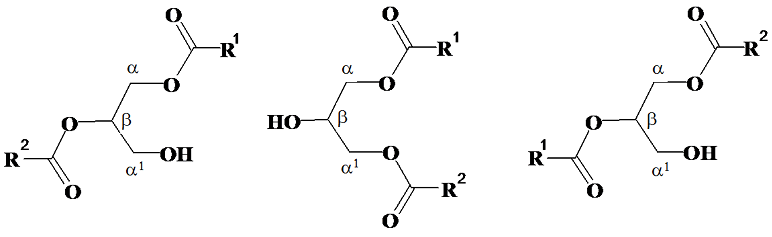
Моноацилглицериды имеют два изомера: a и b.
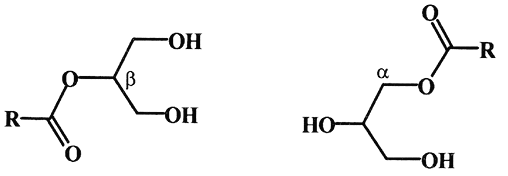
Ацилглицериды, содержащие два различных концевых остатка, имеют асимметрический атом углерода, следовательно, они обладают оптической активностью. Природные ацилглицериды являются L–изомерами, однако они вследствие легкой внутри- и межмолекулярной миграции ацильных групп (реакции переэтерификации) быстро подвергаются рацемизации.
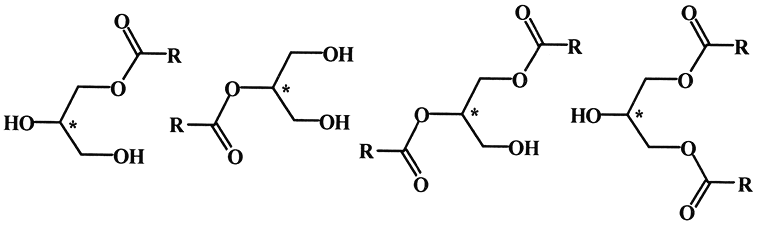
Природные жиры в основном состоят из смеси триацилглицеридов. Диацилглицериды и моноацилглицериды присутствуют в незначительных количествах. Однокислотных ацилглицеридов также мало. В основном жиры состоят из разнокислотных ацилглицеридов, чаще это 5–8 различных жирных кислот, количество возможных изомеров ацилглицеридов – десятки. Жиры рыб и морских зверей содержат десятки различных жирных кислот, то есть количество триацилглицеридов – несколько тысяч.
Существует формула для подсчета числа триацилглицеридов, которые могут быть образованы при участии «n» числа жирных кислот:
без учета оптических изомеров,
a = n3, с учетом стереоизомеров,
где а – число возможных триацилглицеридов;
n – число жирных кислот.
|
Число жирных кислот, n |
Число возможных |
|
5 |
75 |
|
6 |
126 |
|
7 |
196 |
|
8 |
298 |
|
9 |
550 |
Однокислотные триацилглицериды встречаются редко, например, в оливковом масле – до 80% олеиновой кислоты, поэтому триацилглицерид олеиновой кислоты присутствует в нем в значительных количествах. Растительные жиры в большей мере, чем животные, характеризуются наличием разнокислотных триацилглицеридов. В табл. 1.3.1 приведен триацилглицеридный состав масла какао.
Таблица 1.3.1. Триацилглицеридный состав какао-масла
|
Наименование триацилглицерида |
Массовая доля, % |
Температура плавления, °С |
|
Олеопальмитостеарин |
53,0 |
34,5 |
|
Олеодистеарин |
18,5 |
43,5 |
|
Олеодипальмитин |
7,0 |
29,0 |
|
Дипальмитостеарин |
2,5 |
65,0 |
|
Диолеопальмитин |
4,0 |
Жидкие при комнатной температуре |
|
Диолеостеарин |
4,5 |
|
|
Олеинолеопальмитин |
4,5 |
|
|
Олеолинолеостеарин |
4,5 |
В животных жирах присутствует больше однокислотных ацилглицеридов. В таблицах 1.3.2–1.3.4 приведены примеры наличия одно-, двух- и трехкислотных ацилглицеридов в природных жирах.
Таблица 1.3.2. Состав и свойства однокислотных триацилглицеридов
|
Наименование триацилглицерида |
Температура плавления, °С |
Источники |
|
Трилаурин |
45 – 46 |
Лавровое масло |
|
Тримиристин |
56 |
Мускатное масло, пальмовое масло, животные жиры |
|
Трипальмитин |
71,6 – 73 |
Многие жиры |
|
Тристеарин |
65 |
Конский жир, гусиный жир, многие масла |
|
Триолеин |
–4 – (–5) |
Таблица 1.3.3. Состав и свойства двухкислотных триацилглицеридов
|
Наименование триацилглицерида |
Температура плавления, оС |
Источники |
|
Миристино-дилаурин |
33,4 |
Кокосовое, пальмовое масла |
|
Стеарино-дипальмитин |
55,0 |
Говяжье сало, кокосовое масло |
|
Стеарино-дипальмитин |
57,3 |
Бараний, гусиный, говяжий жир |
|
Олеино-дистеарин |
42,0 |
Свиной жир |
|
Пальмитино-диолеин |
жидк. |
Льняное масло, различные животные жиры |
Таблица 1.3.4. Состав и свойства трехкислотных триацилглицеридов
|
Наименование триацилглицерида |
Температура плавления, оС |
Источники |
|
Каприло-лаурино-миристин |
13–15 |
Главная составляющая кокосового масла |
|
Бутиро-пальмитино-олеин Миристино-пальмитино-олеин Пальмитино-олеино-линолеин |
15,5 25–27 жидк. |
Коровье масло Масло какао Льняное масло |
§ 1.3.2. Физические свойства ацилглицеридов
В чистом виде ацилглицериды представляют собой бесцветные вещества без запаха и вкуса. Запах, вкус и цвет природных жиров определяется наличием сопутствующих примесей, характерных для каждого вида жира. Температуры плавления и застывания ацилглицеридов не совпадают, что обусловлено наличием нескольких кристаллических модификаций (полиморфизм). Наличие у ацилглицеридов трех полиморфных кристаллических форм приводит к существованию у них трех точек плавления (табл. 1.3.5).
Таблица 1.3.5. Температуры плавления полиморфных форм ацилглицеридов
|
Наименование ацилглицерида |
Температура плавления, оС |
||
|
Форма 1 |
Форма 2 |
Форма 3 |
|
|
Трипальмитинглицерид |
65,5 |
56,0 |
45,0 |
|
Тристеаринглицерид |
71,5 |
65,0 |
54,5 |
|
Триолеинглицерид |
– 5,5 |
– 13,0 |
– 32,0 |
Так как природные ацилглицериды представляют собой сложные смеси ацилглицеридов, то плавятся они не при определенной температуре, а в широком температурном интервале. При этом температуры плавления не совпадают в точности с температурой затвердевания. Обычно для характеристики ацилглицеридов применяют температуру затвердевания, которая более четко определяется.
Многие животные жиры при комнатной температуре являются твердыми веществами, а растительные липиды (масла) – жидкими. Температура затвердевания жира определяется наличием в его составе предельных кислот: чем выше температура затвердевания, тем выше содержание предельных ВЖК. Температуры плавления и затвердевания природных липидов лежат в широком интервале температур (табл. 1.3.6).
Таблица 1.3.6. Температуры плавления и затвердевания некоторых природных жиров
|
Наименование жира |
Температура, ºС |
|
|
плавления |
затвердевания |
|
|
Масло какао |
48–52 |
22–27 |
|
Пальмовое масло |
27–30 |
31–41 |
|
Кокосовое масло |
20–28 |
14–25 |
|
Арахисовое масло |
– 3 |
|
|
Кукурузное масло |
– 12 |
|
|
Подсолнечное масло |
– 5 |
– 13 – (– 20) |
|
Говяжий жир |
40–50 |
30–38 |
|
Бараний жир |
44–55 |
|
|
Свиной жир |
28–40 |
|
|
Коровье масло (топленое) |
28–30 |
15–25 |
Пищевые жиры представляют собой сложные смеси триацилглицеридов, поэтому они способны образовывать эвтектические смеси – сплавы, обладающие температурой плавления, как правило, более низкой, чем температура плавления составляющих компонентов.
Жиры растворяются в органических растворителях (хлороформ, дихлорэтан, бензол, толуол, бензин и другие), нерастворимы в воде, однако могут образовывать коллоидные дисперсии или эмульсии. Природной эмульсией жира, стабилизированной белками, является молоко.
§ 1.3.3. Химические свойства ацилглицеридов
Для ацилглицеридов как сложных эфиров характерны следующие реакции по эфирной связи: гидролиз (щелочной, кислотный или ферментативный), алкоголиз (взаимодействие со спиртами), ацидолиз (взаимодействие с кислотами) и переэтерификация (взаимодействие с другими сложными эфирами). И алкоголиз и ацидолиз приводят к получению продуктов переэтерификации ацилглицеридов, т. е. получению ацилглицеридов нового жирнокислотного состава.
Алкоголиз
Алкоголиз широко применяется для превращения жирных кислот, входящих в состав липидов, в метиловые эфиры, минуя стадию образования свободных кислот (реакция переэтерификации) и для получения моно- и диацилглицеридов при взаимодействии ТАГ с глицерином:
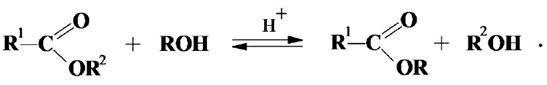
Метанолиз проводят в избытке метанола, в качестве катализаторов используют кислоты (серная, соляная) или щелочной катализатор (метоксид натрия). Реакция метанолиза лежит в основе хроматографического анализа ВЖХ при определении жирнокислотного состава ТАГ.
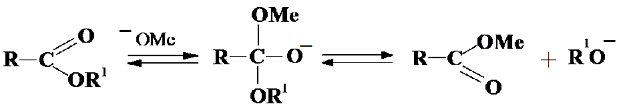
Алкоголиз ТАГ глицирином проводят в присутствии катализатора гидроксида натрия, и он является важным методом получения моно- и диацилглицеридов:
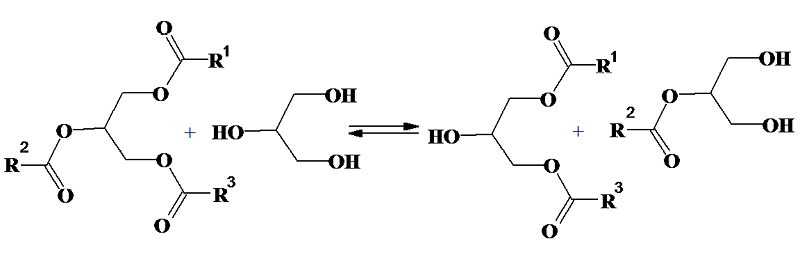
Образуется равновесная смесь, состав которой зависит от относительных количеств ТАГ и глицерина.
Ацидолиз
Ацидолиз протекает при взаимодействии ацилглицеридов с кислотами, в качестве катализатора используют серную кислоту, оксиды цинка или кальция. При этом могут замещаться ацильные остатки ненасыщенных ЖК на насыщенные и наоборот.
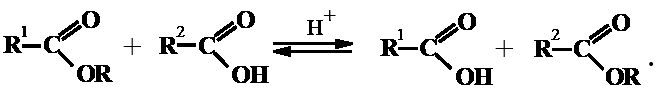
Переэтерификация
Процесс переэтерификации подразумевает внутри- и межмолекулярный обмен остатками жирных кислот с образованием ацилглицеридов нового жирнокислотного состава. Обмен остатками ацилглицеридов носит случайный характер и часто называется рандомизацией.
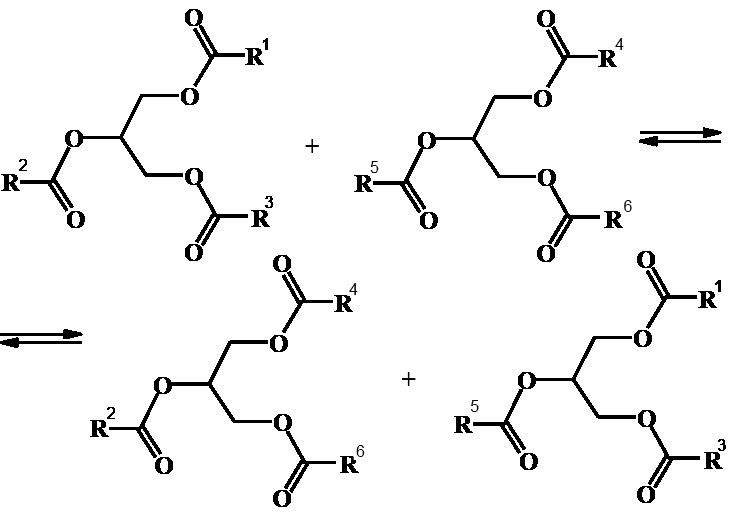
Переэтерификация, изменяя распределение жирных кислот в ацилглицеридах, сопровождается изменением их физико-химических характеристик. Так, под действием основных катализаторов (гидроксид или метоксид натрия, сплав натрия и калия) при температуре около 80 оС у соевого масла температура плавления повышается с –7 оС до +6 оС, а у хлопкового – с 10 оС до +34 оС.
Направленную переэтерификацию можно осуществлять и при более низких температурах 10–40 оС, в этом случае полностью насыщенные ацилглицериды выкристаллизовываются из реакционной смеси и тем самым удаляются из зоны реакции. Таким образом, происходит перераспределение жирнокислотных остатков с образованием двух продуктов: с повышенным содержанием насыщенных ЖК и повышенным содержанием ненасыщенных ЖК. Этот процесс применяют, например, для улучшения свойств свиного жира.
Переэтерификация не влияет на степень насыщения, не приводит к образованию трансизомеров ВЖК и не сопровождается повышением содержания никеля в готовой продукции. По этой причине переэтерификацию в настоящее время широко используют в мире взамен гидрогенизации для получения основ для маргаринов, спредов, заменителей масла какао и других жиров специального назначения.
Переэтерификация в зависимости от используемых катализаторов разделяют на химическую и ферментативную. Первоначально развитие получила химическая переэтерификация, при которой в качестве катализаторов использовались этилаты и метилаты щелочных металлов при температуре процесса 110–125 оС. Химическая переэтерификация, как наиболее изученная, обеспечивает стабильность процесса, имеет высокий уровень организации производства, но сопряжена с рядом недостатков, характерных для сложного химического производства. Это необходимость в очистке готового продукта от остатков катализаторов и побочных продуктов, утилизации отходов производства и значительные энергетические затраты.
Ферментативная переэтерификация представляется наиболее перспективной, хотя и не решает всех проблем, особенно это касается ферментных препаратов. При ферментативной переэтерификации технологический процесс более простой, удобный в эксплуатации, не требует высоких температур и давления, протекает при температуре не выше 70 оС, экологически чистый и безопасный. Кроме того, возможен подбор ферментных препаратов с высокой специфичностью.
Важным преимуществом ферментативной переэтерификации растительных масел является максимальная сохранность в них биологически активных веществ, в том числе витаминов и микроэлементов. Это определяется использованием более низких температур и меньшим количеством стадий очистки конечного продукта, осуществляемых при более умеренных температурах, чем при химической переэтерификации. Кроме того, сохранность исходных токоферолов в модифицированных маслах в дальнейшем при их использовании позволяет сократить добавки других антиоксидантов.
Переэтерификацию проводят с использованием липаз в водно- органических средах. Идея использования органических сред биокатализа родилась в 80–90-е годы прошлого столетия и до сих пор чрезвычайно актуальна. Применение органических растворителей значительно расширяет круг реакций, которые можно осуществлять, используя ферментативный катализ и, особенно в случае применения липолитических ферментов, вследствие того, что субстратами этой группы ферментов являются гидрофобные соединения. В двухфазных водно-органических системах можно достичь значительных сдвигов равновесия реакций, оптимизируя соотношение двух фаз и регулируя значения коэффициентов распределения компонентов между ними. Применение таких сред сделало возможным использование ферментов для модификации жиров, в частности, для переэтерификации ацилглицеридов. Впервые завод по ферментативной переэтерификации был построен в Швеции в 2001 году. В нашей стране первый завод по переработке растительных масел по технологии ферментативной переэтерификации был запущен в 2009 году.
В промышленности используют два типа липаз – неспецифические липазы, которые позволяют получать продукты как при химической рандомизации, и 1–3 специфические липазы, которые позволяют получать продукты определенного триацилглицеридного состава. Например, 1–3 специфические липазы используются для производства эквивалентов масла какао, бестрансовых маргаринов, кулинарных и других жиров специального назначения.
Развитие процессов ферментативной переэтерификации происходит по двум направлениям. Поиск новых продуцентов липаз и, соответственно, получение новых эффективных ферментных препаратов, в том числе с использованием методов генной инженерии. Другое направление – поиск методов иммобилизации ферментов для увеличения термической стабильности, времени жизни фермента и максимального сохранения его активности. В настоящее время для иммобилизации липаз используют в основном кизельгур, селикагель, хитозан и ионообменные смолы.
Содержание трансжиров в заменителях масла какао, полученных по технологии ферментативной переэтерификации, составляет менее 1%, в то время как на основе масел, полученных по технологии гидрогенизации, их содержание составляет порядка 37%. Развитие технологии ферментативной переэтерификации открывает совершенно новые перспективы создания в промышленном масштабе экологически чистых продуктов на основе растительных масел и жиров.
Гидролиз
Ацилглицериды, как и сложные эфиры, гидролизуются с образованием кислоты и спирта. Реакция катализируется кислотами, и в этом случае она обратима:
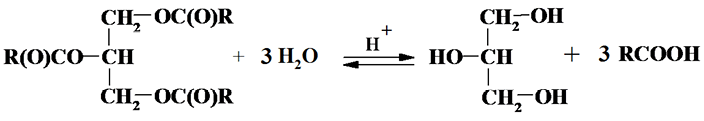
При щелочном катализе реакция необратима, так как образующиеся соли ВЖК в воде труднорастворимы:
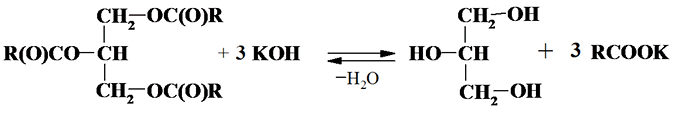
Ацилглицериды обычно гидролизуются растворами щелочи в этаноле, при подкислении гидролизата выделяются свободные ЖК, которые могут быть экстрагированы органическим растворителем. Некислотные компоненты (спирты, стерины или простые эфиры глицерина) также переходят в органический экстракт, а выделившийся глицерин остается в водной фазе. Щелочной гидролиз жиров (омыление) проводят при температуре около 100 ºС. Натриевые и калиевые соли ЖК применяют как мыла, а соли других металлов находят различные области применения – в качестве компонентов пластмасс, смазочных материалов, катализаторов полимеризации высыхающих масел.
Ацилглицериды могут быть гидролизованы до свободных кислот водой в присутствии катализаторов – сульфированных длинноцепочечных алкилбензолов (при температуре около 100 ºС) или оксидов цинка, магния или кальция (при температуре 250 ºС и повышенном давлении).
Ферментативный гидролиз. Более широкое распространение получил ферментативный гидролиз. Панкреатическая липаза промотирует гидролиз остатков жирных кислот, присоединенных к первичным группам глицерина, и конечными продуктами реакции являются 2-О-ацилглицерид и жирные кислоты, находящиеся в положении 1 и 3 в триацилглицеридах:
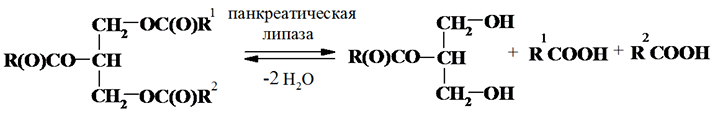
Гидролиз протекает на 50–60% при рН 8,5, при температуре 37 ºС, в качестве активаторов обычно используют желчные кислоты и соли кальция. Ацилглицериды с короткоцепочечными кислотами гидролизуются быстрее, а с разветвленным углеродным скелетом или кратными связями, расположенными рядом с карбоксильной группой (например, С20- и С22-полиеновые кислоты с кратной связью в положении 4 или 5), гидролизуются медленнее, поэтому метод не применяют для гидролиза рыбьего жира, богатого С20- и С22-полиеновыми кислотами.
В растительных триацилглицеридах в положении 2 обычно находится остаток ненасыщенной С18-кислоты, а остатки насыщенных и длинноцепочечных ненасыщенных кислот (С20:1 и С22:1) расположены обычно в положении 1 или 3. В ацилглицеридах животных жиров и рыбьего жира ситуация не столь определена. Так, в свином жире в положении 2 триацилглицеридов обычно находится остаток пальмитиновой кислоты, в ТАГ рыбьего жира в положении 2 – остатки полиеновых (С22:6 и С20:5) и насыщенных (С14:0 и С16:0) кислот.
Применение липаз микробиологического происхождения позволяет провести исчерпывающий гидролиз жиров:
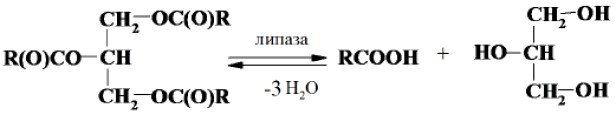
Например, используя смесь микробных липаз, был осуществлен гидролиз оливкового и кукурузного масел на глубину 95–98%, в промышленных масштабах можно достичь 100-процентного выхода при температуре 40 оС за 72 часа. Данный способ нашел применение для получения g-линоленовой кислоты из смеси растительного масла и свиного жира.
Гидролизаты жиров, состоящие из низкомолекулярных ЖК (С4– С10), применяют для ароматизации пищевых продуктов. Для получения аромата сыра, например, используют гидролизат сливочного масла в количестве 0,2–0,5% с глубиной гидролиза 66%.
Каталитическое гидрирование
Для производства твердых и пластичных жировых основ с определенными показателями температур плавленая, используемых для получения маргаринов и различных жиров специального назначения, с начала XX века используются процессы гидрирования ненасыщенных углеводородных остатков ВЖК (гидрогенизация). Гидрирование ведут в присутствии катализаторов на основе палладия, платины, никеля, кобальта, меди, в промышленности чаще всего используют никелевые катализаторы. При исчерпывающем гидрировании происходит полное насыщение кратных связей. Например, олеат переходит в стеарат:
18:1 (9Z) → 18:0.
Состав продуктов частичного гидрирования зависит от катализатора, давления и других факторов, влияющих на степень доступности атомов водорода на поверхности катализатора. Значение имеет также способность различных ацилглицеридов адсорбироваться на поверхности катализатора и десорбироваться с нее. Частичное гидрирование сопровождается миграцией двойной связи и стерическими изменениями, приводящими к образованию трансизомеров. В зависимости от условий гидрирования двойная связь может находиться практически в любом положении углеродной цепи.
Так, гидрирование в присутствии катализатора типа хромита меди протекает только для сопряженных метиленразделенных изомеров. Несопряженные диены и моноены не восстанавливаются в присутствии этого катализатора. При использовании никелевых катализаторов сопряженные соединения обычно восстанавливаются быстрее, чем их несопряженные изомеры. α-линоленовая кислота, содержащаяся в соевом масле, в результате окисления приобретает неприятный вкус. Были предприняты попытки найти селективный катализатор, который позволял бы гидрировать α-линоленовую кислоту в более стабильную линолевую. Отчасти это было достигнуто при использовании хромита меди.
Но как указано выше (раздел 1.2.3), каталитическое гидрирование сопровождается рядом отрицательных моментов – образование опасных для здоровья трансизомеров ВЖК, повышение содержания никеля в готовой продукции, снижение содержание ПНЖК. Это поставило перед производителями вопрос о замене в пищевой промышленности существующих производств по каталитическому гидрированию масложировой продукции на другие методы ее модификации. Фактически это означает глобальную перестройку масложировой промышленности, которая началась с конца XX века и бурно развивается в настоящее время. В качестве альтернативных методов были выбраны методы переэтерификации, это технологии, которые получили название «технологии транс-фри».
Биохимическое восстановление. Микроорганизмы, содержащиеся в рубце жвачных животных, продуцируют изомеразу и редуктазу, способные восстанавливать полиненасыщенные линолевую и линоленовую кислоты до стеариновой кислоты и ненасыщенных кислот с транс-конфигурацией. Например, линолевая кислота может превращаться в вакценовую: 18:2 (9Z, 12Z) → 18:1 (11Z), 18:1 (11E).
Окисление и полимеризация
Окисление жиров протекает по гомолитическому механизму (см. раздел «Порча жиров»). Ацилглицериды, содержащие в своем составе непредельные ЖК, способны к полимеризации. Установлено, что непредельные кислоты с сопряженными двойными связями полимеризуются по механизму диенового синтеза, например образование димера.
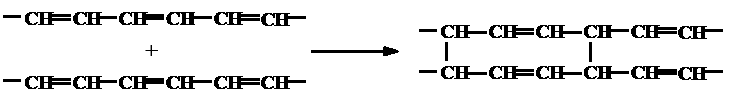
Это высыхающие масла, широко применяемые в промышленности для образования защитных пленок, нерастворимых в органических растворителях и являющихся основой для многих лаков и красок. К ним относятся такие масла, как льняное и тунговое, содержащие в своем составе кислоты с сопряженными двойными связями. Соответственно масла, содержащие остатки кислот с сопряженными двойными связями, не подлежат длительному хранению.
МЕТОДЫ ОПРЕДЕЛЕНИЯ ХИМИЧЕСКИХ ПОКАЗАТЕЛЕЙ ЖИРОВ
Процессы, происходящие в липидах при их хранении и переработке, характеризуются так называемыми константами, или химическими и физическими числами жира. Определение этих констант позволяет контролировать не только качество жиров и масел, но и в некоторой степени их натуральность, регулировать технологические режимы получения продуктов на их основе.
Как факторы регулирования производственных процессов и качества готового продукта широко используются следующие числа жиров: кислотное число, число омыления, эфирное число, йодное и перекисное числа. В последнее время для оценки степени окислительной порчи жира введен показатель – «анизидиновое число».

