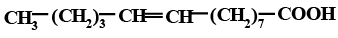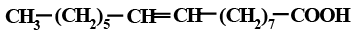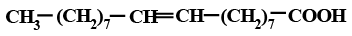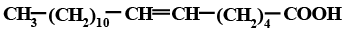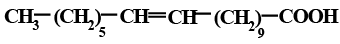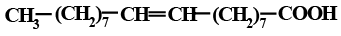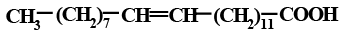§ 1.2.1. Высшие жирные кислоты
§ 1.2.3. Трансизомеры высших жирных кислот
§ 1.2.4. Свойства высших жирных кислот
* * *
§ 1.2.1. Высшие жирные кислоты
Структурное многообразие липидов в значительной степени обусловлено наличием в их составе различных жирных кислот. В природе обнаружено свыше 500 жирных кислот, многие из которых встречаются редко. Основные жирные кислоты, входящие в состав липидов растений и животных, – это высшие жирные кислоты (ВЖК). Они имеют углеродный состав С16 – С22, чаще всего четное число атомов углерода и неразветвленную структуру, делятся на насыщенные и ненасыщенные.
Насыщенные жирные кислоты
Насыщенные жирные кислоты имеют общую формулу: СН3(СН2)nСООН и используются организмом в первую очередь как энергетический материал. Наибольшее значение имеют пальмитиновая и стеариновая кислоты, которые являются первичным продуктом, образующимся под действием синтетазы жирных кислот, и источником биосинтеза других насыщенных и мононенасыщенных кислот (пальмитолеиновой и олеиновой). Избыток их в питании приводит к нарушению обмена жиров, повышению уровня холестерола. В табл. 1.2.1 приведены наиболее важные насыщенные жирные кислоты и их температуры плавления. Температура плавления насыщенных жирных кислот возрастает с повышением молекулярной массы, а температура застывания несколько ниже температуры их плавления вследствие переохлаждения или образования полиморфных форм.
Таблица 1.2.1. Насыщенные жирные кислоты
|
Число атомов углерода |
Наименование жирной кислоты |
Структура |
ТПЛ, ºС |
Источник |
|
|
Систематическое |
Тривиальное |
||||
|
4 |
Бутановая |
Масляная |
СН3(СН2)2СООН |
-5,3 |
Липиды молока |
|
5 |
Пентановая |
Валериановая |
СН3(СН2)3СООН |
-34,5 |
|
|
6 |
Гексановая |
Капроновая |
СН3(СН2)4СООН |
-3,2 |
Липиды молока, кокосовое масло |
|
7 |
Гептановая |
Энантовая |
СН3(СН2)5СООН |
-7,5 |
Липиды молока |
|
8 |
Октановая |
Каприловая |
СН3(СН2)6СООН |
16,5 |
|
|
9 |
Нонановая |
Пеларгоновая |
СН3(СН2)7СООН |
12,5 |
|
|
10 |
Декановая |
Каприновая |
СН3(СН2)8СООН |
31,6 |
|
|
12 |
Додекановая |
Лауриновая |
СН3(СН2)10СООН |
44,8 |
Природные масла и жиры, особенно масла из семян растений |
|
14 |
Тетрадекановая |
Миристиновая |
СН3(СН2)12СООН |
54,4 |
|
|
16 |
Гексадекановая |
Пальмитиновая |
СН3(СН2)14СООН |
62,9 |
|
|
18 |
Октадекановая |
Стеариновая |
СН3(СН2)16СООН |
70,1 |
|
|
20 |
Эйкозановая |
Арахиновая |
СН3(СН2)18СООН |
76,1 |
Масло арахиса, овощи и рыбий жир |
|
22 |
Докозановая |
Бегеновая |
СН3(СН2)20СООН |
80,0 |
Семена горчицы и репы |
|
24 |
Тетракозановая |
Лигноцириновая |
СН3(СН2)22СООН |
84,2 |
Растения и жиры морских животных |
Ненасыщенные жирные кислоты
Ненасыщенные ВЖК могут быть как моноеновыми, содержащие одну кратную связь, так и полиеновыми дивинилметанового ряда:
Природные непредельные ВЖК, не подвергшиеся окислительным процессам, являются преимущественно цис-изомерами:
Ненасыщенные ВЖК могут различаться не только пространственной конфигурацией, но и местом расположения двойных связей, что обусловливает различия в физических и химических свойствах. Например, олеиновая и элаидиновая кислоты – цис-трансизомеры; олеиновая и петрозелиновая – позиционные изомеры (табл.1.2.2).
Замещенные жирные кислоты встречаются редко, известны кислоты, содержащие в качестве заместителей гидрокси-, оксо-, эпоксигруппы или атом фтора. Оптической активностью могут обладать только разветвленные, циклические или замещенные жирные кислоты.
В названии природных жирных кислот часто используются сложившиеся тривиальные наименования. Согласно номенклатуре IUPAC для названия ВЖК применяются следующие сокращенные обозначения. Цифрами обозначается количество углеродных атомов в основной цепи, после двоеточия – количество кратных связей, затем в скобках положение и характер кратных связей (А – ацетиленовая, Е – транс-конфигурация, Z – цис-конфигурация), счет атомов углерода начинается с карбоксильной группы. Всего известно более 100 моноеновых кислот, наиболее распространенные из них приведены в табл. 1.2.2.
Таблица 1.2.2. Моноеновые жирные кислоты
|
Структура жирной кислоты |
Пищевые источники |
|
|
Говяжий, свиной жир, коровье масло, жир морских животных |
|
|
Животные жиры, жиры морских животных (до 27%) и рыб (до 16%), растительные масла (не более 1%) |
|
|
Все жиры растительного и животного происхождения |
|
|
Масла растений семейства зонтичных и аралиевых (кориандр – до 53%, петрушка – до 76%) |
|
|
Говяжий и бараний жиры, свиное сало и коровье масло |
|
|
Гидрированные жиры. Говяжий и бараний жиры, жир жвачных животных (в небольшом количестве) |
|
|
Масла из семян растений семейства крестоцветных, горчичное масло (до 53%), рапсовое масло (до 56%) |
В пищевой промышленности распространена номенклатура, согласно которой атомы углерода в цепи обозначаются греческими буквами, а самый удаленный от карбоксильной группы атом углерода (обычно метильная группа) обозначается буквой w, нумерация атомов углерода начинается с w–конца:

В соответствии с этой номенклатурой ненасыщенные ВЖК относятся к семейству w-3, если двойная связь расположена у третьего атома углерода: α-линоленовая, эйкозапентаеновая, докозагексаеновая кислоты.
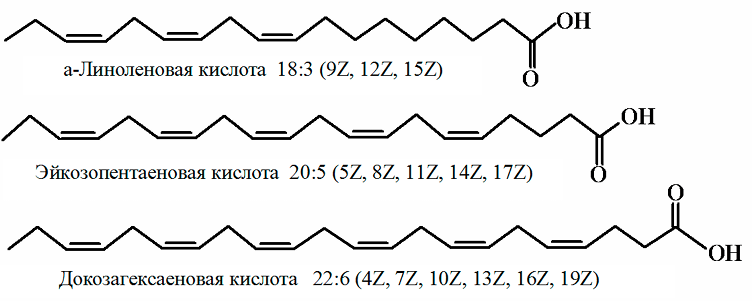
К семейству w-6 относятся кислоты, у которых двойная связь у шестого атома углерода – линолевая, γ-линоленовая, дигомо-γ-линоленовая, арахидоновая и другие кислоты.
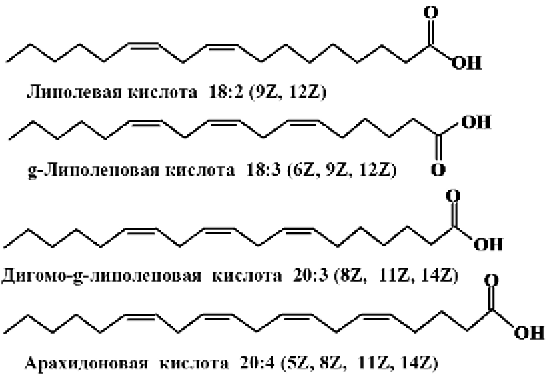
К семейству w-9 жирных кислот относятся кислоты с двойной связью у девятого атома углерода, например олеиновая кислота. Наиболее распространенные представители данных семейств представлены в табл. 1.2.3. В табл. 1.2.4–1.2.7 представлен жирнокислотный состав натуральных масел, рыб, животных жиров.
Таблица 1.2.3. Природные ненасыщенные высшие жирные кислоты
|
Наименование жирной кислоты |
Общее число атомов углерода |
х |
y |
Природные источники |
|
Семейство w-9. Тип олеиновой кислоты – СН3(СН2)7(СН=СНСН2)х(СН2)yСООН |
||||
|
Октадеценовая [18:1 (9Z)] (олеиновая) |
18 |
1 |
6 |
Основные жиры и масла |
|
Докозеновая |
22 |
1 |
10 |
Масло семян горчицы и рапса |
|
Тетракозеновая |
24 |
1 |
12 |
Цереброзиды спинного мозга |
|
Октадекадиеновая |
18 |
2 |
3 |
Жир сельди |
|
Эйкозадиеновая |
20 |
2 |
5 |
Печень быка |
|
Эйкозатриенoвая |
20 |
3 |
2 |
Фосфолипиды мозга, печени |
|
Докозадиеновая |
22 |
2 |
7 |
Жир сельди |
|
Докозатриеновая |
22 |
3 |
4 |
Фосфолипиды мозга |
|
Семейство w-6. Тип линолевой кислоты – СН3(СН2)4(СН=СН-СН2)х(СН2)yСООН |
||||
|
Октадекадиеновая [18:2 (9Z,12Z)] (линолевая) |
18 |
2 |
6 |
Растительные масла, фосфолипиды животного организма |
|
Октадекатриеновая |
18 |
3 |
3 |
Растительные масла |
|
Эйкозадиеновая |
20 |
2 |
8 |
Фосфолипиды печени быка |
|
Эйкозатриеновая |
20 |
3 |
5 |
Фосфолипиды печени быка, гликофосфолипиды мозга |
|
Эйкозатетраеновая |
20 |
4 |
2 |
Фосфолипиды печени, мозга, поджелудочной железы млекопитающих |
|
Докозатетраеновая [22:4 (7Z, 10Z, 13, 16Z)] |
22 |
4 |
4 |
Фосфолипиды печени быка |
|
Семейство w-3.Тип линоленовой кислоты СН3СН2(СН=СН-СН2)х(СН2)yСООН |
||||
|
Октадекатриеновая |
18 |
3 |
6 |
Растительные масла, фосфолипиды животного организма |
|
Октадекатетраеновая |
18 |
4 |
3 |
Жир сельди |
|
Эйкозатетраеновая |
20 |
4 |
3 |
Фосфолипиды печени |
|
Эйкозапентаеновая |
20 |
5 |
2 |
Жир печени акулы и быка |
|
Докозагексаеновая |
22 |
6 |
1 |
Фосфолипиды печени быка, мозга |
|
Тетракозагексаеновая |
24 |
6 |
3 |
Печень трески, жир сардин |
Таблица 1.2.4. Жирнокислотный состав растительных масел, %
|
Наименование жирной кислоты, химическая формула |
Наименование растительного масла |
|||||||||
|
Касторовое |
Кокосовое |
Пальмоядровое |
Пальмовое |
Арахисовое |
Хлопковое |
Соевое |
Подсолнечное |
Льняное |
Рапсовое |
|
|
Насыщенные жирные кислоты |
||||||||||
|
Гексановая кислота, С6Н12О2 |
0,2–0,8 |
сл.–1,6 |
||||||||
|
Октановая кислота, С8Н16О2 |
6–9 |
3–10 |
||||||||
|
Декановая кислота, С10Н20О2 |
6–10 |
3–14 |
||||||||
|
Лауриновая кислота, С12Н24О2 |
4–51 |
37–52 |
||||||||
|
Миристиновая кислота, С14Н28О2 |
13–18 |
7–17 |
0,5–2 |
0,05–2 |
сл. |
сл. |
0–1,5 |
|||
|
Пальмитиновая кислота, С16Н32О2 |
1–2 |
8–10 |
2–9 |
32–47 |
7–2 |
20–27 |
7–10 |
4–8 |
4–7 |
1–4 |
|
Стеариновая кислота, С18Н36О2 |
1–2 |
1–3 |
1–3 |
2–8 |
2–6 |
1–3 |
3–6 |
2–5 |
2–5 |
0,5–2 |
|
Арахиновая кислота, С20Н40О2 |
сл.–0,6 |
2–4 |
0,2–1 |
0–2 |
0–1 |
сл. |
0–1 |
|||
|
Бегеновая кислота, С22Н44О2 |
сл.–3 |
0–1 |
0,5–1,5 |
|||||||
|
Лингоцериновая кислота, С24Н48О2 |
сл. |
1–3 |
сл. |
1–2 |
||||||
|
Мононенасыщенные жирные кислоты |
||||||||||
|
Пальмитолеиновая кислота, С16Н30О2 |
сл.–0,4 |
сл.–0,6 |
– |
сл. |
0,5 |
сл.–1 |
сл. |
сл. |
||
|
Олеиновая кислота, С18Н34О2 |
сл.–8,5 |
5,5–7,5 |
11–23 |
0–52 |
35–70 |
22–35 |
20–35 |
20–40 |
12–34 |
11–24 |
|
Рициноленовая С18Н34О3 |
86–92 |
|||||||||
|
Гадолеиновая кислота, С20Н38О2 |
5–12 |
|||||||||
|
Эруковая кислота, С22Н42О2 |
40–55 |
|||||||||
|
Полиненасыщенные жирные кислоты |
||||||||||
|
Линолевая кислота, С18Н32О2 |
3–6 |
сл.–2,5 |
1–3 |
5–11 |
20–25 |
42–54 |
40–57 |
45–68 |
14–20 |
11–29 |
|
Линоленовая кислота, С18Н20О2 |
сл.–2 |
5–14 |
сл. |
35–65 |
6–13 |
|||||
|
Содержание свободного глицерина в масле, % |
8,8–9,8 |
13,2–13,5 |
12,2–12,8 |
5,5–10 |
8,7–9,9 |
1,6 |
10,2 |
10–12 |
0,4–10,5 |
9–9,7 |
|
Температура плавления, ºС |
-10–(-12) |
23–26 |
24–26 |
27–50 |
–2 |
-2–(+2) |
-20–(-23) |
-10 |
-20 |
-9 |
Таблица 1.2.5. Жирнокислотный состав рыб
|
Наименование жирной кислоты |
Массовая доля жирных кислот, % |
|||
|
Горбуша |
Сельдь |
Скумбрия |
Путасу |
|
|
Насыщенные |
||||
|
Миристиновая |
3,4 |
4,6–8,4 |
4,9 |
4,5 |
|
Пентадекановая |
– |
– |
0,5 |
– |
|
Пальмитиновая |
10,2 |
10,1–15,0 |
28,2 |
33,3 |
|
Стеариновая |
4,4 |
0,7–2,1 |
3.9 |
2,7 |
|
Мононенасыщенные |
||||
|
Пальмитолеиновая |
5,0 |
6,3–11,6 |
5,3 |
5,2 |
|
Олеиновая |
17,6 |
9,3–21,4 |
19,3 |
14,1 |
|
Гадолеиновая |
4,0 |
11,0–19,9 |
3,1 |
2,4 |
|
Эруковая |
3,5 |
14,7–0,6 |
2,8 |
1,1 |
|
Полиненасыщенные |
||||
|
Гексадекадиеновая |
– |
– |
0,7 |
– |
|
Линолевая |
1,6 |
0,6–2,9 |
1,1 |
3,4 |
|
Линоленовая |
1,1 |
0,2–1,0 |
1,3 |
– |
|
Октадекатетраеновая |
2,9 |
1,1–2,5 |
3,4 |
– |
|
Арахидоновая |
0,7 |
0,2–0,7 |
3,9 |
1,4 |
|
Эйкозапентаеновая |
13,5 |
3,9–8,8 |
7,1 |
11,6 |
|
Докозапентаеновая |
3,1 |
0,5–1,3 |
1,2 |
0,6 |
|
Докозагексаеновая |
18,9 |
2,0–6,2 |
10,8 |
15,0 |
Наиболее распространенной моноеновой кислотой является олеиновая, которая содержится во всех растительных маслах: в оливковом – до 85%, миндальном – 70%, в арахисовом – 70%, в других растительных маслах – 10–15%. Олеиновая кислота присутствует в жирах многих тепло- и холоднокровных животных, а также в липидах различных тканей и органов человека и животных.
Таблица 1.2.6. Жирнокислотный состав животных жиров
|
Наименование жирной кислоты |
Массовая доля жирных кислот, % |
||
|
Говяжий жир |
Бараний жир |
Свиной жир |
|
|
Миристиновая |
2,0–2,5 |
2,0–4 |
– |
|
Пальмитиновая |
27–9 |
25–27 |
25–30 |
|
Стеариновая |
24–29 |
25–31 |
12–16 |
|
Олеиновая |
43–44 |
36–43 |
41–51 |
|
Линолевая |
2–5 |
3–4 |
3–8 |
|
Линоленовая |
0,7 |
||
|
Арахидоновая |
0,5 |
||
Таблица 1.2.7. Жирнокислотный состав молочного жира
|
Наименование жирной кислоты |
Массовая доля, % |
|
Масляная |
2,5–5,0 |
|
Капроновая |
1,0–3,5 |
|
Каприловая |
0,4–1,7 |
|
Каприновая |
0,8–3,6 |
|
Лауриновая |
1,8–4,2 |
|
Миристиновая |
7,6–15,2 |
|
Пальмитиновая |
20,0–36,0 |
|
Стеариновая |
6,5–13,7 |
|
Олеиновая |
16,7–37,6 |
|
Миристолеиновая |
1,5–3,5 |
|
Пальмитолеиновая |
1,5–5,6 |
|
Линолевая |
2,0–5,2 |
|
Линоленовая |
0,1–2,1 |
|
Арахидоновая |
0,1–1,7 |
Продуктами биосинтеза олеиновой кислоты в растительных организмах являются линолевая и линоленовая кислоты, выполняющие функцию особого витамина (витамина F). В организме человека данные кислоты не синтезируются и должны поступать с растительной пищей. Некоторые полиеновые кислоты, а именно: арахидоновая (АК), эйкозапентаеновая (ЭПК) и докозагексаеновая кислоты, выполняющие ряд важнейших функций в организме человека, – синтезируются из линолевой и α-линоленовой кислот (рис. 3, 4).
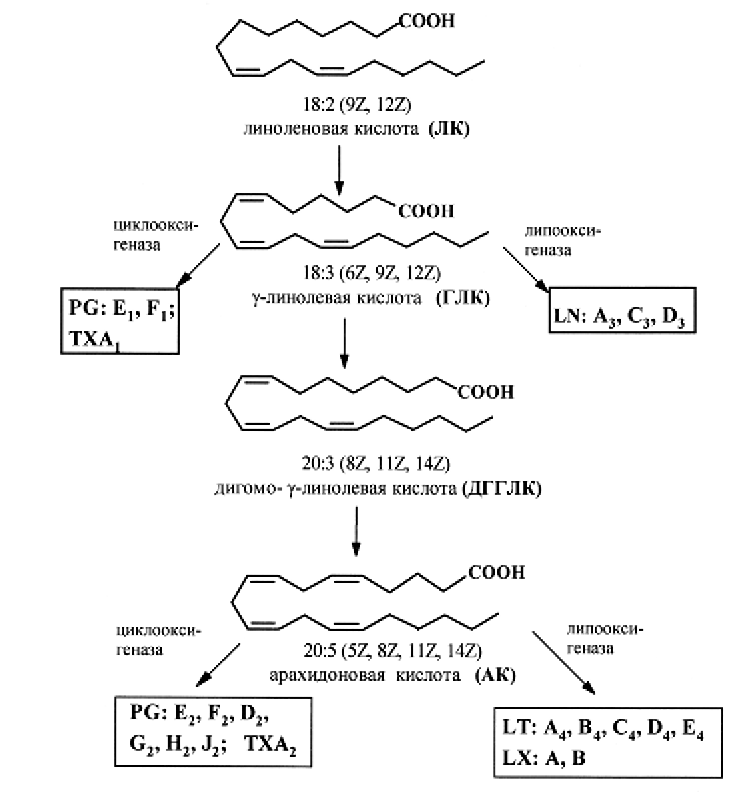
Рис. 3. Схема путей метаболизма ПНЖК семейств w-6:
PG – простагландины; ТX – тромбоксаны; LT – лейкотриены; LХ – липоксины
Линолевую и линоленовую кислоты обычно относят к незаменимым (эссенциальным) кислотам. Кислоты семейства w-9 не относятся к незаменимым.
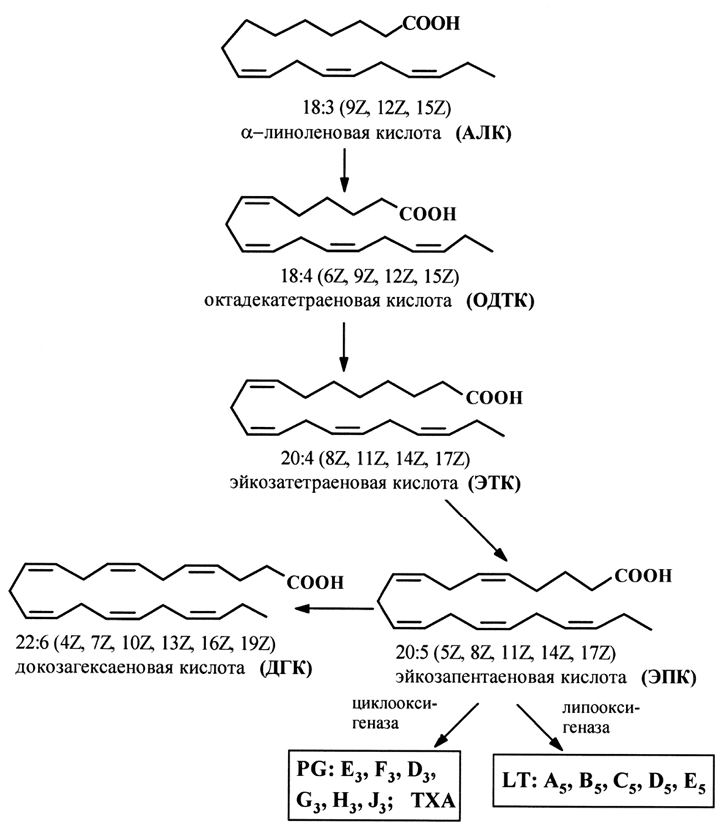
Рис. 4. Схема путей метаболизма ПНЖК семейств w-3:
PG – простагландины, ТX – тромбоксаны, LТ – лейкотриены
В последние десятилетия ведутся интенсивные исследования ПНЖК семейств w-3 и w-6, продемонстрировавшие удивительно широкий спектр их лечебно-профилактического действия. С точки зрения диетотерапии очень важно соблюдать определенное соотношение w-3 и w-6 жирных кислот. Во-первых, эти кислоты осуществляют важные функции в качестве структурных блоков клеточных мембран, выступая регуляторами фазового состояния мембран, и модуляторов биохимических процессов. Во-вторых, они являются предшественниками синтеза биологически высокоактивных эйкозаноидов. Правильное соотношение в продуктах питания w-3, w-6 жирных кислот напрямую связано с механизмом их действия в организме человека, приводящим к биосинтезу различных эйкозаноидов, являющихся биорегуляторами липидной природы.
Эйкозаноиды – оксигенированные производные ПНЖК, содержащие пяти- или шестичленные циклы, имеющие в основной цепи двадцать атомов углерода и обладающие разносторонней физиологической активностью. К эйкозаноидам относятся простогландины, тромбоксаны, лейкотриены и липоксины.
Простагландины (PG), открытые еще в 30-х годах ХХ века, были известны первоначально как вещества, вызывающие сокращение или расслабление гладких мышц. Строение простагландинов установлено лишь в 1962 году. Все простагландины могут рассматриваться как производные простановой кислоты. Они имеют циклопентановое кольцо с кислородсодержащими функциональными группами. Известно 10 типов простагландинов, которые обозначаются буквами латинского алфавита (А, В, С, D, E, F, G, H, I, J).
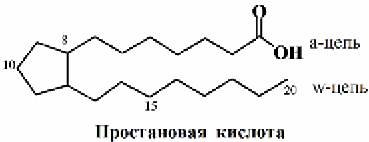
Буквы указывают на характер функционализации кольца, а подстрочные цифровые индексы у букв (1, 2, 3) обозначают количество двойных связей в боковых цепях Ra и Rw.
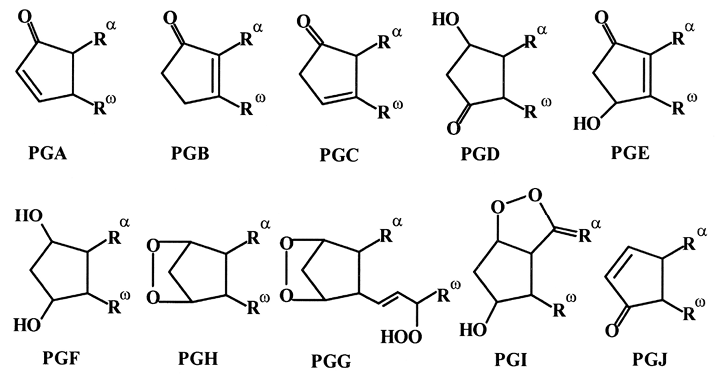
Простагландины типа G и H являются эндопероксидами и рассматриваются как промежуточные продукты для биосинтеза других простагландинов.
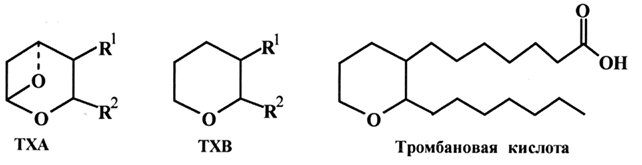
В 1976 году были обнаружены новые метаболиты ПНЖК – тромбоксаны (TX), имеющие в своей структуре тетрагидропирановый цикл. Их можно рассматривать как производные тромбановой кислоты. Известно два типа тромбоксанов (А и В).
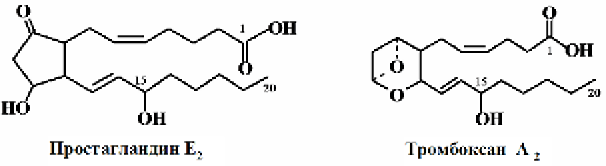
И простагландины и тромбоксаны – карбоновые кислоты, имеющие в основной цепи 20 атомов углерода и аллильную гидроксильную группу у 15-го атома углерода, которая в значительной степени обусловливает их высокую реакционную способность. В качестве примера ниже приведено строение простагландина Е2 – стимулятора гладких мышц, и тромбоксана А2 – мощнейшего стимулятора агрегации тромбоцитов, который сужает кровеносные сосуды и бронхи.
Простагландины и тромбоксаны участвуют в регуляции многих функций организма. Прежде всего они регулируют сокращение гладких мышц, в том числе кровеносных сосудов и матки, оказывают воздействие на сердечно-сосудистую систему. Так, например, простагландины Е1 и Е2 увеличивают кровоток за счет расширения сосудов, что сопровождается снижением кровяного давления. Простагландины типа F вызывают сокращение, а типа Е – расслабление мышц бронхов и трахеи, поэтому PGЕ1 и PGЕ2 используют в аэрозолях для снятия бронхоспазмов, стимулируют активность матки. Простагландины и тромбоксаны являются регуляторами процессов тромбообразования. Так, PGI2 является мощным ингибитором агрегации тромбоцитов и, кроме того, расширяет сосуды, а ТХА2 ускоряет агрегацию тромбоцитов. Следовательно, от соотношения этих эйкозаноидов зависит процесс тромбоцитоза. Влияют простагландины и тромбоксаны и на ряд других функций организма, в том числе и регулирование иммунной системы.
Позднее, в 1979 году, были открыты новые эйкозаноиды – лейкотриены (LT), которые содержат в своем составе систему из трех сопряженных двойных связей и являются регуляторами воспалительных реакций и анафилаксии (болезненная аллергическая реакция немедленного типа). Различают шесть типов лейкотриенов (A, B, C, D, E, F), причем четыре их них (C-F) содержат остаток цистеина или цистеинилпептида.
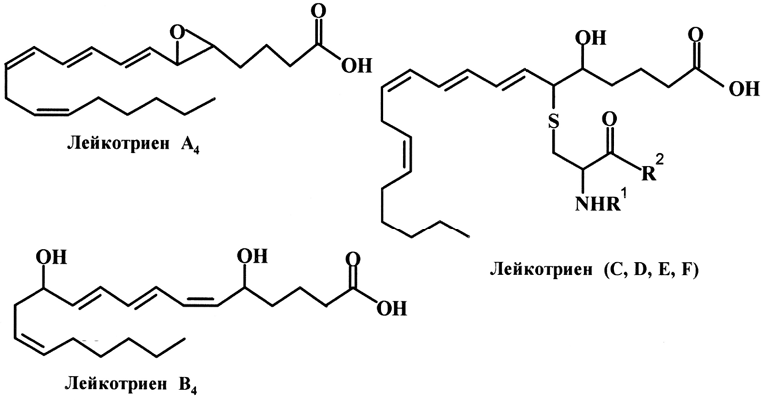
В 1984 году были обнаружены эйкозаноиды, имеющие в своем составе систему из четырех сопряженных двойных связей – липоксины (LX), которые подразделяются на два типа (А и В).
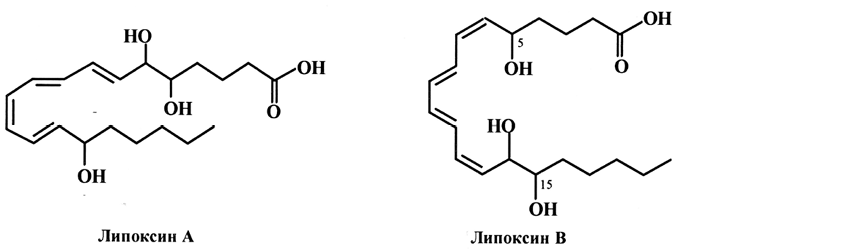
Перечисленные эйкозаноиды являются мощными биорегуляторами, их называют «сверхгормонами», так как они синтезируются в ответ на биологический стимул и, как правило, действуют в очень малых концентрациях. Они обладают широким спектром разнонаправленного действия – регулирование сокращения гладких мышц, в том числе и свертывания крови, воспалительных процессов, передача нервных импульсов, регулирование иммунной системы и ряд других важнейших физиологических функций. Схема метаболизма ПНЖК семейств w-3 и w-6 приведена на рис. 3 и 4.
Поскольку единственным различием между АК и ЭПК является двойная связь, эти жирные кислоты конкурируют между собой за одни и те же ферментные системы. В зависимости от активности ферментов соответствующих клеток эти жирные кислоты под действием циклооксигеназной ферментной системы превращаются в эндопероксиды, из которых затем образуются простагландины и тромбоксаны; под действием липооксигеназной ферментной системы – лейкотриены и липоксины. Таким образом, в результате метаболизма w-3 и w-6 ПНЖК образуется ряд медиаторов (простагландины, тромбоксаны, лейкотриены, липоксины) разнонаправленного биологического действия.
Образованием широкого спектра эйкозаноидов объясняется разнообразный диапазон фармакологических эффектов, характерных для действия ПНЖК на организм: влияние на процессы тромбообразования, свертываемость и вязкость крови, тонус кровеносных сосудов и бронхов, артериальное давление, тонус гладкой мускулатуры матки, процессы секреции, иммунный статус, аллергические состояния. Характер этого действия и его направленность зависят от соотношения исходных w-3 и w-6 эйкозаноидов. Соотношение, в котором эти ПНЖК поступают с пищей, влияет на соотношение синтезируемых в дальнейшем метаболитов жирных кислот w-3 и w-6, что может вызывать нежелательное нарушение обменных процессов. ПНЖК w-3, ингибируя синтез АК, снижают тем самым синтез простагландинов, участвующих в процессах агрегации тромбоцитов. Таким образом, кислоты семейства w-3 помогают сдерживать слипание тромбоцитов, снижают кровяное давление, защищают артерии от появления и нарастания атеросклеротических бляшек, уменьшают вязкость крови и обладают другими терапевтическими эффектами.
Основным источником w-3 кислот являются рыбий жир и рыба (табл. 1.2.5), растительные масла (табл. 1.2.4), особенно льняное, соевое масло, масло грецких орехов. Кислоты семейства w-6 в значительном количестве присутствуют в подсолнечном, кукурузном, сафлоровом масле, семенах черной смородины. Только кислоты этого семейства способны превращаться в γ-линоленовую кислоту, являющуюся предшественником эйкозаноида PGЕ1 (рис. 3), который рассматривается как важнейший защитник организма от преждевременного старения, новообразований, аллергических заболеваний и некоторых других патологических состояний.
По современным представлениям потребление ПНЖК как эссенциального фактора питания должно составлять 4–6% от калорийности суточного рациона. При этом в рационе здорового человека соотношение w-6 и w-3 ПНЖК должно составлять 10:1. При различных патологических состояниях соотношение этих кислот в рационе меняется в сторону увеличения доли линоленовой кислоты и может достигать 5:1, 3:1 и даже 2:1.
Дефицит линоленовой кислоты резко проявляется в младенческом возрасте и в старости, когда процессы метаболизма замедляются. Отсутствие или пониженный уровень ее метаболита – докозагексаеновой кислоты в липидах мозга и сетчатки глаз - влечет к нарушению умственных способностей и ухудшению остроты зрения. Недостаток другого ее метаболита - эйкозапентаеновой кислоты - способствует увеличению синтеза тромбоксанов, что приводит к тромбообразованию. Адекватный уровень потребления линолевой кислоты соответствует 10 г/сут., линоленовой – 1 г/сут. (верхний допустимый уровень потребления – 3 г/сут.).
§ 1.2.3. Трансизомеры высших жирных кислот
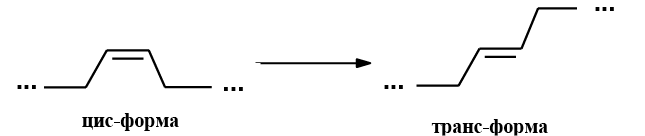
Природные непредельные ВЖК являются в основном цис-изомерами, однако небольшое количество трансизомеров жирных кислот (ТИЖК) может присутствовать в природных жирах
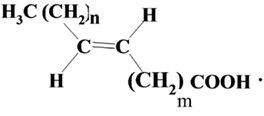
Так, некоторые бактерии желудка жвачных животных, в частности коров, способны продуцировать элаидиновую кислоту (табл. 1.2.2), которая является трансизомером олеиновой кислоты:
Поэтому небольшое количество ТИЖК: элаидиновая и вакценовая, присутствует в животных жирах (говяжий, бараний, свиной, коровье масло) и молочных продуктах. Молочный жир содержит 2,5–7% ТИЖК.
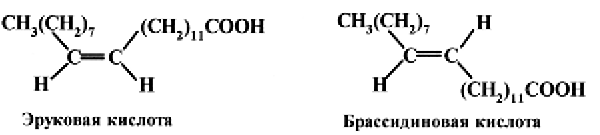
Цис- и трансизомеры ВЖК отличаются не только по конформации, но и по своим физико-химическим свойствам. Так, олеиновая кислота находится в жидком состоянии при температуре выше 13 °С, а ее трансизомер – элаидиновая кислота плавится выше 46,5 °С. Аналогичным образом эруковая кислота, являющаяся цисизомером, плавится при температуре 34 °C, а ее трансизомер брассидиновая кислота – при температуре 61,9 °C.
Рицинолевая кислота имеет температуру плавления 4–5 °С и 7,7–16 °С (полиморфизм), а ее трансизомер рицинэлаидиновая кислота – 53 °С.
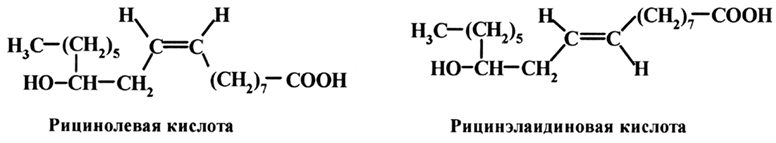
При транспревращении цис-изомеров ПНЖК (линолевой и линоленовой) консистенция жирных кислот не изменяется.
Проблеме трансжиров (трансизомеры жирных кислот) с начала 1990-х годов уделяется пристальное внимание и связано это с тем, что было обнаружено неблагоприятное воздействие повышенного содержания ТИЖК в пище на организм человека. Содержание ТИЖК в природных жирах обычно не превышает 8%, однако оказалось, что в частично гидрированных растительных жирах оно резко возрастает.
Технология гидрирования растительных жиров с целью придания им твердой консистенции была разработана в начале ХХ века. Обычно гидрирование проводят при температуре 180–240 °С в присутствии никелевых и медно-никелевых катализаторов. При этом часть ненасыщенных ВЖК переходит в насыщенные. Дешевое растительное масло превращается в твердую, устойчивую к окислению жировую массу (саломассу), из которой готовят маргарины, кондитерские, кулинарные и фритюрные жиры.
В процессе частичного гидрирования ненасыщенных ВЖК образуются ТИЖК, то есть цисформы переходят в трансформы. Содержание ТИЖК в твердом маргарине составляет 19%, мягком – 11%. С технологической точки зрения снижение содержания ненасыщенных ВЖК и увеличение ТИЖК в жирах приводит к повышению температуры плавления и твердости жировой массы. Получаемые при частичном гидрировании жиры и создаваемые на их основе маргарины дешевле сливочного масла, дольше хранятся, поэтому они стали основой почти всей кулинарной продукции, общепита, индустрии фастфуда. Более того, много лет постулировалось, что маргарины являются более здоровой пищей, чем твердые жиры животного происхождения.
Процессы гидрирования растительных жиров проводятся не только с целью получения твердых жиров, но и для увеличения сроков хранения посредством частичной замены непредельных кислот на предельные. При этом жир может остаться жидким. Эта процедура актуальна и проводится для жиров, имеющих высокое содержание линоленовой кислоты (соевое и льняное масла). Снижение содержания линоленовой кислоты, имеющей три кратные связи, способной к быстрому прогорканию, приводит к большей стабильности масла и увеличению сроков его хранения.
В целом можно сказать, что процессы гидрирования растительных жиров выгодны с технологической точки зрения, так как повышают стабильность, увеличивают сроки хранения жиров, снижают стоимость продукции и предают ей ряд функциональных преимуществ – устойчивость при жарке, пластичность, быстрое плавление, хорошая взбиваемость и т. д. Но гидрирование приводит к ухудшению жирнокислотного состава масел, так как снижает содержание ПНЖК, в том числе кислот ω-3 и ω-6, которые, как показывают исследования последних лет, чрезвычайно важны для нашего организма. Кроме того, гидрирование жиров сопровождается образованием трансжиров, оказывающих неблагоприятное воздействие на организм.
В настоящее время достоверно установлено, что трансжиры повышают риск сердечно-сосудистых заболеваний и атеросклероза, помимо этого, трансжиры, входя в состав фосфолипидов клеточных мембран, нарушают их работу. Страдает транспорт веществ через мембраны, снижается иммунитет, нарушается биохимия воспалительных процессов. Хотя механизмы воздействия трансжиров на биологические системы исследован недостаточно, можно сказать, что практически все биохимические процессы являются комплементарными и замена одного конформера на другой не может не сказаться на течении этих процессов, образуются дефектные биологические структуры, которые начинают давать сбой в самых различных ситуациях. В связи с этим в некоторых странах вышли законы, ограничивающие содержание транс-жиров в продукции.
В 2010 году Европейским парламентом принята «Декларация о регулировании ограничений содержания промышленных транс-изомеров в продуктах питании» и было установлено, что максимальный уровень содержания промышленных трансизомеров во всех ингредиентах питания в странах ЕС не более 2% от общих жиров. В РФ в соответствии с ФЗ № 90 от 2008 года содержание трансжиров не должно превышать 8% от общего содержания жиров в продуктах питания.
Кроме того, нужно отметить, что каталитическое гидрирование приводит к повышенному содержанию никеля в масложировой продукции. В настоящее время никель представляет собой один из основных экотоксикантов и ВОЗ назван одним из наиболее опасных загрязнителей окружающей среды. Главный источник поступления никеля в организм человека с пищей являются гидрированные жиры.
§ 1.2.4. Свойства высших жирных кислот
ВЖК насыщенного ряда при комнатной температуре обычно имеют твердую консистенцию, ненасыщенного – жидкую, а их геометрические и позиционные изомеры – твердую. Температура плавления кислоты зависит от длины углеводородного радикала и степени ненасыщенности. С увеличением длины углеводородной цепи температура плавления повышается, а с увеличением степени ненасыщенности – снижается. Примером могут служить следующие ненасыщенные кислоты.
|
Жирные |
Лауриновая |
Миристиновая |
Пальмитиновая |
|
Температура |
44 |
52 |
63 |
Структура кристаллов ВЖК показывает, что молекулы кислот с длинной нормальной цепью расположены в кристаллах карбоксилами впритык и между ними существует довольно прочная связь. Метильные же хвостовые группы связаны ван-дер-ваальсовыми силами и довольно подвижны, так как каждая углеродная связь свободно вращается. Однако энергетически более выгодна вытянутая форма. Присутствие цисдвойных связей в ВЖК вызывает изгиб углеводородного хвоста примерно на 30º, так как вращение вокруг двойных связей затрудняется, что ведет к ослаблению ван-дер-ваальсовых взаимодействий между углеводородными хвостами ненасыщенных кислот. В результате цисненасыщенные ВЖК имеют менее упорядоченную кристаллическую структуру и более низкую температуру плавления, чем насыщенные.
Увеличение числа кратных связей ведет к усилению этого эффекта, и ВЖК становятся более текучими. Так, стеариновая кислота является твердым продуктом с температурой плавления 70 ºС, олеиновая кислота имеет температуру плавления 13 и 16 ºС, а линолевая и линоленовая кислоты являются жидкими с минусовыми температурами плавления.
|
Жирные кислоты: |
Стеариновая С18 : 0 |
Олеиновая С18 : 1 (9Z) |
Линолевая |
Линоленовая |
|
Температура плавления, ºС: |
44 |
16 и 13 |
–5 |
–11 |
В случае трансформы двойной связи конформация цепь выпрямляется, и она становится близкой к конформации насыщенной цепи (рис. 5).
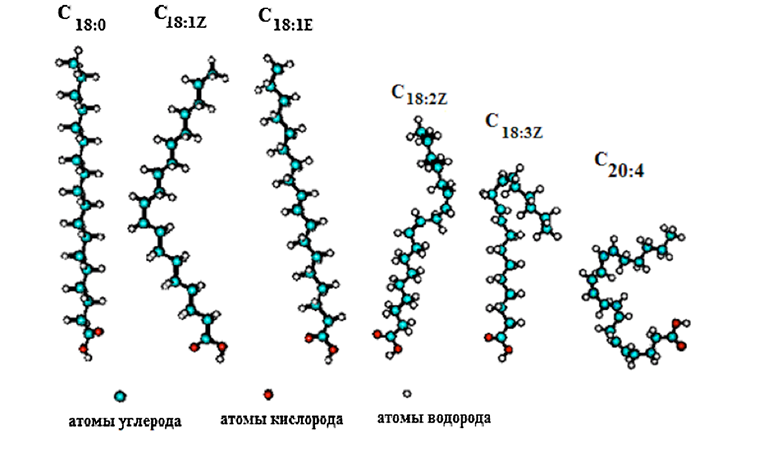
Рис. 5. Строение ВЖК
ВЖК отличаются от низкомолекулярных карбоновых кислот своей бифильностью – карбоксильная группа придает им гидрофильный характер, а длинная углеводородная цепочка – гидрофобность, поэтому ВЖК локализуются на границе раздела фаз (гидрофильная жидкость – липофильная жидкость, жидкость – воздух, твердая фаза – жидкость), что обеспечивает образование жидких дисперсных систем (эмульсии и пены). ВЖК практически нерастворимы в воде, но их натриевые или калиевые соли образуют в воде мицеллы, стабилизируемые за счет гидрофобных взаимодействий (рис. 6). Величины констан ты диссоциации (рK) ВЖК лежат в интервале 4–5.
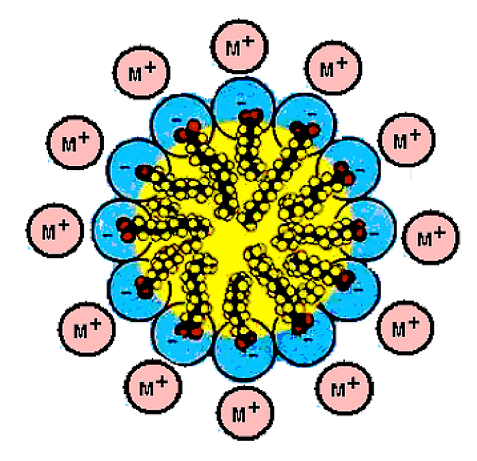
Рис. 6. Мицеллы солей ВЖК
Химические свойства ВЖК определяются наличием в них карбоксильной группы и кратных связей или других заместителей в углеводородном радикале. Реакции по карбоксильной группе типичны для всех карбоновых кислот. ВЖК этерифицируются спиртами с образованием сложных эфиров:
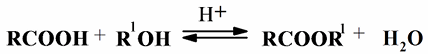
Реакция катализируется кислотами. Этерификация ВЖК глицерином протекает при температуре до 200 ºС в присутствии в качестве катализаторов минеральных кислот, обычно при пониженном давлении для удаления воды.
Другие характерные реакции по карбоксильным группам для ВЖК – образование ангидридов и галоидангидридов, амидов:
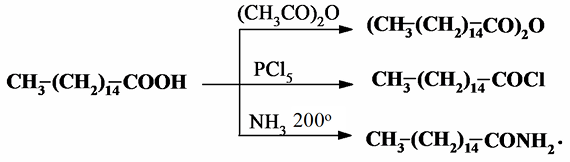
В ряду непредельных ВЖК типичны реакции гидрирования до насыщенных кислот:
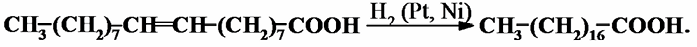
Легко в ВЖК протекают реакции присоединения по кратным связям галогенов – йода, брома и хлора. При комнатной температуре протекают реакции окисления перманганатом калия до гликолей:
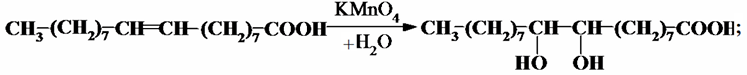
реакции эпоксидирования надкислотами:
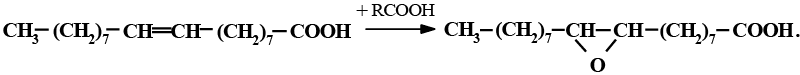
Окисление предельных ВЖК кислородом протекает уже при обычных условиях, хотя и медленно. Реакция окисления ускоряется фотолизом, поэтому жиросодержащие продукты нужно хранить в темноте. Эту реакцию катализируют ферменты липооксигеназы, широко распространенные в растительном и животном мире. Наиболее легко окисляются метиленразделенные полиеновые кислоты (механизм процесса см. в разделе «Порча жиров»).