13.1. Термодинамический и кинетический критерии оценки состояния термодинамической системы
13.2. Скорость химической реакции
13.3. Факторы, влияющие на скорость химической реакции
13.1. Термодинамический и кинетический критерии оценки состояния термодинамической системы
Все химические процессы, наблюдаемые в природе и осуществляемые человеком в его практической деятельности, протекают во времени с определенными скоростями. Направление и глубина химической реакции определяются законами термодинамики. Скорости химической реакций определяются законами химической кинетики. Химическая кинетика, как и термодинамика, является теоретической базой для анализа природных процессов в зависимости от времени протекания процесса.
13.2. Скорость химической реакции
Большинство химических реакций является сложными процессами, протекающими через ряд последовательных и параллельных стадий. Каждая элементарная реакция протекает с определенной скоростью и может влиять на скорость всего процесса. В дальнейшем, говоря о скорости реакции, будем понимать под ней скорость процесса, описываемого определенным суммарным уравнением химической реакции. Определим понятие скорости реакции для элементарной химической реакции, уравнение которой имеет вид:
ν1A1 + ν2A2 + ... + νiAi = κ1B1 + κ2B2 + ... + κjBj
Правилами IUPAС рекомендуется определять скорость химической реакции u как скорость возрастания степени завершенности реакции ξ:
u = dξ/dt (13.1)
Степень завершенности реакции ξ в закрытой системе равна величине изменения количества i-го компонента (моль) в системе, деленной на стехиометрический коэффициент компонента:
ξ = (ni — noi)/νi, (13.2)
ni — число молей i-го компонента через t (сек) после начала реакции, noi — начальное число молей i-го компонента в системе.
Используя соотношения (13.1) и (13.2) получим:
(13.3)
Знак (–) записывается, если ni — число молей исходного компонента реакции. Если сi(моль/л) — молярная концентрация компонента реакции, то ni = V × сi и при постоянном объеме системы для скорости реакции получим соотношение:
(13.4)
где V(литр) — объем сосуда.
13.3. Факторы, влияющие на скорость химической реакции
Во многих случаях скорость реакции пропорциональна концентрации реагирующих веществ сi, возведенных в соответствующие степени:
u = k × (c)ν1 × (c)ν2 × ... (13.5)
где k — константа скорости реакции. Соотношение (13.5) называется кинетическим уравнением и является математическим выражением закона действующих масс: скорость реакции равна произведению концентрации реагентов, участвующих в реакции, возведенных в степени, равные стехиометрическим коэффициентам реакции.
Зависимость константы скорости реакции от температуры. Уравнение Аррениуса. С повышением температуры скорость химической реакции, как правило, возрастает. Понижение скорости реакции с повышением температуры всегда является суммарным результатом для сложной реакции. Для константы скорости реакции Аррениус предложил зависимость константы скорости реакции от температуры в виде уравнения (6):
или в интегральной форме:
k = W × exp(Ea/RT) (13.6)
В уравнении (8) предэкспонента W зависит от числа эффективных столкновений между молекулами, приводящие к химическому превращению компонентов реакции. Eакт — энергия активации реакции; энергия активации — это то избыточное количество энергии (по сравнению со средней величиной), которой должны обладать компоненты реакции, чтобы быть способными к данному химическому взаимодействию. Определив экспериментально константу скорости реакции при нескольких температурах, то (6) можно рассчитать значения W и Eакт. Например, энергия активации равна
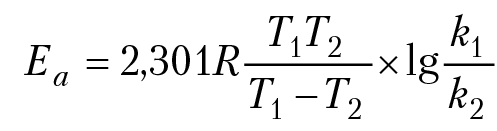
если k1 и k2 — константы скорости реакции при температурах Т1 и Т2. На основании экспериментальных данных для реакции диссоциации двуокиси азота, 2NO2 = 2NO + O2, получили: W = 9,41012 cмз/(моль × сек), Eакт = 112,6 кДж/моль.
13.4. Энергия активации реакции
Превращение одних частиц, в другие, в ходе протекания реакции, предполагает столкновения компонентов реакции. Косвенно это подтверждается увеличением скорости реакции при нагревании. Но не все так просто. Например, при нагревании на 10°, скорость частиц возрастает на 1–2 %, а скорость гомогенной реакции возрастает в 2–4 раза. Кроме того, если бы каждое столкновение оканчивалось актом химического превращения, то все реакции протекали бы со скоростью взрыва. Основываясь на огромном разрыве между числом частиц, вступающих в реакцию (их называют активные частицы), и числом столкновений, имеет смысл предположить, что в реакции участвуют лишь те частицы, энергия которых выше средней энергии частиц по объему реакционной зоны. Как правило, доля этих частиц мала. Избыточная энергия отдельных компонентов реакции, достаточная для протекания реакции, называется энергией активации (рис. 13.1). В химических реакциях происходит разрыв одних связей и образование других. Поэтому следует ожидать, что энергия активации должна быть выше энергии связи атомов в частицах. Однако опыт показывает, что энергия активации меньше энергии связи атомов в частицах. Объяснить этот факт можно, если предположить, что для протекания реакции достаточно уменьшить энергию связи атомов в компонентах реакции путем создания оптимальной конфигурации реагирующих частиц с последующим перераспределением энергии внутри такого образования. В разработанной Г. Эйрингом и М. Поляни теории переходного комплекса предполагается, что скорость образования переходного комплекса много больше скорости распада комплекса. Таким образом, истинная энергия активации — это та энергия, которой должны обладать частицы для образования переходного комплекса.
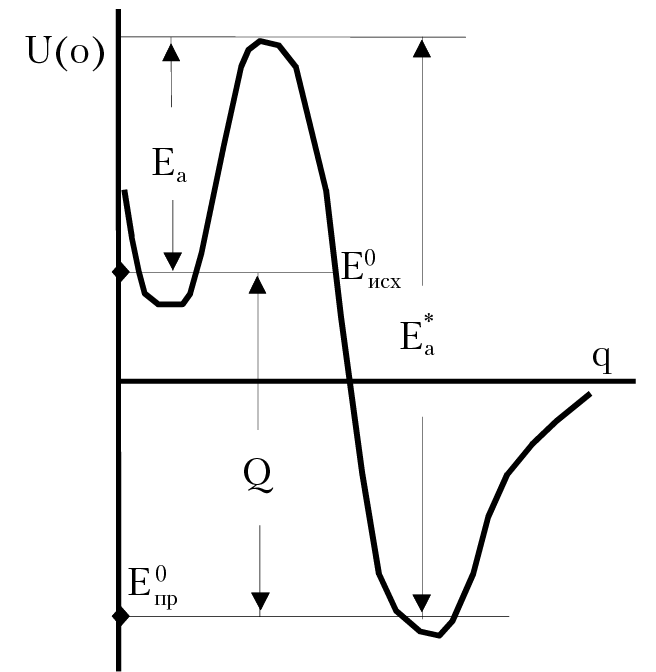
Рис. 13.1. Энергия активации реакции
Е0исх — энергия исходных компонентов реакции; Е0пр — энергия продуктов реакции;
Еа — энергия активации прямой реакции; Е*а — энергия активации обратной реакции;
Q — тепловой эффект реакции
Среди множества конфигураций реагирующих частиц существует одна, образование которой происходит с минимальной энергией. Эта конфигурация активно взаимодействующих частиц называется активированным комплексом (АК). В ходе образования АК система реагирующих частиц описывает некоторые траектории в реакционном пространстве. В каждый момент времени положение частиц на этой траектории может быть охарактеризовано с помощью координаты реакции q. Естественно, что энергия частиц изменяется вдоль координаты реакции и описывается вполне определенной функцией потенциальной энергии взаимодействия частиц U(q). В ходе реакции система переходит из одного устойчивого состояния с энергией Еисх (энергия исходных компонентов реакции) через активированный комплекс с энергией Еа в другое состояние с энергией Епр, которая соответствует энергии продуктов реакции (рис. 13.1). Протекание реакции через активированный комплекс — процесс энергетически более выгодный, чем разрыв химических связей исходных компонентов реакции. Поэтому подавляющее число реакций протекает через активированный комплекс. Исключение составляют фотохимические реакции. Возвращаясь к уравнению Аррениуса для константы скорости реакции, k = A × exp(–Ea/RT), отметим, что предэкспонента А зависит от числа столкновений компонентов реакции, а экспонента — от энергии активации реакции.
13.5. Кинетическая классификация химических реакций
В отношении кинетики химические реакции разделяются или по признаку молекулярности реакции, или по признаку порядка реакции. Молекулярность реакции. Наблюдаемая на опыте скорость химической реакции является совокупностью множества протекающих за единицу времени элементарных химических актов. Число частиц, участвующих в элементарном акте, называется молекулярностью реакции. Молекулярность реакции целое положительное число: 1, 2, реже 3.
Порядок реакции. Порядком реакции называется сумма показателей степеней, в которых входят концентрации реагирующих веществ в кинетическом уравнении (5): r = ν1 + ν2 + ...+ νi. Например, порядок реакции 2СО + О2 = 2СО2 равен трем (r = 3). Кинетическое уравнение (4) для реакции имеет вид (P — давление газа СО):
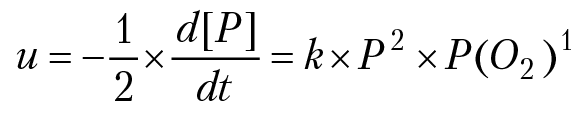
u = –1/2 × d[P]/dt = k × P2 × P(O2)1, r = 2 + 1 = 3. В реальных процессах реакции бывают нулевого, первого, второго и очень редко третьего порядка.

