15.1. Основные понятия и определения термодинамики фазовых равновесий
15.2. Условия фазового равновесия. Правило фаз Гиббса. Минералогическое правило фаз
15.3. Анализ фазовых равновесий в однокомпонентных системах
15.4. Полиморфизм. Энантиотропные и монотропные превращения
15.5. Диаграмма состояния воды
15.6. Диаграмма состояния кварца
15.7. Зависимость температуры плавления минералов от давления
15.1. Основные понятия и определения термодинамики фазовых равновесий
Вещества, образующие систему, могут находиться в различных агрегатных состояниях — твердом, жидком и газообразном. Равновесие между различными агрегатными состояниями называют фазовыми равновесиями. К фазовым равновесиям относят и равновесие между полиморфными формами вещества. Например, минералы кальцит и арагонит имеют одинаковую химическую формулу СаСО3, но разное строение кристаллической решетки. Термодинамическая система, состоящая из различных по своим свойствам частей, разграниченных поверхностями раздела, называется гетерогенной системой. Каждая гетерогенная система состоит из отдельных фаз. Например: вода, лед и пар — гетерогенная, трехфазная, однокомпонентная система.
Фаза — совокупность однородных частей системы по своим химическим и физическим свойствам и которые отделены от других частей системы видимыми (или воображаемыми) поверхностями раздела.
Независимые компоненты системы — вещества, составляющие систему, наименьшее число которых достаточно для того, чтобы создать любую фазу в системе. Число независимых компонентов системы (в дальнейшем изложении просто компоненты системы) будет равно числу веществ, входящих в состав системы, если образование любой равновесной фазы системы может произойти без протекания химической реакции между веществами системы. При наличии химических реакций между веществами системы, число компонентов системы будет равно числу веществ в системе за вычетом числа химических реакций между этими веществами, в результате которых могут быть получены вещества системы. Например, в системе (MgO, СaO, SiO2, СaMgSiO4) три компонента, так как диопсид может быть получен в результате реакции MgO + СaO + SiO2 = СaMgSiO4 ; в системе (СаСО3, СаО, СО2) число компонентов равно двум, так как вещество системы кальцит (СаСО3) может быть получено в результате реакции: СаО + СО2 = СаСО3.
Степени свободы системы: число независимых параметров системы, значения которых можно изменять в некоторых пределах так, что это не приведет к изменению числа фаз в системе. Например, раствор галита NaСl в воде будет однофазной системой, если в 100 г воды растворить до 30 г соли при 25 °С. При P = const, температура и концентрация раствора будут степенями свободы нашего раствора. При небольшом изменении концентрации и температуры раствора число фаз в системе не изменится. Однако, если при постоянной температуре раствора непрерывно повышать его концентрацию, система станет двухфазной — насыщенный раствор соли + кристаллы соли в виде осадка. В момент образования насыщенного раствора один из параметров системы — концентрация — потеряет статус степени свободы: при изменении концентрации раствора изменилось число фаз системы. Соотношение между числом фаз в системе (Ф), числом компонентов системы (К) и числом степеней свободы системы (С) было установлено в 1876 г. Д. Гиббсом и носит название «правило фаз Гиббса»: С = К — Ф + 2.
15.2. Условия фазового равновесия. Правило фаз Гиббса. Минералогическое правило фаз
MgO + СaO + SiO2 + СaMgSiO4
Получим правило фаз. Каждый компонент системы в разной фазе имеет разную концентрацию. Если Ф — число фаз в системе, то каждый компонент в системе имеет Ф различных концентраций. Если К — число компонентов в системе, то число параметров системы, характеризующих концентрации компонентов, будет равно К × Ф. Если концентрации компонентов выражать в молярных долях или в процентах, то для характеристики состава одной фазы достаточно задать (К – 1) концентраций, для характеристики состава Ф фаз достаточно задать (К – 1) × Ф концентраций. Учитывая температуру и давление, общее число параметров системы будет равно (К — 1) × Ф + 2. Концентрации компонентов в разных равновесных фазах связаны условием равенства химических потенциалов этих компонентов в равновесных фазах: µi°= µi° +RT×lg[xif], [xif] — мольная доля i-го компонента в фазе Ф:
µ11 = µ12 = µ13 =. . .= µ1f,
µ21 = µ22 = µ23 =. . .= µ2f,
...........................................
µк1 = µк2 = µк3= ... = µкf,
к — номер компонента в системе.
Всего уравнений, связывающих концентрации компонентов в системе, равно (Ф–1) × К. Разность между числом параметров системы (К–1) × Ф+2 и числом уравнений их связывающих (Ф 1) × К равно числу степеней свободы системы С: С = (К–1) × × Ф + 2 – (Ф–1) × К = К – Ф + 2.
Правило фаз Гиббса: С = К – Ф + 2,
где С — число степеней свободы системы;
К — число компонентов в системе;
Ф — число фаз в системе;
(температура + давление) = 2 обязательные параметры системы.
Минералогическое правило фаз. Природные системы, как правило, многокомпонентные и многофазные. Правило фаз Гиббса позволяет вычислить максимальное число фаз, которые могут находиться в равновесии при фиксированном значении степеней свободы системы. В инвариатной системе (С = О, при фиксированных значениях температуры и давлении) в равновесии могут находиться Ф = К + 2 фазы. В природе процессы образования минералов протекают в широком диапазоне изменения температуры и давления, т. е. эти два параметра всегда обеспечивают, как минимум, две степени свободы системы. Каждый минерал — это отдельно взятая фаза системы. Если в системе К компонентов, то правило фаз Гиббса для природных процессов можно записать в виде неравенства: С ≥ 2, К – Ф + 2 ≥ 2 , Ф ≥ К. Это соотношение установлено В. Гольдшмитом и носит название минералогическое правило фаз Гольдшмита. Например, в системе из трех компонентов: периклаз (MgO) — кварц (SiO2) — корунд (Al2O3) возможны минеральные парагенезисы из трех минералов: форстерит (2MgO×SiO2) + шпинель (MgO×Al2O3) + периклаз (MgO), или корунд (Al2O3) + шпинель (MgO×Al2O3) + кордиерит (2MgO×2Al2O3×5SiO2) и т. д. Добавление четвертого минерала в записанные парагенезисы сделает систему неравновесной, в системе начнут протекать процессы до исчезновения одной из фаз.
15.3. Анализ фазовых равновесий в однокомпонентных системах
Для однокомпонентных систем фазовые переходы связаны с изменением агрегатного состояния или перестройкой кристаллической решетки. Фазовые равновесия в однокомпонентных системах определяются температурой и давлением в системе. Поэтому число степеней свободы может изменяться от двух до нуля, а число фаз, которые могут находиться в равновесии — от одной до трех. Существуют понятия о фазовых переходах первого и второго рода. Согласно Эренфесту, фазовый переход первого рода — это равновесный переход вещества из одной фазы в другую, в котором скачком изменяются первые производные от потенциала Гиббса для данного перехода по температуре и давлению. Примерами фазовых переходов первого рода служат агрегатные превращения вещества, аллотропические превращения. Так как первая производная от потенциала Гиббса по температуре есть энтропия фазового перехода с обратным знаком, [d(∆G)/dT]p = –∆S, а первая производная от потенциала Гиббса по давлению равна изменению объема вещества, [d(∆G)/dP]T = ∆V, именно энтропия и мольный объем вещества скачкообразно изменяются при агрегатных превращениях веществ. При фазовых переходах второго рода (переход железа из ферромагнитного в парамагнитное состояние, металла из обычного в сверхпроводящее состояние и т. д.) скачком изменяются теплоемкость вещества С, коэффициент объемного расширения и сжимаемость вещества. В лекциях мы затронем фазовые переходы только первого рода. При фазовом переходе вещество переходит из первой фазы (Ф1) во вторую (Ф2). Потенциал Гиббса фазового перехода Ф1 → Ф2,
∆G = –(∆S)dT + (∆V)dP
где ∆S — энтропия фазового перехода; ∆V — изменение мольного объема вещества при фазовом переходе. При фазовом равновесии:
∆G = 0 и dP/dT = ∆S/∆V (15.1)
Полученное соотношение называется уравнение Клапейрона—Клаузиуса. С помощью уравнения К-К можно вычислить, на сколько изменится давление в системе при изменении температуры системы, если до этого имело место фазовое равновесие.
15.4. Полиморфизм. Энантиотропные и монотропные превращения
Полиморфизмом называют способность вещества изменять строение кристаллической структуры (кристаллизоваться в различных модификациях) при изменении внешних условий. Явление полиморфизма было открыто в 1821 г. немецким минералогом Э. Митчерлихом. В различных полиморфных модификациях существует углерод, кремний, фосфор, железо, лед, кварц, карбонат кальция и т. д. При превращении высокотемпературной модификации в более низкотемпературную обычно первоначальная внешняя форма кристаллов сохраняется, в то время как внутренняя структура вещества претерпевает изменения. Такое сохранение внешней формы, не отвечающей вновь образованной структуре кристаллической решетки, получило название параморфозы. Известны параморфозы b-кварца, кальцита и др. Существуют два вида полиморфных превращений — энантиотропные и монотропные. Если каждая из модификаций вещества имеет свою область устойчивости и возможно обратимое превращение одной модификации в другую при вполне фиксированных значениях температуры и давления, такое превращение называется энантиотропным. Примером энантиотропного превращения является переход ромбической α-серы в моноклинную β-серу и обратно. Превращение одной модификации в другую, при котором обратный переход невозможен, называется монотропным. Монотропные модификации не могут находиться в равновесии друг с другом. Примером монотропного перехода служит превращение ромбического арагонита СаСО3 в кальцит.
15.5. Диаграмма состояния воды
Вода может находиться в трех агрегатных состояниях: жидком, твердом (лед) и газообразном (пар). Агрегатное состояние воды зависит от температуры и давления паров воды. Отметим основные особенности фазовых равновесий для воды (рис. 15.1). В твердом состоянии для воды имеет место явление полиморфизма — наличие различных кристаллических модификаций льда (до семи модификаций). До давления Р = 2 × 108 Па и Т = 251 °К плавление льда сопровождается уменьшением объема ∆V = Vж – Vт < 0, лед данной модификации называется лед I. При более высоких давлениях в устойчивом равновесии с водой находятся модификации льда III–VII, плавление которых сопровождается увеличением объема.
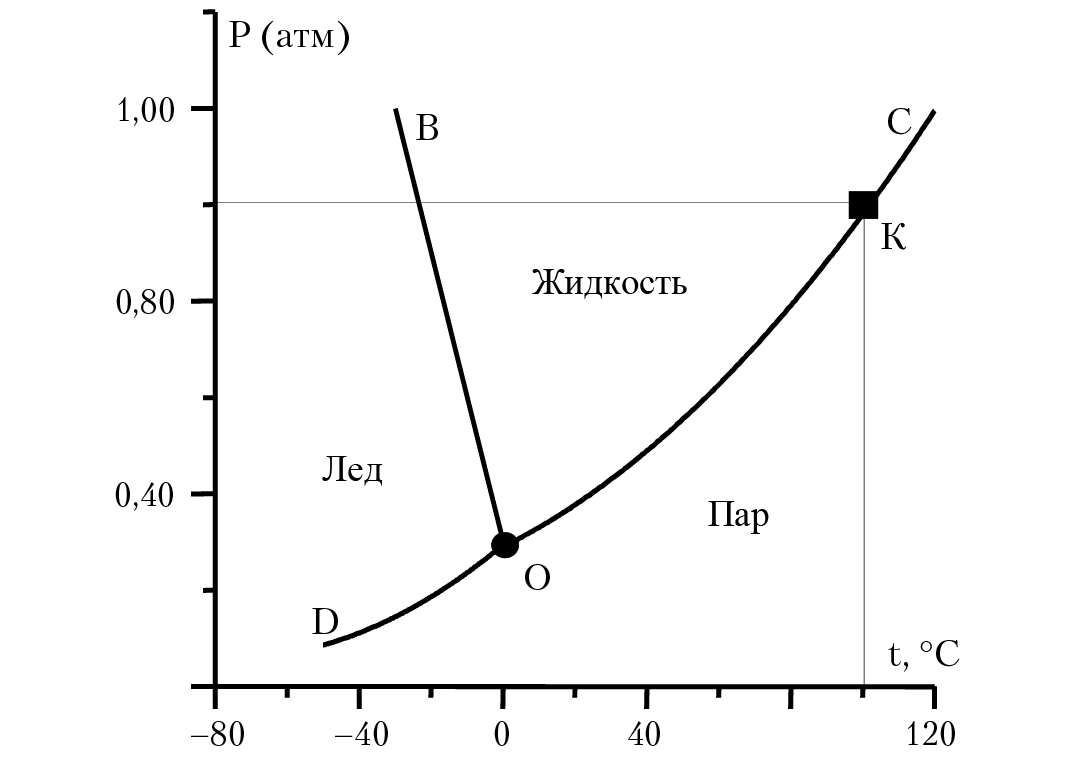
Рис. 15.1. Диаграмма состояния воды
При температуре Т = 273,16 К и давлении паров воды 610,48 Па (4,579 мм рт. ст.) в равновесии будут три фазы — лед, вода, пар (тройная точка воды). В точке К (647,35 °К, давление 226 бар). Кривая ОК соответствует равновесию «жидкость — пар». Уравнение этой кривой можно получить из уравнения К-К (15.1): dP/dT = ∆S/∆V.Уравнение К-К описывает зависимость давление в системе от температуры при фазовых равновесиях. В нашем случае левая часть равенства — это зависимость давления паров воды от температуры жидкости; числитель правой части равенства — изменение энтропии воды при испарении одного моля жидкости. Если температура воды Т, ∆S = ∆H/T; ∆H — энтальпия испарения одного моля воды при температуре Т. ∆V — изменение объема жидкости при испарении одного моля воды; ∆V = Vпар – Vжидк (напомним, что при работе с уравнением К-К температура всегда измеряется в градусах Кельвина). Считаем, что пар подчиняется уравнению состояния идеального газа PV = RT, отметим, что объем одного моля пара (22 400 см3) много больше объема одного моля жидкости (18 см3), а энтальпия фазового перехода не зависит от температуры. Тогда ∆V = Vпар = V, V = RT/P. Подставим полученные соотношения в уравнение К-К:
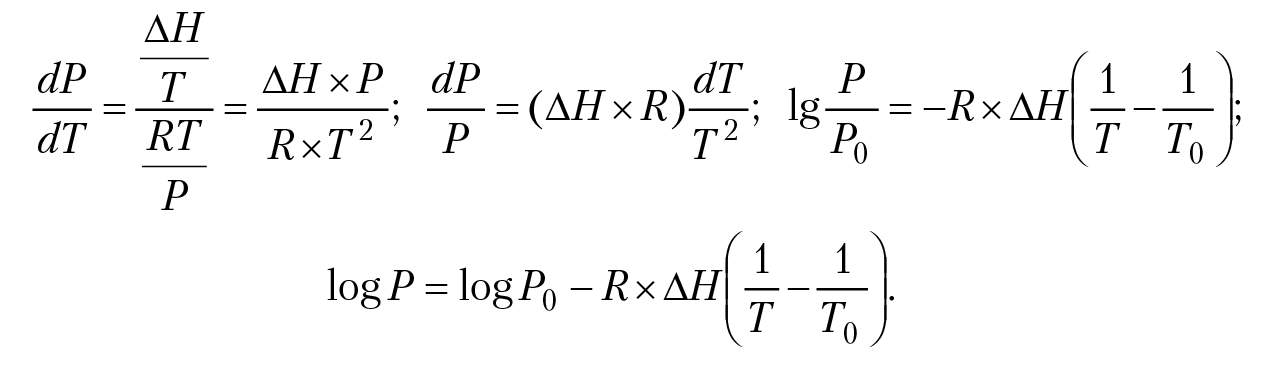
Для воды при Т = 373 °К, Р0 = 1 бар. Подставляя в полученное уравнение энтальпию испарения воды ∆H = 40617(Дж/моль) и значение R= 8,31 (Дж/моль × К), получим уравнение кривой ОК: lgP = 905 – 337 528/T.
Не составляет труда получить соответствующие уравнения для участков кривых OB и OD.
15.6. Диаграмма состояния кварца
Диоксид кремния SiO2 являтся однокомпонентной системой с весьма сложным полиморфизмом. В природе встречается одиннадцать кристаллических полиморфных модификаций и две стеклообразные формы кварца (рис. 15.2). Три главные полиморфные модификации кварца (модификации первого порядка) — кварц, тридимит и кристобалит — энантиотропны, резко различаются между собой по структуре и физико-химическими свойствам и имеют низко- и высокотемпературные модификации. На рис. 15.2 (диаграмма Финнера) по оси OY в условных единицах откладывается давление насыщенного пара диоксида кремния (очень малые значения). Анализ фазовых равновесий диоксида кремния показывает, что при повышенных давлениях возможно прямое превращение α-кварц -> α-кристобалит и α-кварц -> расплав.

Рис. 15.2. Диаграмма фазовых равновесий SiO2
Особенно заметно влияние давления на рост температуры полиморфных превращений α-кварц ↔ α-тридимит и α-кварц ↔ α-кристобалит. В присутствии воды при высоких давлениях области устойчивости модификаций кремнезема сместятся: линия ликвидуса кристобалита понижается (рис. 15.3). При давлении паров воды выше 40,0 МПа расплавленный тридимит сразу переходит в водную суспензию. Таким образом, кристобалит и, особенно, тридимит в присутствии воды становятся неустойчивыми. С повышением давления сверх 140 МПа тридимит вообще не образуется в качестве стабильной фазы, а аморфный кварц образует суспензию с водой. В области относительно низких температур при охлаждении из насыщенных растворов выделяется гель кремнезема, который постепенно превращается в метастабильный кристобалит. Со временем, в присутствии насыщенного кремнеземом раствора, кристобалит превращается в кварц.
Скорость фазовых превращений для раз личных модификаций диоксида кремния различная. Превращения между главными модификациями кварца (α-кварц ↔ α-тридимит, α-тридимит ↔ α-кристобалит), связанные с глубокой перестройкой кристаллической решетки, протекают очень медленно, Превращения между модификациями второго порядка (α-кварц ↔ β-кварц, α-тридимит ↔ β-тридимит ↔ γ-тридимит), протекают с большими скоростями.
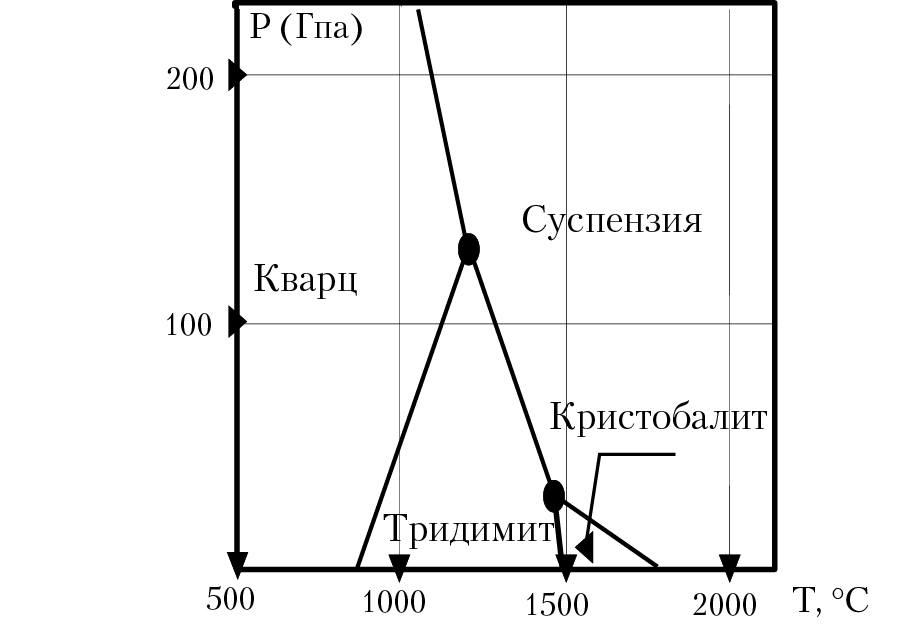
Рис. 15.3. Диаграмма состояния системы SiO2 — H2O
15.7. Зависимость температуры плавления минералов от давления
Плавление вещества — это фазовый переход (тв. фаза) → (расплав). Уравнение К-К для анализа данного фазового равновесия надо записать в виде соотношения dT/dP = ∆V/∆S; или dT = ∆V/∆S × × dP. В этом уравнении ∆V = Vжид — Vтв, Vжид — объем одного моля вещества в жидком состоянии, Vтв — объем одного моля вещества в твердом состоянии, ∆S — энтропия плавления вещества. Считая, что ∆V не зависит от давления, ∆S — от температуры, интегрируя последнее уравнение, получим:
(15.3)
T0 — температура плавления вещества при давлении P0.
Задача 15.1. Рассчитать температуру плавления диопсида СaMg(SiO3)2 при давлении 5000 атм.
Решение: справочные данные: ∆V = 7,15 (смз/моль) = 7,15 × 10–6 (мз/моль), ∆S = 57,8 Дж/(мольК). T0 = 1665 °K (P0 = 1 бар = 105 Па). P = 5000 атм = 4,9 × 108 Па. Подставляя справочные данные в уравнение (15.3) получим: T = 1665 °К + 61 °К = 1726 °К.
Отметим, что возможность получить экспериментально диаграмму состояния однокомпонентной системы и возможность рассчитать диаграмму позволяет уточнить термодинамические параметры вещества.

