11.1. Основные определения и понятия электрохимии
11.2. Окислительно-восстановительные реакции в растворах
11.3. Окислительно-восстановительный потенциал раствора
11.4. Измерение окислительно-восстановительного потенциала раствора
11.5. Водородный электрод сравнения
11.6. Анализ окислительно-восстановительных реакций в растворе
11.1. Основные определения и понятия электрохимии
Окислительно-восстановительными реакциями (ОВР) называют такие реакции, которые протекают с изменением степени окисления атомов, входящих в состав реагирующих веществ. Сущность окислительно-восстановительной реакции состоит в переходе всех или части валентных электронов от восстановителя к окислителю. Горение угля — типичный пример окислительно-восстановительной реакции: С + О2 = СО2. В этой реакции кислород принимает электроны от углерода. Говорят, что углерод окисляется, кислород — восстанавливается. В окислительно-восстановительной реакции должны присутствовать атомы, которые изменяют степень окисления. Степенью окисления атома называют условный электрический заряд (в единицах заряда электрона), который получил бы данный атом, если бы каждая пара электронов, связывающая его с другим атомом, полностью переместилась бы к более электроотрицательному атому. Для определения степени окисления данного атома в химическом соединении придерживаются следующих правил.
1. Степень окисления атомов в простых веществах равна нулю. Например, степень окисления атомов кислорода, азота, железа в молекулах N2, O2, Fe равна нулю.
2. Металлы всегда имеют положительную степень окисления.
3. Водород во всех соединениях, кроме гидридов металлов (NaH, СаН2 и др.), имеет степень окисления +1; в гидридах металлов степень окисления водорода –1.
4. Степень окисления кислорода равна –2. Исключение составляют пероксиды (H2O2, N2O2). В этих соединениях степень окисления кислорода –1; в соединениях KO2, OF2, O2F2 степень окисления кислорода соответственно: –1/2, +2, +1. 5. Степень окисления одноатомного иона всегда равна его заряду. Например, для Са2+, Fe3+ степень окисления кальция +2, железа +3. Степень окисления остальных атомов может быть как положительной, так и отрицательной. Например, степень окисления азота в частицах N2, N2O, NO, NO2, NO2–, NO3–, NH4+ равна соответственно: 0, +1, +2, +4, +3, +5, –3. Отметим, что изменение степени окисления атома в результате ОВР не всегда связано с отдачей или присоединением электронов. Может иметь место смещение электронного облака валентных электронов от одного атома к другому.
11.2. Окислительно-восстановительные реакции в растворах
Окислительно-восстановительные реакции могут протекать в газовой фазе, в растворах и при взаимодействии твердых фаз. Мы займемся исследованием ОВР в растворах. Для этого нам надо будет записывать уравнения ОВР. Окислительно-восстановительные реакции протекают по сложному и не во всех случаях детально изученному механизму. Как правило, уравнения окислительно-восстановительных реакций отражают не реальное их течение, а лишь конечный результат. Однако уравнение окислительно-восстановительной реакции дает возможность определить количественные соотношения концентраций реагирующих веществ, а в ряде случаев указывают и условия протекания реакции. Мы будем записывать ОВР в молекулярной форме, в ионной форме и в виде окислительно-восстановительной полуреакции. Например, реакцию восстановления серебра из соли можно записать:
• в молекулярной форме в виде уравнения:
2AgNO3 + Zn = Zn(NO3)2 + 2Ag
• в ионной форме:
2Ag+ Zn = 2Ag + Zn2+
• в форме полуреакций:
1) полуреакция восстановления ионов серебра:
2Ag+ 2e = 2Ag
2) полуреакция окисления цинка:
Zn — 2e = Zn2+
Отметим, что почленное сложение полуреакций должно давать уравнение ОВР в ионной форме:
2Ag+ 2e = 2Ag
+ Zn – 2e = Zn2+
______________________________
2Ag+ Zn = 2Ag + Zn2+.
Выбор формы записи уравнения окислительно-восстановительной реакции зависит от конкретной задачи, решение которой необходимо найти.
11.3. Окислительно-восстановительный потенциал раствора
Одну из задач термодинамики окислительно-восстановительных процессов можно сформулировать следующим образом: предсказать, в каком направлении будут протекать ОВ реакции в данном растворе при его взаимодействии с веществами, которые мы привнесем в раствор. Одной из характеристик, которая поможет решить задачу, является окислительно-восстановительный потенциал раствора.
Определение. ОВ потенциалом раствора называется электродный потенциал (∆φ), возникающий на инертном электроде (например, на платиновой пластинке), опущенным в данный раствор.
Электродным потенциалом ∆φ называется разность потенциалов между металлическим электродом и раствором. В общем случае достаточно сложно бывает разобраться, в результате каких физико-химических процессов на металлическом электроде, опущенном в раствор, возник потенциал. Но так как потенциал на электроде может измениться только в том случае, если электроду сообщить заряд (или, наоборот, удалить с электрода электрический заряд), значит имеет смысл считать, что при взаимодействии электрода с раствором имеет место обмен электрическими зарядами между электродом и компонентами раствора. Как правило, взаимодействие платинового электрода с раствором заканчивается на стадии переноса электронов с поверхности или на поверхность электрода от компонентов раствора. Например, если опустить платиновый электрод в раствор солей марганца MnСl2 и KMnO4, то на электроде возникнет положительный потенциал, величина которого будет зависить от концентрации солей марганца и рН раствора. Возникновение потенциала на электроде можно объяснить следующим образом. При растворении солей марганца равновесие между ионами MnO4– и Mn2+ устанавливается в результате реакции: MnO4– + 5e + 8H+ = Mn2+ 4H2O. Необходимые для установления равновесия электроны компоненты раствора могут «позаимствовать» с платинового электрода. Запишем уравнение Вант-Гоффа для данной реакции: ∆G° = ∆G°298 + RTln([Mn2+]/[MnO4–]) – RTln[H+]8. В данном случае изобарный потенциал реакции имеет ясный физический смысл: ∆G° = –A, где А — работа по переносу электронов с поверхности электрода к компонентам раствора. С другой стороны, работа по переносу электрического заряда A = ∆φ × q; ∆φ — есть разность потенциалов между раствором и электродом, т. е. ОВ потенциал раствора, ∆G° = –∆φ × q. В электрохимии электродные потенциалы измеряются относительно электрода сравнения. В свою очередь, потенциал электрода сравнения измеряется относительно стандартного водородного электрода φ0, потенциал которого по определению равняется нулю, φ0 = 0 (см. разделы 1.4–1.5 данной главы). Таким образом, независимо от того, какой электрод сравнения используется при измерении ОВП раствора, ОВП раствора определяется относительно стандартного водородного электрода. Будем обозначать ОВ потенциал раствора, измеренный относительно стандартного водородного электрода, символом Eh, тогда ∆φ = Eh; если Е(В) напряжение между измерительным электродом и электродом сравнения, тогда E = Eh – φ0; так как φ0 = 0 по определению, Eh = Е. ∆φ можно вычислить по уравнению ∆φ = –∆G°/q, значить можно вычислить и ОВ потенциал раствора, измеренный относительно стандартного водородного электрода: Eh = –∆G°/q, где ∆G° — изобарный потенциал ОВ реакции, которая протекает в данном растворе.
11.3.1. Уравнение Нернста
Вернемся к анализу ОВ свойств раствора, равновесие между компонентами которого устанавливается в результате ОВ полуреакции:
Ox + ne + kH+ = Red + (k/n)H2O
В данном уравнении Ох — компонент реакции, который присоединяет n электронов в результате протекания ОВР, т. е. восстанавливается. Продуктом восстановления Ох является компонент реакции Red. При восстановлении одного моля ионов Ох будет перемещен заряд q = n × F, F = 96 485 (Кл/моль) (постоянная Фарадея F равна произведению заряда e электрона на число Авагадро NA, F= e ⋅ NA; таким образом F — это моль электрического заряда). Далее, если присоединение электронов инициирует реакцию:
Ox + ne + kH+ = Red + (k/n)H2O
тогда изобарный потенциал реакции
∆G° = –A = –q × Eh = –n × F × Eh и
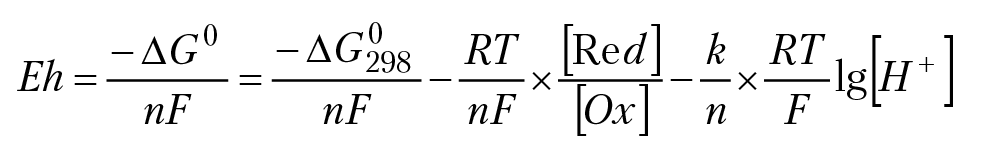
Для T = 298,15K, (RT/F)lnX = 0,059lgX; пусть Eh0 = –∆G°298/nF, lg[H+] = –pH, тогда:
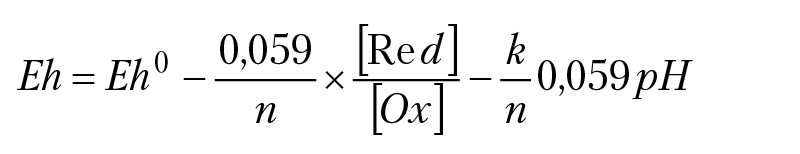
Полученное уравнение называется уравнение Нернста для ОВ реакции
Ox + ne + kH+ = Red + (k/n)H2O
Оно связывает ОВ потенциал раствора, с концентрацией компонентов раствора при равновесии. Так как Eh0 определяется через стандартный изобарный потенциал реакции, то Eh0 называется стандартный ОВ потенциал раствора. При возрастании концентрации компонента Ox возрастает ОВ потенциал раствора Eh. Возрастание ОВ потенциала раствора с ростом концентрации частицы, способной принимать электроны (Ох), можно трактовать как возрастание окислительных способностей раствора. Отметим, что при равновесии раствора установится вполне определенное значение ОВ потенциала раствора, определяемое отношением концентраций потенциалобразующих компонентов раствора и рН раствора:
Eh = Eh0 – 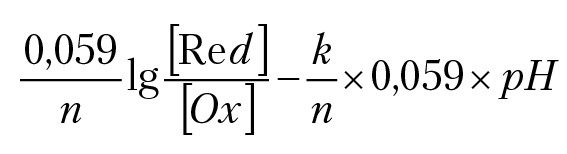
Отметим «инерционность» ОВ потенциала по отношению к изменению концентраций ионов в растворе. Пусть f = [Red]/[Ox]: если f изменить в 10 000 раз, ОВ потенциал раствора f изменится меньше, чем на 4 %. Но если изменить рН раствора всего вдвое, ОВ потенциал раствора измениться больше, чем на 13 %, поэтому говорят, что ОВ потенциал раствора определяется значением Eh0 и рН раствора. ОВ потенциал раствора может быть положительным, а может быть и отрицательным. В первом случае говорят, что раствор проявляет окислительные свойства, т. е. при попадании в данный раствор вещества, оно может быть окислено компонентами раствора. Во втором случае раствор проявляет ярко выраженную способность к восстановлению вещества. Такая ситуация может возникнуть в растворе, который находится в равновесии с сероводородом и кристаллической серой. Уравнение электродного процесса в этом случае имеет вид: Sкр + 2e + 2H+ = H2Sгаз, ОВ потенциал раствора можно вычислить по уравнению Нернста:
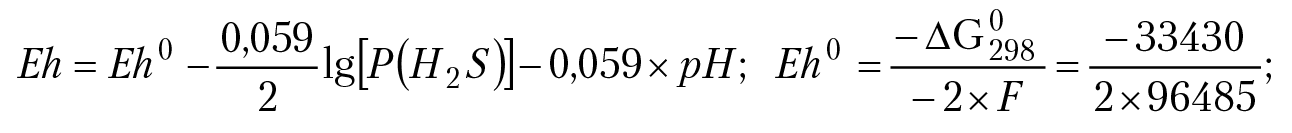 Eh0 = –0,17 B.
Eh0 = –0,17 B.
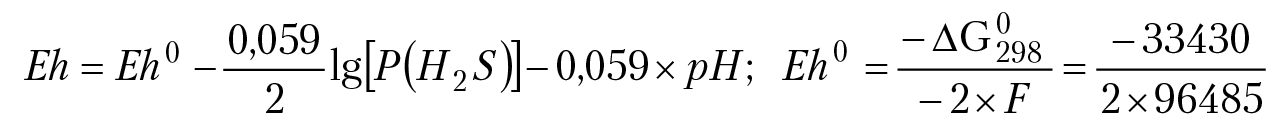
При возрастании давления газа над раствором (при возрастании концентрации восстановителя в растворе) уменьшается ОВ потенциал раствора. Следует отметить, что ОВ потенциал раствора является важнейшей характеристикой раствора, в котором протекает окислительно-восстановительная реакция. Так как можно измерить только разность потенциалов, необходимо договориться о точке отчета потенциала. Это можно сделать примерно так же, как это было сделано при определении стандартной энтальпии и стандартного изобарного потенциала образования вещества, т. е. постулировать значение потенциала специально сделанного электрода. В разделах 1.4 и 1.5 обсуждается данная проблема.
11.4. Измерение окислительно-восстановительного потенциала раствора
Известно, что потенциал может быть определен с точностью до константы, значение которой должно быть определено. Поэтому, когда заходит речь об ОВ потенциале раствора, необходимо иметь точку отсчета потенциала. С другой стороны, не представляет труда измерить разность потенциалов. Если собрать гальванический элемент, рис. 11.1, в котором одним электродом будет служить платиновая пластинка, опущенная в раствор, для которого надо определить ОВ потенциал (такой электрод называют редокс-электрод), а вторым электродом — специально изготовленный электрод, потенциал которого есть величина постоянная (этот электрод называется электрод сравнения), то ЭДС такого элемента E = φ – φc (φ — редокс-электрод, φс — электрод сравнения). Таким образом, ОВ потенциал раствора будет равен: φ = Е + φ0.
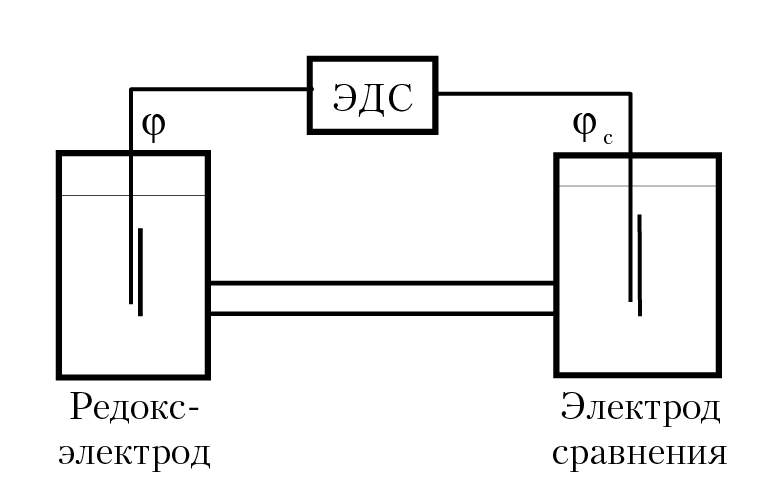
Рис. 11.1. Схема измерения ОВ потенциала раствора
В настоящее время используются электроды сравнения самой разной конструкции. Но независимо от типа электрода сравнения, потенциалы электродов сравнения измерены относительно стандартного водородного электрода сравнения, потенциал которого принят равным нулю. В настоящее время в мировой практике используют каломельный электрод сравнения и хлорсеребряный электрод как наиболее удобные в работе. Потенциал каломельного электрода определяется ОВ реакцией Hg2Сl2 + 2e = 2Hg+2Сl+. Потенциал электрода (относительно водородного электрода сравнения) равен 0,2438 вольта. На хлорсеребряном электроде осуществляется процесс: AgСl = Ag+ Сl–; Ag+ e = Ag. Этот электрод представляет собой серебряную проволочку, на которую нанесен слой трудно растворимого хлорида серебра и помещенную в насыщенный раствор KСl. Потенциал электрода равен 0,2218 вольта. Отметим еще раз: независимо от того, каким образом получено значение окислительно-восстановительного потенциала раствора (или электрода), его значение определено относительно стандартного водородного электрода. Потенциал стандартного водородного электрода принят равным нулю при любой температуре.
11.5. Водородный электрод сравнения
Все измерения и расчеты потенциалов в электрохимии делаются относительно стандартного водородного электрода. Конструкции водородных электродов очень разнообразны, что, впрочем, не имеет существенного значения, если соблюдены необходимые условия правильной работы этих электродов. На рисунке 11.2 приведена конструкция одного из самых распространенных водородных электродов. Платиновую пластинку частично погружают в раствор соляной кислоты с активностью ионов Н+ равной единице. В растворе соляной кислоты с моляльной концентрацией [Н+] ≈ 1 (моль/кг) активность ионов водорода близка к единице, поэтому в расчетах вместо активности будем использовать концентрацию ионов водорода. В момент измерения потенциала через раствор пропускают водород так, чтобы он омывал платиновую пластинку. Если температура раствора будет 298,15 °К, давление водорода 1 бар, активность ионов водорода в растворе будет равна единице, тогда потенциал платиновой пластины принимается равным нулю. Так как на электроде идет реакция Н+ + е = 0,5 Н2, согласно уравнению Нернста, потенциал платинового электрода будет равен:
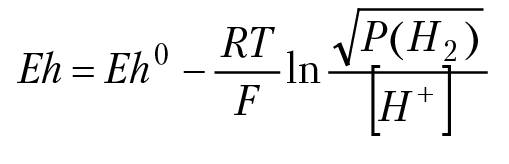 ;
;
F = 96 485 Кл/моль. Так как стандартный изобарный потенциал реакции Н+ е = 0,5 Н2 равен нулю, выражение под знаком логарифма равно единице (т. е. логарифм равен нулю), значит потенциал водородного электрода при стандартных условиях равняется нулю.
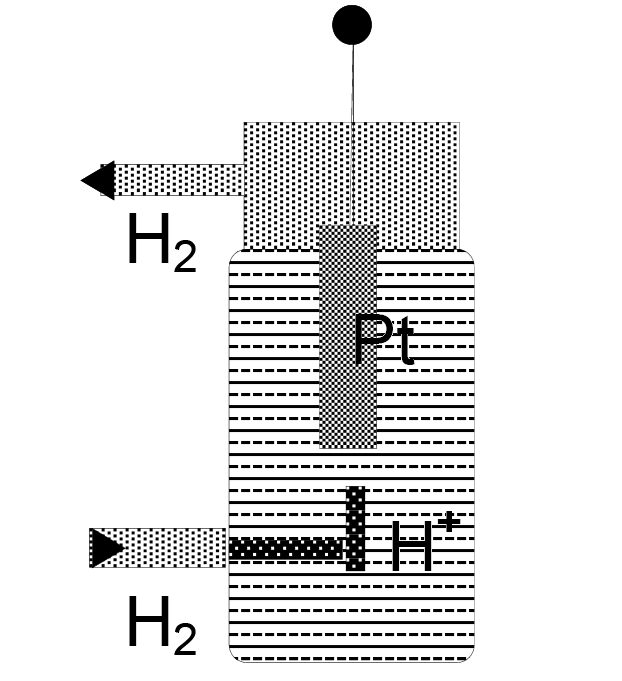
Рис. 11.2. Водородный электрод
11.6. Анализ окислительно-восстановительных реакций в растворе
Проведем анализ ОВ реакции, которая будет протекать в растворе, если в одну емкость слить раствор солей марганца (MnСl2,KMnO4) и раствор солей железа (FeСl2,FeСlз). Пусть рН растворов будет 4, отношение концентраций ионов марганца f1 = [Mn2+]/[MnO4–] и ионов железа f2 = [Fe2+]/[Fe3+] . Запишем уравнение Нернста для раствора солей марганца:
MnO4–+ 5e + 8H+ = Mn2+ 4 H2O
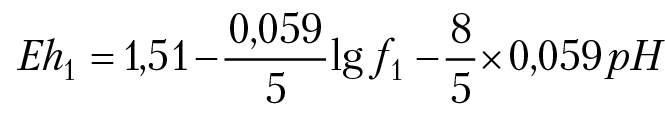
Так как в реальных растворах f1 ≈ 10±5 , вклад второго слагаемого в значение ОВ потенциала будет незначительный, поэтому Eh1 ≈ 1,51 – 0,9944 × 4 = 1,13В при рН = 4. ОВ потенциал второго раствора определяется полуреакцией Fe3+ e = Fe2+ и равен: Eh2 = 0,76 – 0,059lgf2 ≈ 0,76 B.
Так как Eh1 > Eh2, можно сказать, что раствор солей марганца по отношению к раствору солей железа, следует рассматривать как окислитель; это означает, что если мы сольем эти два раствора в одну емкость, компоненты раствора марганца будут окислять компоненты раствора солей железа. В растворе будут протекать реакции:
1| MnO4– + 5e + 8H+ --> Mn2+ 4 H2O, восстановление
+ 5| Fe2+ – e ---> Fe3+ окисление,
________________________
MnO4– + 5Fe2+ 8H+ = Mn2+ 5Fe3+ 4 H2O.
Ион MnO4– окисляет ион Fe2+. В результате протекания реакции изменится соотношение концентраций ионов в растворе: f1 = [Mn2+]/[MnO4–] увеличится, f2 = [Fe2+]/[Fe3+] уменьшится! ОВ потенциал раствора, когда установиться равновесие, можно вычислить по уравнению Нернста:
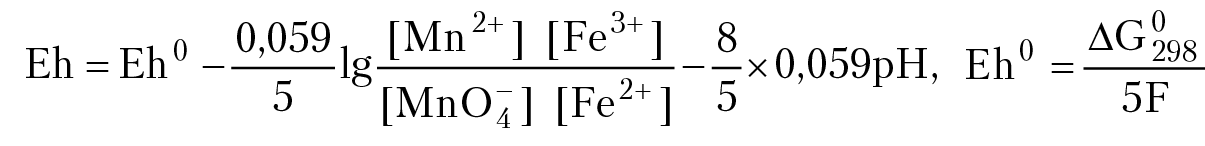
∆G°298 — стандартный изобарный потенциал реакции:
MnO4– + 5Fe2+ 8H+ = Mn2+ 5Fe3+ 4 H2O
Обратим внимание на тот факт, что при определении направления ОВ реакции мы воспользовались значениями ОВ потенциалов растворов. Раньше для определения направления реакции, мы анализировали значение изобарного потенциала реакции. Необходимо понимать, что мы не сформулировали новый критерий направленности реакций, а просто выразили его в новых обозначениях. Весь математический аппарат анализа ОВ реакций базируется на втором законе термодинамики, т. е., в конечном счете, на понятии о термодинамическом потенциале Гиббса.
11.6.1. Формы нахождения элементов в растворе с учетом окислительно-восстановительных реакций
В разделе 6.3 было показано, что формы нахождения элементов в растворе зависят от рН раствора. Если в растворе изменяется окислительно-восстановительный потенциал, то при наличии в растворе элементов с переменной степенью окисления формы нахождения будут зависеть от рН и Eh раствора. Рассмотрим схему расчета форм нахождения элемента в этом случае на примере серы.
Задача 11.1. Рассчитать формы нахождения серы в растворе с учетом ОВ реакций.
Решение: считаем, что серу в растворе можно обнаружить в виде частиц H2S0, HS–, HSO4–, SO42–.
Сначала исследуем равновесие между частицами с одинаковой степенью окисления. В этом случае формы нахождения зависят только от рН раствора, поэтому схема расчета аналогична той, что мы использовали в задаче 6.1 Запишем реакцию диссоциации первой частицы:
H2S0 = H+ HS–
µ0: –27321,5 0 + 12593,6.
∆G°298 = 40275,1 Дж/моль
2,303 × RT = 5709 Дж. lgK = –7,5
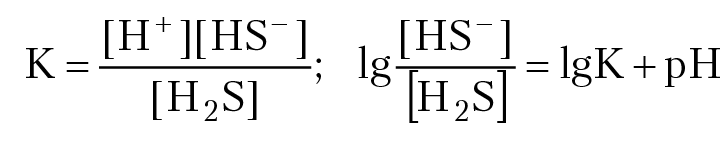
[HS–] = [H2S0], если lgК + pH = 0; рН = 7,5
HS– = H+ S2–
µ0 : +12593,6 0 + 91880,6.
∆G°298 = 72287 (Дж/моль)
lgK = –13,91
[S2–] = [HS–], если рН = 13,91
Аналогично находим области существования компонентов шестивалентной серы. [SO42–] = [HSO4–], если рН = 1,99.
Теперь рассмотрим формы нахождения серы с учетом окислительно-восстановительного потенциала раствора. Данное рассмотрение надо провести для четырех областей изменения рН раствора: 1) 0 ≤ pH < 1,99; 2) 1,99 ≤ pH < 7,05; 3) 7,05 ≤ pH < 13,91; 4) рН ≥ ≥ 13,91.
1. В очень кислой области, при рН < 1,99 преобладающими формами нахождения серы в растворе являются частицы HSO4– и H2S0 (рис. 11.3).
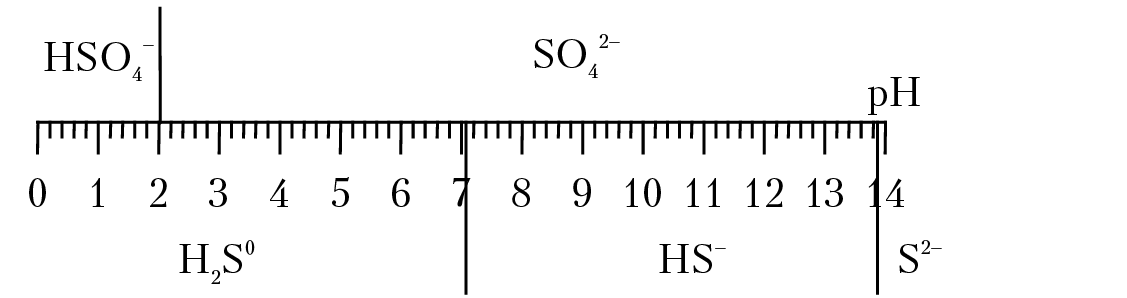
Рис. 11.3. Формы нахождения серы в растворе
Равновесие между этими частицами можно описать с помощью полуреакции:
1) HSO4– + 8e + 9H+ = H2S0 + 4 H2О
При равновесии окислительно-восстановительный потенциал раствора вычисляем с помощью уравнения Нернста:
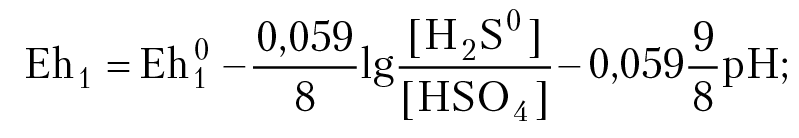
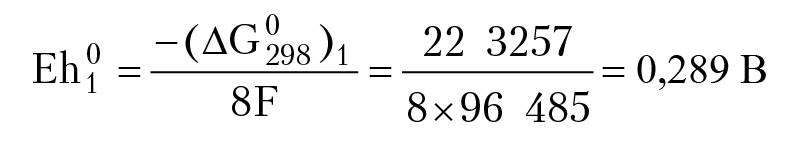
Равным концентрациям [H2S0] = [HSO4–] отвечают точки, лежащие на прямой: Eh1 = 0,289 – 0,059 × (9/8) pH;
Eh1 = 0,289 – 0,064 pH.
2. В области 1,99 < pH < 7,05 преобладающими формами нахождения серы в растворе являются частицы SO42– и H2S0. Равновесие между этими частицами можно описать с помощью полуреакции:
2) SO42– + 8e + 10 H+ = H2S0 + 4 H2O
Равным концентрациям [SO42–] = [H2S0] соответствуют точки, лежащие на прямой Eh2 = 0,31 – 0,074.
3. В области 7,05 < pH < 13,91 преобладающими формами нахождения серы в растворе являются частицы SO42– и HS– (см. рис. 11.4). Равновесие между этими частицами можно описать с помощью полуреакции:
3) SO42–+ 8e +9H+ = HS–+ 4 H2O
Равным концентрациям частиц SO42– и HS–соответствуют точки, лежащие на прямой: Eh3 = 0,24 — 0,064 pH.
4. В области pH ≥ 13,91 преобладающими формами нахождения серы в растворе являются частицы SO42– и S2–. Равновесие между этими частицами можно описать с помощью полуреакции:
4) SO42–+ 8e +8H+ = S2–+ 4H2O
Равным концентрациям частиц SO42–и S2–соответствуют точки, лежащие на прямой: Eh4 = 0,169 – 0,059 pH.
Результаты расчетов удобно представить в виде Eh–pH диаграммы серы (рис. 11.4).

Рис. 11.4. Eh-pH диаграмма серы
На диаграмме вертикальные линии разграничивают области преобладания серы в растворе с одинаковой степенью окисления, наклонные линии разграничивают области преобладания серы с разной степенью окисления. Для построения Eh-pH диаграммы в уравнение Eh1 = 0,289 — 0,064 подставляем значения рН1 = 0 и рН2 = 1,99 и вычисляем значения Eh1(1) = 0,289(B) и Eh1(2) = 0,162(B). Повторяем эту процедуру, используя уравнение Eh2 = 0,31 –0,074 и подставляя значение рН = 7,05: Eh2(7,05) = –0,212(B). Аналогично вычисляем Eh3(13,91) = –0,65 (B) и Eh4(14) = –0,66(B). Вычисленные координаты точек наносим на диаграмму и соединяем прямыми линиями (см. рис. 11.4).
Теперь необходимо разметить диаграмму, т. е. указать области преобладания соответствующих частиц. В этом случае опять полезно воспользоваться принципом Ле-Шателье: при возрастании окислительно-восстановительного потенциала раствора, равновесие окислительно восстановительной реакции смещается влево, т. е. возрастает концентрация частицы с большей степенью окисления. Поэтому над линией записывается символ частицы с большей степенью окисления, подсимвол частицы, с меньшей степенью окисления.
Как читать диаграмму на рис. 11.4?
Если параметры раствора Eh = –0,2 B и рН = 4, то преобладающей формой нахождения серы в этом растворе будет частица H2S0. При Eh = 0,1 В и рН = 8 преобладающей формой нахождения серы в растворе будет ион SO42– и т. д.
Сделаем некоторые замечания о системе обозначений, которая используется в литературе по электрохимии. В литературе по геохимии для обозначения ОВ потенциалов растворов, ОВ потенциалов реакций, полуреакций, электродных реакций используется обозначение Eh. В литературе по химии для обозначения ОВ потенциалов используется символ E, в физике потенциалы обозначаются буквой φ. В лекциях мы будем использовать символ Eh для обозначения ОВ потенциалов, измеренных относительно стандартного водородного электрода. [Eh] = вольт; мВ = 10–3B. В справочниках значения электродных потенциалов записаны для ОВ реакций, ОВ полуреакций или электродных реакций, которые протекают в сторону восстановления компонентов реакции. Например, стандартный ОВ потенциал полуреакции Zn2+ 2e = Zn, Eh0 = –0,76 B. В американской литературе по электрохимии принята обратная система знаков.
11.7. Определение направления окислительно-восстановительной реакции с использованием табличных данных по окислительно-восстановительным потенциалам полуреакций
На основании второго закона термодинамики мы сформулировали критерий направленности реакции: реакция будет протекать в направлении уменьшения изобарного потенциала реакции. Этот критерий направленности работает и при анализе направления ОВ реакций. Но для ОВ реакций можно сформулировать критерий направленности реакции в терминах электрохимии. Необходимо отметить, что мы не формулируем новый критерий направленности реакций: всю термодинамику ОВ реакций мы создаем на основании второго закона термодинамики. Разберем решение задачи о направлении ОВ реакции на конкретном примере.
Задача 11.2. Определить направление ОВ реакции: Zn + PbCl2 ↔ ZnCl2 + Pb, если стандартные ОВ потенциалы соответствующих ОВ полуреакций равны: Eh01(Zn2+/Zn) = –0,763 B, Eh02(Pb2+/Pb) = –0,126 B. Запись Eh01(Zn2+/Zn) надо понимать следующим образом: ОВ потенциал Eh01 полуреакции Zn2+ 2e = Zn равен –0,763В. Так как стандартный ОВ потенциал пары (Pb2+/Pb) больше, чем для цинка, значит свинец по отношению к цинку будет выступать как окислитель;
Pb2+ 2e = Pb Eh = –0,126 B
Zn2+ 2e = Zn Eh = –0,763 B
Свинец восстанавливается, цинк окисляется: ОВ реакция должна протекать в прямом направлении.
11.8. Окислительно-восстановительные реакции металлов при их взаимодействии с кислотами. Ряд напряжений металлов
При взаимодействии металлов с кислотами, металлы выступают как восстановители: Мe — ne = Men+. Окисляют металлы продукты диссоциации кислот. Например, при окислении металлов серной кислотой H2SO4 = 2H+ SO42– окислителем может выступать: 1) ион водорода Н+: 2Н+ 2е = Н2, Eh = –0,059pH; 2) ион SO42–; в зависимости от продуктов восстановления иона SO42– реакцию восстановления иона можно записать в виде полуреакций:
SO42– + 2e + 4H+ = SO2 + 2H2O; Eh0 = 0,161 B;
SO42– + 6e + 8H+ = S + 4H2O ; Eh0 = 0,354 B;
SO42– + 8e + 10 H+ = H2S + 4H2O; Eh0 = 0,309 B.
Справа от уравнений полуреакций приведены значения стандартных окислительно-восстановительных (ОВ) потенциалов полуреакций. Большими окис.-восст. способностями обладает азотная кислота:
2H+ 2e = H2; Eh = –0,059pH;
NO3– + e + 2H+ = NO2 + H2O; Eh0 = 0,81B;
NO3– + 3e + 4H+ = NO + 2H2O; Eh0 = 0,95B;
NO3– + 8e + 10H+ = NH4+ 3H2O; Eh0 = 0,88B;
2NO3– + 10e + 12H+ = N2 + 6H2O; Eh0 = 1,244B.
Совершенно очевидно, что вероятность протекания ОВ реакции металлов с кислотами зависит как от природы металла и кислоты, так и от концентрации кислоты. Детальный механизм каждой конкретной реакции металла с кислотой имеет свои особенности. Поэтому мы попытаемся сформулировать только общий подход к анализу ОВ реакций металлов с кислотой в рамках физико-химической модели процесса. Рассмотрим первый случай, когда со стороны кислоты окислителем выступает ион водорода: 2Н+ + 2е = Н2. ОВ потенциал данной полуреакции зависит от концентрации ионов водорода и равен Eh1 = Eh10 – 0,059/2 lgP(H2) – 0,059pH; Eh10 = 0, вторым слагаемым в уравнении Нернста можно пренебречь в силу малости давления водорода над раствором, следовательно, Eh1 = –0,059pH. ОВ потенциал полуреакции восстановления металла Men+ + ne = Me Eh2 = Eh20 + (0,059/n)lg [Men+].
Для того, чтобы имело место окисление металла кислотой, необходимо, чтобы выполнялось неравенство: Eh1 > Eh2:
–0,059pH > Eh20 + (0,059/n)lg[Men+]
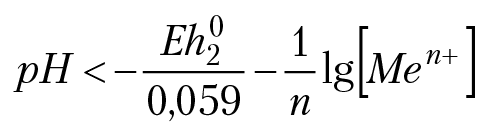
В данном неравенстве Eh02 — стандартный электродный потенциал металла, [Men+] — моляльная концентрация металла в растворе. Например, растворение цинка в кислоте будет иметь место, если
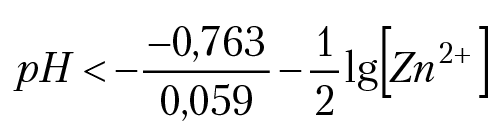
pH < 12,93 – 0,5lg[Zn2+]. Для оценки растворимости металла в кислоте можно пренебречь вторым слагаемым в неравенстве и работать с выражением: pH < 17(–Eh20). Для никеля (Eh20 = –0,25B) рН < 4,25. Окисление никеля возможно только в концентрированной кислоте. Растворение меди: (Eh20 = 0,34B), pH < 0, т. е. окисление меди ионом водорода невозможно. Но, как было указано выше, концентрированная серная кислота в качестве окислителя может использовать ион SO42–, например, по реакции:
SO42– + 6e + 8H+ = Sкр + 4H2O, Eh10 = 0,36 B
Cu2+ 2е = Cu, Eh20 = 0,34 B
В этом случае окисление меди возможно в результате реакции:
3Сu + SO42– + 8H+ = 3Сu2+ Sкр + 4 H2O
Раствор, в котором возможно растворение меди, должен иметь pH < 17 × 6/8 × (Eh01 – Eh02); pH < 0,25. Окисление меди возможно только в сильно концентрированной серной кислоте. Вернемся к анализу процесса окисления металла ионом водорода. Мы получили, что при [Men+] ≤ 1(моль/кг), окисление металла возможно при рН < 17 × (–Eh0), где Eh0 [B] — стандарный электродный потенциал металла. Следовательно, для всех металлов, для которых рН < 17 × (–Eh0), возможно окисление металла ионом водорода и вероятность протекания реакции тем больше, чем выше значение Eh0. Этот факт лежит в основе так называемого ряда напряжений металлов: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,¦H¦, Bi, Sb, Cu, Hg, Ag, Pd, Pt, Au. Для всех металлов слева от водорода возможно выполнение неравенства рН < 17 × (–Eh0), следовательно они могут быть окислены ионом водорода. Для металлов от висмута Bi до золота Au — окисление металла ионом водорода невозможно.
11.9. Окисление металлов кислородом, растворенным в воде
При растворении кислорода в воде в присутствии восстановителя возможно протекание реакции: О2 + 4е + 4Н+ = 2Н2О. ОВ потенциал раствора, в котором имеет место равновесие кислорода с раствором, можно вычислить по уравнению Нернста: Eh = Eh0 + 0,059/4lg[P(О2)] – 0,059pH.
Eh0 = 1,228 B. Так как предельное давление кислорода на поверхности Земли не может превысить 1 бар, получим: Eh < 1,288 — 0,059pH. В качестве восстановителя кислорода могут выступать металлы при их взаимодействии с кислородом:
Men+ ne = Me |4 Eh1 = Eh01 + 0,059/n × lg[Men+]
– O2 + 4e + 4H+ = 2H2O |n Eh2 = 1,228 + 0,059/4 × lgP(O2) – 0,059pH
___________________________________________________
4Me + nO2 + 4nH+ = 4Men+ 2n × H2O.
Считаем, что предельная концентрация металла в растворе [Men+] < 1 (моль/кг), Р(О2) < 1 бар. Растворенный в воде кислород будет способен окислить металл, если Eh2 > Eh1; 1,288 – 059pH > Eh01. E01 < 1,288 — 0,059pH, или pH < 16,9 × (1,288 – Eh01). Рассмотрим два примера расчета коррозии металлов кислородом.
Задача 11.3. Рассчитать рН раствора, в котором возможно окисление железа кислородом с образованием ионов Fe2+.
Решение: F2+ 2e = Fe; Eh1 = – 0,47 B.
O2 + 4e + 4H+ = 2H2O; Eh2 = 1,288 – 0,059pH
Окисление железа до иона Fe2+ будет иметь место, если рН < 16,9 × (1,288 + 0,47) ≈ 30. Можно считать, что окисление железа кислородом возможно в любом растворе. Усложним задачу. Пусть в продуктах окисления железа присутствует частица Fe(OH)20.
Задача 11.4. Рассчитать рН раствора, в котором возможно окисление железа кислородом с образованием Fe(ОН)20.
Решение: Fe(OH)02 + 2e +2H+ = Fe + 2 H2O;
Eh1 = – 1,15 – 0,059pH;
O2 + 4e + 4H+ = 2H2O; Eh2 = 1,288 – 0,059pH.
Окисление железа возможно, если Eh2 > Eh1. Данное неравенство выполняется при любом значении рН раствора. Если моляльная концентрация Fe(OH)20 превысит 1,2 (моль/кг), в осадок выпадает гидроокись железа Fe(OH)2, ржавчина. Окисление металлов кислородом лежит в основе атмосферной коррозии металлов. Необходимо отметить, что на поверхности металлов возможно образование пленки из оксида данного металла. Присутствие таких пленок и их структура сильно влияют на скорость коррозии металлов; в ряде случаев эти пленки обладают защитным действием. На воздухе такие пленки образуются на поверхности хрома, никеля, алюминия, цинка.
11.10. Термодинамика гальванического элемента
Гальванический элемент (ГЭ) — это источник энергии, которая нарабатывается за счет протекания окислительно-восстановительных реакций в элементе. Энергия ГЭ расходуется на поддержание электрического тока в замкнутой цепи. Так как принцип работы всех ГЭ одинаковый, разберем работу ГЭ на примере классического элемента Даниэля—Якоби.
Устройство элемента. Элемент состоит из двух сообщающихся сосудов. В одном из них находится раствор сульфата цинка ZnSO4, в который опущена цинковая пластинка (цинковый электрод), во втором сосуде находится раствор сульфата меди CuSO4, в который опущена медная пластинка (медный электрод). Растворы разделяются пористой перегородкой f, которая препятствует перемешиванию растворов, но проницаемая для перемещения ионов. ГЭ готов к работе (рис. 11.5).

Рис. 11.5. Схема гальванического элемента Даниэля—Якоби
Принцип работы ГЭ. В растворе сульфата цинка цинковая пластинка может растворяться, а может протекать и процесс восстановления ионов цинка до элемента:
1) Zn – 2e = Zn2+ растворение цинковой пластинки (окисление цинка);
2) Zn2+ 2e = Zn восстановление ионов цинка.
Легко показать, что при любой допустимой концентрации ионов цинка, изобарный потенциал первой полуреакции отрицательный, ∆G0r1 = µ0(Zn2+) + RTlg[Zn2+] = –147 050 + RTlg[Zn2+], второй полуреакции — положительный, т. е. самопроизвольно может протекать только процесс растворения цинка. Теряя положительно заряженные частицы (ионы Zn2+), на цинковой пластинке начнет накапливаться отрицательный заряд. Процесс быстро закончится, так как электрическое поле отрицательно заряженной пластинки будет препятствовать выходу в раствор ионов цинка. Потенциал пластинки вычисляем по уравнению Нернста:
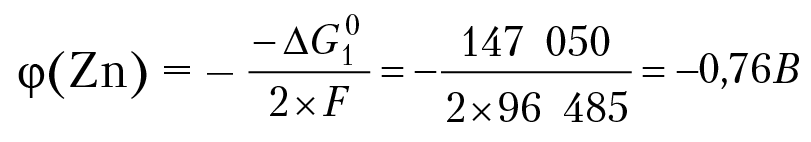
Аналогичным образом можно показать, что на медном электроде будет протекать процесс восстановления ионов меди с образованием меди: Cu2+ 2e = Cu, и на медной пластине возникнет положительный потенциал: φ (Cu) = +0,34 В.
Принцип работы гальванического элемента. Гальванический элемент должен обеспечивать перемещение электрических зарядов по замкнутой цепи: по внешнему контуру BPD перемещаются электроны, от d к b ионы электролита. На поддержание напряжения между электродами U = ∆φ = φ+ – φ– = 0,34 – (–0,76) = 1,1 В затрачивается энергия, которая выделяется в результате протекания ОВ реакции: Zn + Cu2+ = Zn2+ Cu. Максимальная работа ГЭ по перемещению одного моля электрического заряда A = –(∆G0298) = –[µ(Zn2+) — µ (Cu2+)] = + 212 260 (Дж/моль), электродвижущая сила ГЭ, ЭДС = А/q = –∆G/(nF) = 212 260/(2 × 96 485) = 1,1 B. Таким образом, в процессе работы гальванического элемента от цинковой пластины отбираются электроны (цинк окисляется) и этими электронами восстанавливаются ионы меди из раствора до металлической меди, которая осаждается на электроде. К сожалению, данная конструкция ГЭ не позволяет потреблять заметную мощность от ГЭ, так как происходит поляризация электродов: вокруг электродов возникает большая плотность электрического заряда: цинковый электрод окружается ионами меди, медный электрод — сульфатными ионами SO42–. Такие «шубы» вокруг электродов препятствуют движению электрических зарядов, возникает большое электрическое сопротивление. В промышленных ГЭ предпринимают специальные меры против поляризации электродов, но к концу работы ГЭ защитные оболочки разрушаются и ГЭ прекращает свою работу, несмотря на то, что запаса энергии в нем еще достаточно много. Рассмотренная схема ГЭ позволяет сформулировать достаточно простой алгоритм оценки ЭДС элемента. Действительно, ЭДС = ∆φ = Е02 — Е01, где Е0i — нормальный электродный потенциал i-го электрода (табличные значения). В таблице 11.1 приведены значения нормальных электродных потенциалов окисления металлов в воде и растворе аммиака. Если составить ГЭ из [Ti2+/Ti] и [Ag+/Ag] в воде ЭДС = 0,799 – (–1,628) = 2,427 В.
Таблица 11.1. Стандартные электродные потенциалы
|
Электрод |
Е0(Н2О) |
Е0(NH3) |
|
Электрод |
Е0(Н2О) |
Е0(NH3) |
|
Cs+/Cs |
–2,923 |
–2,951 |
|
Ti2+/Ti |
–1,628 |
|
|
Zn2+/Zn |
–0,763 |
–1,532 |
|
Cd2+/Cd |
–0,403 |
–1,201 |
|
Co2+/Co |
–0,277 |
|
|
Ni2+/Ni |
–0,250 |
|
|
Cu2+/Cu |
+0,337 |
|
|
Ag+/Ag |
+0,799 |
–0,182 |
|
Pt2+/Pt |
+1,200 |
|
|
Au+/Au |
+1,691 |
–0,187 |

