7.1. Учет электростатического взаимодействия ионов в растворе
7.2. Методы расчета коэффициента активности электролита
7.3. Термодинамическая и концентрационная константы равновесия реакции
7.4. Методы прямого учета электростатического взаимодействия ионов при расчете изобарного потенциала
7.1. Учет электростатического взаимодействия ионов в растворе
В теории разбавленных растворов предполагается, что частицы растворенного вещества взаимодействуют только с молекулами растворителя. При повышении концентрации раствора необходимо принимать во внимание взаимодействие частиц в растворе между собой. Это может быть сделано разными способами. Мы воспользуемся результатами работы Льюиса. Для описания термодинамических свойств реальных растворов Льюис ввел понятие термодинамическая активность компонента раствора или просто активность. По определению, активность компонента раствора а = γm; m [моль/кг] — моляльная концентрация компонента, γ — коэффициент активности. С помощью понятия активность компонента раствора можно применять к реальному раствору термодинамические соотношения, относящиеся к разбавленному раствору, если заменить в них концентрации активностями. Отклонение коэффициента активности γ от единицы указывает на степень отклонения свойств раствора от поведения разбавленного раствора. В данной модели реального раствора взаимодействие частиц друг с другом учитывается умножением концентрации компонента на коэффициент активности компонента. Естественно, изменяется и термодинамические характеристики компонента реального раствора: выражение для химического потенциала компонента реального раствора будет иметь вид: µ = µ° + RTln[a]. Так как а = γm, µ = µ° + RTln(γ[m]) = RTln[m] + RTln(γ). Слагаемое RTln(γ) учитывает взаимодействие компонентов раствора с данным компонентом. Очевидно, что для того, чтобы построить термодинамику реальных растворов, надо уметь вычислять коэффициенты активности. В теории электролитов предложены различные способы вычисления коэффициента активности, а значит и химического потенциала компонента раствора (формулы Дебая—Хюккеля, Питцера и т. д.). В случае неэлектролитов, коэффициенты активности определяются экспериментально.
Растворы электролитов. Растворы, хорошо проводящие электрический ток, называют электролитами. Вещества, при растворении которых получаются электролиты, так же называют электролитами. Электролиты получаются при растворении в воде веществ с ионной кристаллической решеткой (например, солей NaСl, KСl) или веществ с полярной ковалентной связью, например HСl(газ), HBr(газ). Растворение этих веществ сопровождается диссоциацией с образованием ионов в растворе. В растворе ионы связываются с молекулами воды с образованием гидратной оболочки. Образование электролитов за счет диссоциации вещества в воде лежит в основе теории электролитической диссоциации шведского ученого С. Аррениуса (1900). Аррениус ввел понятие степени диссоциации: отношение числа молекул электролита, распавшихся на ионы к общему числу его молекул в растворе. Если обозначить концентрацию электролита через m (моль/кг), степень его диссоциации в растворе через α, то концентрация каждого из ионов будет равна mα, концентрация недиссоциированных молекул будет равна m(1–a). Уравнение для константы диссоциации реакции АВ = А+ + В– будет иметь вид:
Отметим, что константу диссоциации электролита мы можем вычислить по уравнению Вант-Гоффа: RTlnK = –∆G°298, а значит, и степень диссоциации электролита.
7.2. Методы расчета коэффициента активности электролита
Одним из основных понятий термодинамики является химический потенциал компонента раствора. В теории разбавленных растворов для вычисления химического потенциала мы имеем уравнение: µi = µ0i + RTln[mi]. С учетом межмолекулярного взаимодействия компонентов раствора, согласно представлениям Льюиса, мы должны записать для химического потенциала выражение: µi = µ0i + RTln(miγi), где miγi = ai активность компонента раствора. Для электролитов, Дебай и Хюккель предложили формулу для расчетов коэффициентов активности γi:
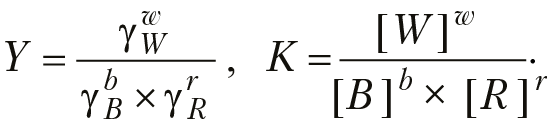
где A и B — параметры, зависящие от свойств растворителя и температуры. Для стандартных условий и воды, A = 0,5091[кг1/2моль–1/2], B = 0,3283 × 108 [кг1/2моль–1/2см–1]. I = 0,5ΣmiZ2i — ионная сила раствора. ri в теории Дебая — Хюккеля определено как «среднее расстояние сближения ионов». Точное физическое определение этой величины затруднено, поэтому параметр ri рассматривается как некоторая эмпирическая константа, которая зависит от размеров иона. Величина параметра ri близка к размерам ионов в кристаллических решетках, таблица 7.1. Среднее значение ri = 0,45 × 10–8 см может быть использовано для растворов с ионной силой I < 0,05. Приведенное уравнение Дебая—Хюккеля считается пригодным для расчетов коэффициентов активности ионов в растворах с ионной силой I < 0,25. Дальнейшее усовершенствование теории (для приложения ее к более концентрированным растворам) пошло по пути учета поляризуемости молекул воды ионами растворенного вещества. Это потребовало введения полуэмпирических параметров, что идет в ущерб цельности теории. Для увеличения интервала концентраций, охватываемого электростатической теорией Дебая—Хюккеля, добавляют эмпирические члены степенного ряда:
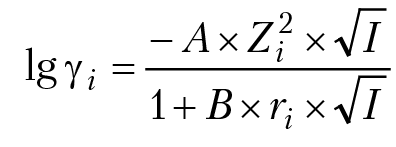
+ CI, где для С рекомендуется значение 0,1 ≈ 0,2.
Таблица 7.1. Ионные радиусы компонентов (ri × 108 [см])
|
Ионы |
ri |
|
Rb+, Cs+, NH4+, Ag+, Tl+ |
0,25 |
|
K+, Cl–, Br–, I–, NO3– |
0,30 |
|
OH–, F–, HS–, BrO3–, MnO4– |
0,35 |
|
Na+, HCO3–, H2PO4–, HSO4–, SO42–, SeO42–, CrO42–, PO43– |
0,43 |
|
Pb2+, CO32–, SO32– |
0,45 |
|
Sr2+, Ba2+, Ra2+, Cd2+, Hg2+, S2–, WO42– |
0,51 |
|
Li+, Ca2+, Cu2+, Zn2+, Sn2+, Mn2+, Fe2+, Ni2+, Co2+, Mg2+, Be2+ |
0,81 |
|
H+, Al3+, Cr3+ |
0,90 |
|
Th4+, Zr4+, Ce4+, Sn4+ |
1,10 |
7.3. Термодинамическая и концентрационная константы равновесия реакции
В реальных растворах энергия взаимодействия между компонентами раствора сравнима, а иногда и превышает энергию взаимодействия частиц с растворителем. По этой причине, только часть растворенных частиц способна участвовать в химических реакциях. Концентрации этих активных частиц называют активностями компонентов раствора и обозначают а (моль/кг). Если реакция протекает в реальном растворе, bB + rR = wW, то связь между активностями компонентов реакции и концентрациями задаются уравнениями: aB = γB × [B], aR = γR × [R], aW = γW × [W]. [B], [R], W — моляльные концентрации компонентов реакции, γi — коэффициенты активности соответствующих компонентов. Для химического потенциала компонента раствора имеем µ = µ° + RTlna. Для компонента реального газофазного раствора используется понятие летучести (или фугитивности f [бар] ) газа: µ= µ° + RTlnf. Если реакция протекает в реальном растворе, то константа равновесия реакции должна быть записана через активности компонентов реакции и в этом случае константа равновесия реакции называется термодинамической константой равновесия раствора:
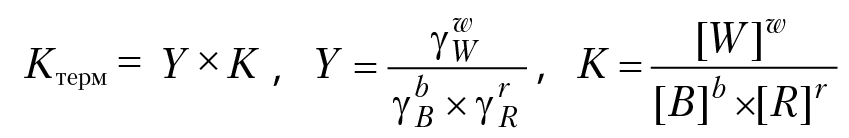
Полученные формулы устанавливают связь между термодинамической и концентрационной константами равновесия реакции. Например, для реакции: Fe2O3 + 3H2O = 2Fe3+ 6OH–; Y = (γFe)2 × (γOH)6. Активности твердой фазы Fe2O3 и воды приняты равными единице. Отметим, что если реакция протекает в реальном растворе, то уравнение Вант-Гоффа должно быть записано через термодинамическую константу равновесия: RTlnKтерм = –∆G(P, T). В этом случае расчет концентрационной константы равновесия необходимо делать с учетом электростатической поправки Y и уравнение Вант-Гоффа примет вид: RTlnK = –[∆G(P, T) + D0], где D0 вычисляем по формуле : D0 = RTlnY.
7.4. Методы прямого учета электростатического взаимодействия ионов при расчете изобарного потенциала
Мы разобрали метод учета взаимодействия между компонентами раствора с помощью понятия об активности компонентов раствора. В данном разделе мы разберем методы оценки взаимодействия компонентов в растворе путем прямого расчета энергии электростатического взаимодействия ионов в растворе. Данный подход к решению задачи позволяет связать константу диссоцииации комплекса (частицы типа NaOH0, FeOH+) с физико-химическими свойствами растворителя. Так как константа диссоциации вычисляется по уравнению Вант-Гоффа RTlnK = –∆G°298, то решение задачи будем искать в виде поправки к изобарному потенциалу реакции, связанную с учетом электростатического взаимодействия ионов:
.png) (7.1)
(7.1)
∆G(P, T) — потенциал Гиббса реакции диссоциации с учетом электростатического взаимодействия ионов, ∆G°R — изобарный потенциал реакции диссоциации, вычисленный в предположении, что реакция протекает в разбавленном растворе; а — сумма ионных радиусов частиц, продуктов диссоциации. Данные для расчета “а” приведены в таблице 7.2: е — заряд электрона, N — число Авагадро. εт,p — диэлектрическая проницаемость воды при соответствующем значении температуры и давления. На основании (10.1) в работе [7] Б. Н. Рыженко предложил формулу для расчета константы диссоциации электролитов, (7.2):
.png) (7.2)
(7.2)
pKst= –lgKst; lgKst = –∆G°298/2,3026 × R × 298,15; e2 × N/(2,3026 × R) = 72 600. Константа 72 600 получается, если сумму ионных радиусов a = rk + ra, (rk — ионный радиус катиона, ra — ионный радиус аниона), подставлять в уравнение для pK(Р,Т) в ангстремах: [a] = 10–8 см. Если а = 2,16 × 10–8 , подставлять в уравнение надо число 2,16. Число 0,0128 = 1/ε298 , ε298 — диэлектрическая проницаемость воды при температуре 298 °К. В данной модели учета электростатического взаимодействия ионов мы предполагаем, что имеет место диссоциация симметричного электролита с одним лигандом и рассматривается энергия электростатического взаимодействия j-иона в электрическом поле i-иона. В общем случае необходимо учитывать энергию взаимодействия между катионом и каждым лигандом, а так же энергию отталкивания каждой пары лигандов. При таком анализе электростатического взаимодействия энергия комплекса будет зависить от заряда катиона, числа лигандов и геометрической конфигурации комплекса.
Таблица 7.2. Кристаллохимические радиусы некоторых ионов [12]
|
ион |
ρ |
ион |
ρ |
ион |
ρ |
ион |
ρ |
|
F– Cl– Na+ K+ Mg2+ Ca2+ S2– |
1,33 1,81 0,98 1,33 0,78 1,06 1,74 |
Al3+ Fe2+ Fe3+ Cu+ Ag+ Au+ ClO4– |
0,57 0,83 0,67 0,96 1,13 1,37 2,36 |
Mn2+ Zn2+ OH– HS– NO3– CO3–2 HSO4– |
0,91 0,83 1,40 1,95 1,89 1,85 2,06 |
HCO3– SO4–2 WO4–2 PO4–3 SiO4–4 NH4+ MoO2– |
1,63 2,30 2,57 2,38 2,40 1,43 2,54 |
Геометрическая конфигурация комплекса должна быть такой, чтобы энергия комплекса была минимальной. Это означает, что для комплекса КА2 (К — катион, А2 — два аниона) это линейная структура, А–К–А, КА3 — равносторонний треугольник и т. д. Такое рассмотрение энергии электростатического взаимодействия приводит к поправке расчета Z = |Zi∗Zj|:
.png) (7.3)
(7.3)
где Q = (3 × L2–5 × L+2)/8,
L — число лигандов в комплексе,
zk , za — абсолютные значения зарядов катиона и аниона
ξ — поляризуемость аниона, таблица 7.3.
Подставляя в уравнение для рК вместо |Zi × Zj| значение Z, получим:
.png) (7.4)
(7.4)
Таблица 7.3. Поляризуемость ионов. ξ × 1024 [см3]
|
анион |
Cl– |
F– |
OH– |
CO32– |
NO3– |
SO42– |
Br– |
I– |
|
ξ |
3,59 |
4,09 |
2,04 |
4,81 |
4,37 |
5,83 |
5,02 |
7,62 |
|
катион |
H+ |
Na+ |
Mg2+ |
Ca2+ |
Cd2+ |
Ba2+ |
Fe2+ |
Al3+ |
|
ξ |
–0,21 |
0,08 |
–0,71 |
0,28 |
0,92 |
1,73 |
1,13 |
–1,01 |
Задача 7.1. Оценить константу диссоциации флюорита при Р = 500 бар и температуре 50 °С с учетом электростатического взаимодействия ионов в растворе и без учета изменения мольного объема раствора.
Решение: значение константы диссоциации CaF2 вычисляем по уравнению (10.4), ∆V = 0. pK°298 = 10,63 (см. задачу 6.3). Вычисляем a = rk + ra = (1,06 + 1,33) × 10–8 см = 2,39 × 10–8см. По уравнениям (10.3) вычисляем эффективный заряд:
Q = (3 × L – 5 × L+2)/8, L = 2 (в молекулу CaF2 два лиганда);
Z = 2 × 2 × 1 –0,5 × 1 + (4,09 × 4)/[2 × 2,39)2] = 4,932;
pK323, 500 = 0,9226 × 10,63 + (4,932/2,39) × 0,2762 = 10,38;
K (323 K, 500 бар) = 4,17 × 10–11;
L (325 K, 500 бар) = 17,04 (мг/кг).

