2.1. Теория химической связи и ее задачи
2.2. Ионная и ковалентная связь атомов в молекулах
2.3. Метод валентных связей. Теория Гейтлера и Лондона
2.5. Гибридизация атомных орбиталей
2.6. Основные идеи метода молекулярных орбиталей в приближении ЛКАО
2.7. Описание молекулы по методу МО ЛКАО
2.1. Теория химической связи и ее задачи
Проблема химической связи является центральной в современной химии. Выяснение физической природы сил, обеспечивающих устойчивость молекул, должно привести к объяснению различных особенностей этих сил и свойств молекул. Силы взаимодействия между частицами в природе сводятся к общеизвестным электромагнитным и гравитационным силам. С классической точки зрения химические силы так или иначе должны сводиться к силам электромагнитного взаимодействия между атомами, входящими в состав молекулы. Но химическая связь — это взаимодействие микрочастиц и здесь следует быть готовым к пересмотру классических понятий на природу химической связи. Первые же квантомеханические расчеты Гейтлера и Лондона в 1927 г. привели к понятию так называемой обменной энергии, обеспечивающей устойчивость молекул и не имеющей классического аналога. Но построение теории химической связи атомов в молекулах началось с полуклассических расчетов М. Борна, Г. Гейзенберга и В. Косселя в 1925 г. Их теоретическое рассмотрение природы химической связи в ионных соединениях типа NaСl, KСl, MgF2, СaF2, Al2O3 и т. д. и сегодня не потеряло научного интереса.
2.2. Ионная и ковалентная связь атомов в молекулах
Если взаимодействие двух нейтральных атомов сопровождается переносом электрона от одного атома к другому, то говорят, что связь в образовавшейся молекуле ионная. Такая связь между атомами в NaСl, KСl, СsI и т. д. В основе концепции ионной связи лежит идея о стремлении атомов образовывать ионы, с электронными оболочками, подобные оболочкам благородных газов. Атомы щелочных металлов (Li, Na, K, Rb, Сs) могут достигнуть этого, теряя электрон и образуя положительные ионы с оболочками, аналогичными электронным оболочкам Ne, Ar, Kr, Xe. Для того, чтобы иметь такие оболочки атомам F, Сl, Br и I надо присоединить электрон, т. е. образовать отрицательные ионы. Работа, которую необходимо затратить на полный отрыв электрона от атома или иона, называется потенциалом ионизации или энергией ионизации. Количество энергии, которое выделяется или поглощается при присоединении электрона к атому или иону называется сродством к электрону, Еср.
Таблица 2.1. Первые потенциалы ионизации атомов (в вольтах)
|
1 группа |
2 группа |
6 группа |
7 группа |
|
Li 5,3 |
Be 9,32 |
O 13,62 |
F 17,42 |
|
Na 5,14 |
Mg 7,65 |
S 10,36 |
Cl 12,97 |
|
K 4,34 |
Ca 6,11 |
Se 9,76 |
Br 11,84 |
|
Rb 4,18 |
Sr 5,00 |
Te 9,01 |
I 10,45 |
|
Cs 3,89 |
Ba 5,21 |
В пределах группы периодической таблицы Д.И. Менделеева потенциал ионизации {I} уменьшается (таблица 2.1), а сродство к электрону {Еср} растет (таблица 2.2). При встрече атома M с низким потенциалом ионизации (например, Na) с атомом Х с большой энергией сродства к электрону (например, Cl) может произойти переход электрона от атома М к Х с образованием молекулы по схеме: М + Х → М++ Х– → [М+Х–]. В данной схеме образования химической связи мы предполагаем, что один из атомов притягивает общую электронную пару, за счет которой происходит образование химической связи и при этом симметричное распределение зарядов нарушается, связь становится полярной. Степень полярности связи зависит от различия в электроотрицательности (Y) атомов, участвующих в образовании связи.
Электроотрицательностью элемента (по Малликену) называется полусумма первого потенциала ионизации и энергии электронного сродства: Y = 0,5 × (I + Еср).
В таблице 2.3 приведена относительная шкала электроотрицательности элементов по Полингу. За единицу отсчета выбрана электроотрицательность лития. Ионная химическая связь тем прочнее, чем больше разность электроотрицательностей (∆Y) участвующих в ней атомов. Для CsF и FrF ∆Y максимальна и равна 3,5, в KСl ∆Y = 2,2. Одно из характерных свойств ионных соединений — их способность образовывать к р и с т а л л ы. Анионы и катионы образуют кристаллические решетки — упорядоченное расположение ионов.
Таблица 2.2. Энергия сродства к электрону ( эВ)
|
Li +0,54 |
Be –0,60 |
B +0,20 |
C +1,25 |
N +0,00 |
O +2,20 |
F +3,63 |
Ne –0,25 |
|
Na +0,74 |
Mg –0,30 |
Al +0,61 |
Si +1,81 |
P +0,81 |
S +2,42 |
Cl +3,78 |
Ar –0,21 |
Таблица 2.3. Относительная электроотрицательность некоторых элементов (по Полингу)
|
H |
||||||
|
Li |
Be |
B |
C 2,5 |
N 3,0 |
O 3,5 |
F 4,0 |
|
Na |
Mg |
Al |
Si 1,8 |
P 2,1 |
S 2,5 |
Cl 3,0 |
Кристаллы хлорида натрия имеют правильную кубическую форму и там нет изолированных ионных пар типа Na+Cl– . Мы не останавливаемся на математическом аппарате расчета энергии ионной химической связи. Этот материал подробно изложен в книгах по квантовой химии. Отметим только, что в упрощенном изложении ионную связь можно трактовать как электростатическое взаимодействие ионов. Ионы рассматриваются как «твердые шары» с ионными радиусами r(M+) и r(X–) (табл. 2.4).
Таблица 2.4. Ионные радиусы (Е) некоторых элементов
|
Группы |
|||||
|
Периоды |
1а |
2а |
3а |
4а |
5а |
|
Группы |
|||||
|
Периоды |
1а |
2а |
3а |
4а |
5а |
|
2 |
Li |
Be |
B |
C |
N |
|
3 |
Na |
Mg |
Al |
Si |
P |
|
4 |
K |
Ca |
Ga |
Ge |
As |
|
5 |
Rb |
Sr |
In |
Sn |
Sb |
|
6 |
Cs |
Ba |
Tl |
Pb |
Bi |
Образование связи происходит за счет выигрыша энергии при образовании молекулы из двух атомов. Например, молекула NaCl может образоваться только в том случае, если ее энергия будет меньше энергии атомов Na и Cl, взятых порознь. Расчеты показывают, что для передачи электрона от Na к Сl требуется энергия Е1: E1 = I(Na) – Еср(Сl) = 5,4 – 3,8 = 1,6 эВ. Энергия электростатического притяжения ионов Na+ и Сl– E2 = 5,8 эВ. При образовании молекулы NaСl получим выигрыш в энергии ∆E = 5,8 – 1,6 = 4,2 эВ.
Рассмотренная теория удовлетворительно объясняет ионную связь, но бессильна при попытке истолковать химическую связь в случае молекулы, например, из одинаковых атомов (Н2 или О2). Это связано не с учетом кинетической энергии электронов, участвующих в образовании связи и играющей доминирующую роль в расчетах энергии химической связи. В квантомеханической теории строения молекул кинетическая энергия электронов учитывается автоматически, что приводит к понятию обменной энергии, играющей центральную роль в интерпретации квантомеханической теории связи атомов в молекулах.
2.3. Метод валентных связей. Теория Гейтлера и Лондона
При решении задачи о природе и характере химической связи атомов в молекуле, квантовая механика исходит из уравнения Шредингера, вид которого определяется степенью сложности молекулы. В случае молекулы водорода уравнение Шредингера записывают в виде:
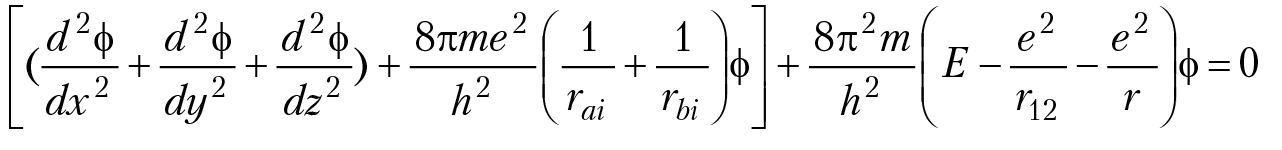
Выражение в квадратных скобках — это кинетическая энергия электронов в молекуле, в круглой скобке — потенциальная энергия взаимодействия электронов между собой и с ядрами; r12 — расстояние между электронами в молекуле водорода, r — расстояние между ядрами (протонами) в молекуле водорода. Расстояние между ядрами r рассматривается как фиксированный параметр (приближение Борна–Оппенгеймера); Е — энергия молекулы; φ — волновая функция, которая описывает поведение электронов в молекуле водорода; φ2dv — вероятность обнаружить оба электрона в элементе объема dv (рис. 2.1).
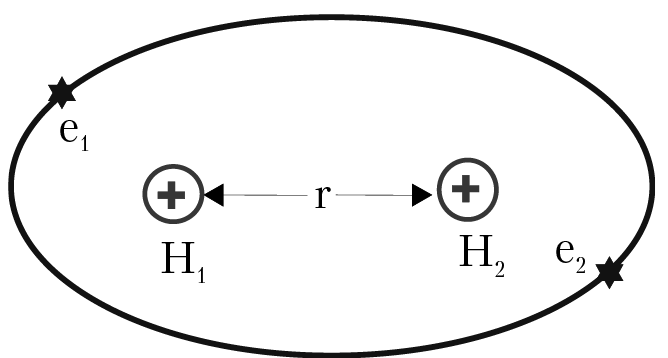
Рис. 2.1. Геометрия молекулы водорода
Так как точно решить уравнение Э. Шредингера для молекулы водорода невозможно, рассмотрим приближенный метод решения задачи о химической связи в молекуле водорода, который предложили немецкие физики Гейтлер и Лондон в 1927 г. В качестве нулевого приближения рассмотрим разъединенные атомы, т. е. электрон 1 при ядре a и электрон 2 при ядре b. Полная энергия системы равна сумме энергий двух изолированных атомов, т. е. 2Е0. Электроны в атомах водорода находятся в 1s-состоянии, поэтому волновые функции электрона имеют вид:
,
где ra — расстояние электрона 1 от ядра «а» и rb — расстояние электрона 2 от ядра «b»; |φa(1)|2 dV1 означает вероятность найти первый электрон, принадлежащий ядру a в элементе объема dV1 = dx1dy1dz1, |φb(2)|2 dV2 означает вероятность найти второй электрон, принадлежащий ядру b в элементе объема dV2 = dx2dy2dz2. На расстоянии, когда еще нет молекулы водорода, т. е мы имеем дело с изолированными атомами, вероятности эти независимы и вероятность одновременного нахождения первого электрона в элементе объема dV1, а второго — в элементе объема dV2 равна произведению φ2a(1)dV1 × × φ2b(2)dV2 = [φa(1) × φb(2)]2dV1dV2, откуда для молекулярной волновой функции нулевого приближения получаем выражение φ1 = φa(1)φb(2). При сближении атомов водорода, т. е. при образовании молекулы водорода, происходит делокализация электронов, возникает возможность перехода электрона от одного ядра к другому, электроны становятся неразличимы и могут обмениваться местами локализации. Наряду с состоянием 1 с волновой функцией φ1 = φa(1)φb(2) возникает состояние 2 с волновой функцией φ2 = φa(2)φb(1). Запись φa(2) означает волновую функцию электрона 2, локализованного около ядра «a». Более точному решению уравнения Э. Шредингера для молекулы водорода будет отвечать линейная комбинация волновых функций, которые описывают состояние 1 и состояние 2 системы:
φ = c1φ1 ± c2φ2 = c1φa(1)φb(2) ± c2φb(1)φa(2).
Решение уравнения Э. Шредингера с данной волновой функцией приводит к двум значениям энергии для молекулы водорода:
при этом c1 = c2 = с;
при этом с1 = –с2.
где Е0 — энергия изолированного атома водорода в основном состоянии;
С — кулоновский интеграл; его значение равно энергии электростатического взаимодействия электронов с ядрами, электронов и ядер между собой в молекуле водорода;
J — обменный интеграл; он не имеет классического аналога и поэтому допускает лишь приближенную трактовку, как энергия электронов, связанную с делокализацией электронов в молекуле, которая обусловлена движением электронов в пределах молекулы;
S12 = Sab резонансный интеграл, значение которого пропорционально степени делокализации электронов в молекуле:
S12 = ∫φa(1)φb(2)φb(1)φa(2)dV1dV2
Расчет показывает, что кулоновский и обменный интегралы отрицательны, причем обменный интеграл J значительно превосходит по абсолютной величине кулоновский интеграл. Это приводит к тому, что для молекулы водорода возможно состояние с энергией Е1, которая меньше суммы энергии разъединенных атомов 2Е0 (т. е. реализуется возможность образования стабильной молекулы из двух атомов) и возможно состояние с энергией Е2, которая больше 2Е0, т. е. возможно неустойчивое, возбужденное состояние молекулы. Устойчивому состоянию молекулы соответствует симметричная координатная волновая функция φ+ = с[φa(1)φb(2) + φb(1)φa(2)] с энергией Е1, возбужденному состоянию молекулы — антисимметричная координатная волновая функция φ– = с[φa(1)φb(2) — φb(1)φa(2)] с энергией Е2; симметрия волновой функции определяется по отношению к перестановки электронов: если при перестановке электронов знак волновой функции не меняется, значит функция симметричная, если изменяется на обратный — антисимметричная функция. Последующий теоретический анализ возникновения химической связи выявил огромную роль спина электронов, участвующих в образовании связи. Каждой химической связи должна соответствовать волновая функция в виде произведения двух волновых функций: пространственной φ(1,2) и спиновой σ(1,2); при записи спиновой функции электрона 1 с положительной проекцией спина используют обозначение α(1), с отрицательной β(1). Запись β(2) означает, что проекция спина электрона 2 — отрицательная. Минимальной энергии электронов в молекуле водорода (устойчивому состоянию молекулы водорода) соответствует произведение симметричной координатной волновой функции на антисимметричную спиновую функцию σ– = 1/√2[α(1)β(2) – α(2)β(1)], которая задает суммарный спин электронов в молекуле, равный нулю S = 0 (так как спины электронов направлены в разные стороны):
χ(1,2) = φ+ × σ–; энергия молекулы E1 < 2E0, спин S = 0.
χ* = φ– × σ+; энергия молекулы E2 > 2E0, спин S = 1.
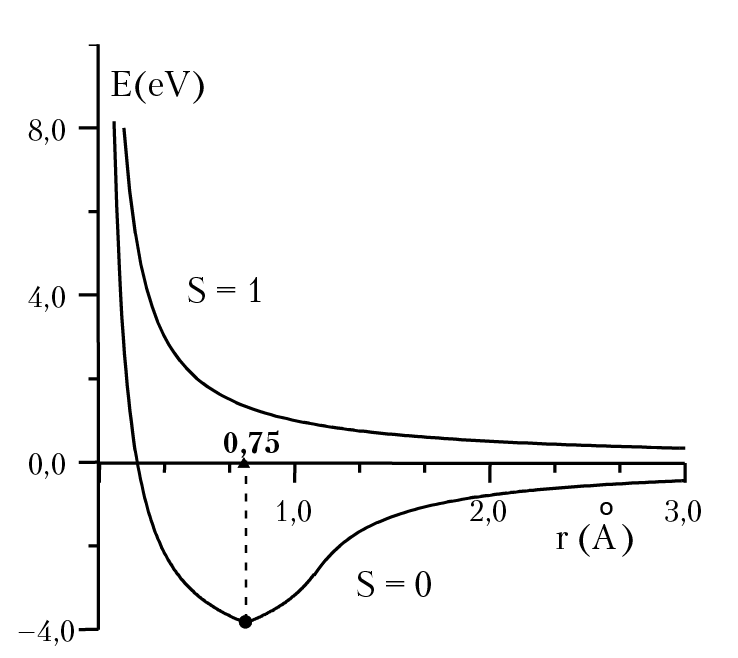
Рис. 2.2. Зависимость энергии молекулы водорода от расстояния между ядрами
Расчеты Гейтлера и Лондона дали количественное объяснение химической связи на основании положений квантовой механики. Он показал, что если электроны атомов водорода обладают противоположно направленными спинами, то при сближении атомов происходит значительное уменьшение энергии системы, возникает химическая связь. Именно наличие у электронов спина сделало возможным образование химической связи.
Возбужденному состоянию молекулы соответствует волновая функция, равная произведению антисимметричной координатной волновой функции на симметричную спиновую функцию σ+ = 1/√2[α(1)β(2) + α(2)β(1)], которая задает спин молекулы равный единице S = 1: электронов антипараллельных спинов делает возможным нахождение электронов около обеих ядер, что и трактуется как «обмен электронами». Движение электронов в пространстве между ядрами приводит к значительному увеличению электронной плотности в пространстве между ядрами, которое и «стягивает» положительно заряженные ядра. В системе с параллельными спинами электронов, плотность электронного облака между ядрами резко снижается — электроны выталкиваются из пространства между ядрами, и химическая связь не возникает. Волновые функции φ , которые получаются в результате решения уравнения Шредингера, называются молекулярными орбиталями. Путем вычисления амплитуды вероятности распределения электронов [φ(x, y, z)]2 можно показать, что в устойчивом состоянии молекулы водорода распределение электронной плотности соответствует концентрации электронов в пространстве между ядрами, в то время как в неустойчивом (возбужденном) состоянии электроны стремятся отойти от центра молекулы. Орбиталь, которая задает основную часть электронной плотности, сосредоточенной между ядрами (область связывания), называется связывающей молекулярной орбиталью. В нашем случае это орбиталь: φ+ = c[φa(1) × φb(2) + φb(1) × φa(2)]. Ей соответствует кривая потенциальной энергии типа «S=0» на рис. 2.2 (в расчете на одну молекулу). На кривой потенциальной энергии молекулы есть минимум, который соответствует максимально устойчивому состоянию молекулы. Положение минимума потенциальной энергии взаимодействия электронов в молекуле определяет оптимальное расстояние между ядрами молекулы (rmin = 0,75 Å). Если молекулярная орбиталь задает максимум электронной плотности, сосредоточенной за пределами между ядрами (область разрыхления), то орбиталь называется разрыхляющей и ей соответствует орбиталь со знаком [–] и кривая потенциальной энергии типа «S=1» (см. рис. 2.2), на которой отсутствует минимум энергии атомов в составе молекулы, Это означает, что ни при каком расстоянии между ядрами молекула не может находиться в устойчивом состоянии, если спины электронов параллельны (см. рис. 2.2). Отметим, что мы рассмотрели метод описания химической связи, в основе которого лежат представления о химической связи, которая образуется между двумя атомами за счет пары электронов с противоположными спинами, локализованными между атомами. Представление о локализованной паре электронов подтверждает идею Льюиса о химической связи как о паре электронов, общей двум атомам и лежит в основе понятия валентности атома. В случае образования молекулы из трех и более атомов, в данном методе принимаются во внимание только парное взаимодействие атомов: <A|B>, <A|C>, <B|C> в случае атомов А, В, С. Рассчитанные по этой схеме молекулярные орбитали и соответствующие им уровни энергии называются связывающие и разрыхляющие соответственно. К сожалению, метод локализованных пар оказался неудобным для описания сопряженных связей в органических молекулах и дальнейшее развитие теории химической связи пошло по пути частичного отказа от рассмотрения молекулы как совокупности атомов, сохраняющих некоторую индивидуальность. В методе молекулярных орбиталей молекула рассматривается как единое целое, каждый электрон движется в поле всех ядер молекулы.
По виду перекрывания атомных волновых функций электронов молекулярные связи бывают σ-, π- и т. д. типов. Если связь обеспечивается перекрыванием волновых функций электронов, симметричных относительно оси, соединяющей ядра, связь называется σ-связью. Если при образовании связи перекрывание электронных волновых функций будет симметрично относительно плоскости, проходящей через ось, соединяющей атомы (например, ось Z) и перпендикулярной плоскости XY , то в этом случае говорят о π-связи. Примеры перекрывания орбиталей двух атомов с образованием σ- и π-связи приведены на рис. 2.3. Как правило, энергия σ-связи больше энергии π-связи.
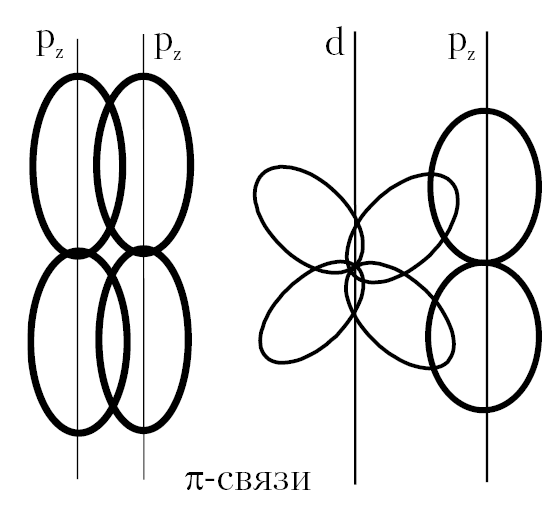
Рис. 2.3. Перекрывание АО при образовании химической связи
2.5. Гибридизация атомных орбиталей
Чем полнее в пространстве перекрываются друг с другом две атомные орбитали, участвующие в химической связи, тем прочнее связь. Иногда связь между атомами оказывается прочнее, чем это следует из расчета. Исправить положение оказалось возможным, если предположить, что в момент образования химической связи атомная орбитали принимает «форму», позволяющую ей более полно перекрываться с орбиталью соседнего атома. Изменить свою «форму» атомная орбиталь может, лишь комбинируясь с другими атомными орбиталями иной симметрии этого же атома. С математической точки зрения это означает, что в уравнение Шредингера надо подставлять не «чистые» АО, а их некоторую линейную комбинацию. Подбор линейной комбинации АО, обеспечивающей максимальное перекрывание атомных волновых функций и обеспечивающих более точное решение уравнения Шредингера, называется гибридизацией атомных орбиталей. Гибридизация осуществляется при возбуждении атома, т. е. требует затрат энергии, которые должны окупиться при образовании химической связи с другим атомом. Таким образом, первое условие необходимости гибридизации можно сформулировать следующим образом: по сравнению с исходными АО гибридная АО должна обеспечивать более полное перекрывание с АО соседнего атома. Второе: в образовании химической связи должны участвовать не спаренные электроны, т. е. внешние электроны, суммарный спин которых не равен нулю (валентные электроны). Гибридное состояние АО энергетически, естественно, менее выгодно, чем нормальное. На гибридизацию АО, например, атома углерода требуется затрата энергии ≈ 270 кДж/моль, что, однако, компенсируется тем, что образующиеся связи оказываются более прочными вследствие повышенной электронной плотности в направлении связей между атомами. Использование понятия гибридизации атомных орбиталей оказалось плодотворным и с точки зрения предсказания геометрии молекулы, т. е. расположения атомов в пространстве. Рассмотрим эти положения на конкретных примерах.
sp-гибридизация. Подобный тип гибридизации возникает при образовании атомом двух связей за счет электронов, находящихся в s- и р-состояниях (или с использованием s- и р-состояний электронов).
Пример. Атом бериллия Ве имеет электронную конфигурацию 1s22s2 (два внешних, спаренных электрона на 2s АО). Из данного электронного состояния атом бериллия не сможет образовать две химические связи, так как отсутствуют неспаренные электроны. Необходимо сообщить дополнительную энергию атому Ве, чтобы перевести его внешние электроны в валентное состояние 1s22s12p1. Используя 2s и 2р атомные орбитали теперь можно сконструировать две sp-гибридные АО с волновыми функциями:
φ± = 1/2 × [f(s) ± f(p)]
Получающиеся гибридные sp-орбитали располагаются на одной прямой, образуя угол в 180°. Направленностью двух АО объясняют угол между атомами в СО2, MgCl2 .
sp2-гибридизация. Используя s- и две р-орбитали атома можно получить три гибридные АО, причем вклад в перекрывание атомных орбиталей s-орбитали будет равен 1/3, а р-орбиталей — 2/3. Если в гибридизации участвуют s, px и py АО, в этом случае sp2-гибридные АО получаются в результате линейной комбинации s и двух р-орбиталей:
φ1 = f(s) + f(p)x + f(p)y ; φ2 = f(s) — f(p)x + f(p)y ; φ3 = f(s) + f(p)x — f(p)y
sp2-гибридные орбитали обеспечивают плоское строение молекулы с углом в 120° между связями. В молекуле этилена sp2-гибридные АО углерода получаются при линейной комбинации 2s, 2px и 2py АО. 2рz — АО участвует в образовании π-связи с другим атомом углерода. Обратим внимание на то, что в нормальном состоянии атома углерода валентные электроны расположены на 2s22p2 АО. Для организации sp2-гибридных АО углерода надо затратить энергию на перевод 2s-электрона на 2р-орбиталь. sp2-гибридизация АО реализуется в трихлориде бора, BСl3 и подобных молекулах, в ионе СО32–, С2Н4.
sp3-гибридизация имеет место при линейной комбинации четырех атомных орбиталей одного слоя (т. е. с одинаковым главным квантовым числом n), s, px,py,pz. В этом случае гибридные φi AO получаются в результате линейных комбинаций:
φ1 = f(s) + f(p)x + f(p)y + f(p)z ; φ2 = f(s) — f(p)x + f(p)y + f(p)z
φ3 = f(s) + f(p)x — f(p)y + f(p)z ; φ4 = f(s) + f(p)x + f(p)y — f(p)z
sp3 — гибридизация обеспечивает угол между связями ≈ 109°. При этом атом надо расположить в центре правильного тетраэдра, sp3-гибридных орбитали будут направлены от атома к вершинам тетраэдра. Особое значение имеет гибридизация атомных орбиталей атома кислорода в молекуле воды. Гибридизация АО атома кислорода и образование водородных связей (см. дальше) объясняют свойства воды в жидком состоянии.
sp3-гибридизация АО атома кремния в ионе SiO44– объясняет строение силикатов и т. д.
Кроме рассмотренных типов гибридизации атомных орбиталей существует dsp2-гибридизация АО, которая обеспечивает плоское строение молекулы с углом в 90° между связями (ион AuCl4–), тригонально-бипиримидальная гибридизация АО dsp3 (PСl5) и т. д.
2.6. Основные идеи метода молекулярных орбиталей в приближении ЛКАО
В методе валентных связей, при образовании молекулы из атомов, принимаются во внимание только парные взаимодействия атомов. В методе МО это ограничение снимается и исходная молекулярная орбиталь φ представляет собой линейную комбинацию атомных орбиталей всех атомов, участвующих в образовании молекулы:
φ = ca1φa(1) + ca2φa(2) + ca3φa(3) + ... + cb1φb (1) + ...
φa(1) — волновая функции первого электрона атома «а», φa(2) — волновая функция второго электрона атома «а» и т. д. <cai|cai> вероятность обнаружить электрон ei в окрестности атома «а». Если эта вероятность не равна 1, значит электрон делокализован по молекуле. Метод МО ЛКАО был успешно реализован для расчета π-связей в молекулах с двойными и тройными связями между атомами в молекуле (например, для объяснения цветности органических красителей, люминесценции и флюоресценции, процессов фотосинтеза и т. д.). В данного типа расчетах состояние π-электронов рассматривалось в электрическом поле остова молекулы, создаваемого σ-связями молекулы. В свою очередь, σ-связи рассчитывались по методу ВС.
2.7. Описание молекулы по методу МО ЛКАО
В методе МО исчезает представление об индивидуальности атомов, из которых построена молекула; молекула состоит не из атомов, а представляет собой качественно новую систему, образованную несколькими атомными ядрами и движущимися в их электромагнитном поле электронов. Конструирование МО в методе ЛКАО подчиняется нескольким правилам:
1) число молекулярных орбиталей равно общему числу исходных АО;
2) количество связывающих и разрыхляющих МО орбиталей равны между собой;
3) число связывающих МО равно числу участвующих в образовании АО того атома, у которого их меньше;
4) распределение всех электронов по энергетическим уровням подчиняется принципу Паули и закону минимальности энергии молекулы.
Строение двухатомных гомоядерных молекул. Гомоядерные двухатомные молекулы — это молекулы, образованные из одинаковых атомов, например, молекула водорода Н2, кислорода О2, азота N2 и т. д. Ядра атомов гомоядерных молекул имеют одинаковые заряды, поэтому соответствующие квантовые состояния атомов, которые входят в молекулу, имеют одинаковую энергию. В двухатомной молекуле существует выделенное направление — это ось молекулы, вдоль которой направлено электрическое поле ядер. Это направление определяет направление оси 0Z декартовой системы координат, относительно которой определятся координаты составных частей молекулы. Взаимодействие молекулярного электрона с осевым электрическим полем зависит от магнитного квантового числа ml, но не от его знака. Поэтому вводят квантовое число λ =| ml |, которое определяет тип молекулярной орбитали линейной молекулы:
|
Квантовое число λ |
1 |
2 |
3 |
|
Тип МО |
σ |
π |
δ |
Все МО дважды вырождены, кроме σ. В обозначении молекулярной орбитали записывается информация о типе МО (σ, π, δ ...), четности или нечетности (символы g или u) МО. У разрыхляющей МО справа вверху ставится звездочка. Например, запись σ*u2s означает, что данная МО является разрыхляющей линейной комбинацией 2s атомных орбиталей и изменяет знак при инверсии относительно отражения в центре молекулы (нечетная МО). МО легких молекул от (H2 до N2) заполняются в последовательности, соответствующей возрастанию энергии МО:
σ1s < σ*1s < σ2s < σ*2s < πx = πy < σz < π*x = π*y < σ*z;
σz = σ2pz, πx = π2px, πy = π2py ... (a).
МО более тяжелых двухатомных молекул заполняются в последовательности:
σ1s < σ*1s < σ2s < σ*2s < σz2pz < πx = πy < π*x = π*y < σ*z2pz ...(b)
Совокупность молекулярных орбиталей, занятых электронами, определяет электронную конфигурацию молекулы. В приведенных последовательностях заполнения МО использована упрощенная запись МО. Имеет смысл уточнить некоторые обозначения. Запись σz обозначает связывающую МО, которая является линейной комбинацией 2pz АО атомов: φ = A[φ(2pz) + φ(2pz)] (рис. 2.4). Запись σ*z обозначает разрыхляющую МО, которая является линейной комбинацией 2pz АО, но со знаком минус: φ = A[φ(2pz) — φ(2pz)]. МО типа πx и πy получаются в результате линейной комбинации 2px и 2py АО атомов; например, волновая функция МО πx имеет вид: φ(πx ) = А[φ(2px) + φ(2px)]. На рисунке 2.5 приведен фрагмент энергетической диаграммы, на котором показано относительное положение энергии МО, которые получены в результате линейной комбинации 2р атомных орбиталей второго периода до азота включительно. Анализ диаграммы позволяет получить детальную информацию о молекуле — число и тип химических связей, оценить устойчивость молекулы и т. д. Электроны заселяют МО с учетом минимума энергии, принципа Паули и правила Гунда. Наиболее простую энергетическую диаграмму имеет молекула водорода. Электронная конфигурация молекулы в основном состоянии [(σg1s)2]. Два ее электрона согласно закону наименьшей энергии занимают наиболее низкую орбиталь σ1s и согласно принципу Паули имеют противоположные спины.

Рис. 2.4. Молекулярная орбиталь σz
Описание молекулы водорода в методе ЛКАО. 1. Число ядер, участвующих в образовании молекулы, — два. 2. Число электронов в молекуле — два. Пусть φ1(1s) — АО электрона первого атома водорода, φ2(1s) — АО электрона второго атома водорода. Используя две АО мы можем сконструировать две молекулярные орбитали: φ1 = C11φ1(1s) + C12φ2(1s), σs φ2 = C21φ1(1s) – C22φ2(1s), σ*s.
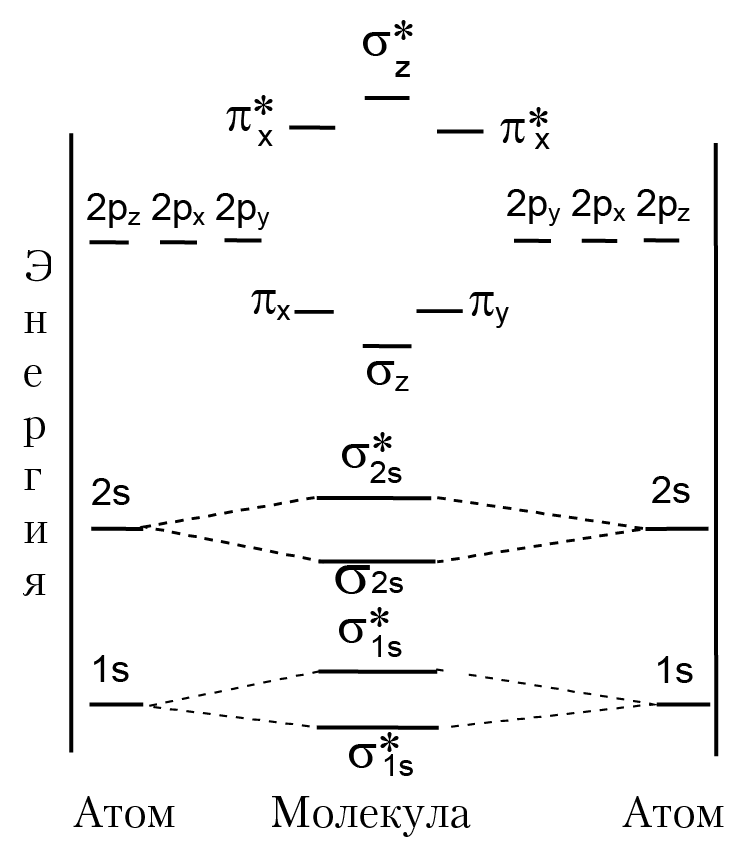
Рис. 2.5. Относительное расположение энергии молекулярных орбиталей
Первая МО — это связывающая σs орбиталь, вторая МО — это разрыхляющая σ*s орбиталь. Естественно, энергия электронов на связывающей орбитали [E(σ)] меньше энергии электронов на разрыхляющей орбитали [E(σ*)]; [E(σ)] < [E(σ*)]. Cij2 — электронная плотность (вероятность обнаружить электрон i около ядра j). На рисунке 2.6 по оси OY откладывается энергия электронов в составе атома (боковые вертикальные линии) и энергия электронов в составе молекулы (по центру диаграммы).
Согласно принципу Паули, на каждой орбитали можно разместить только по два электрона с противоположно направленными спинами.
Если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях, такая молекула устойчива.
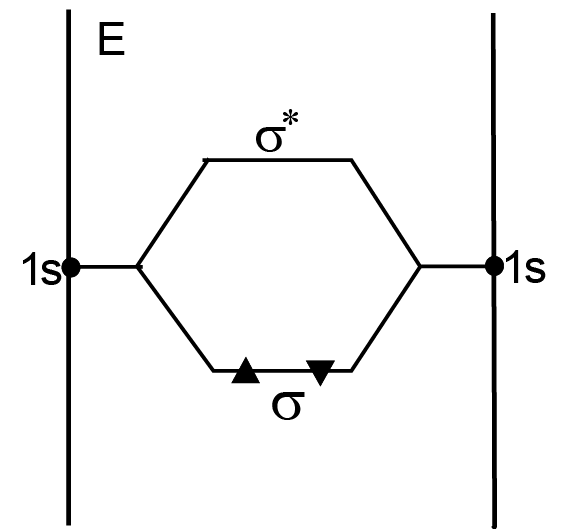
Рис. 2.6. Энергетическая диаграмма водорода
Согласно этому правилу, можно утверждать, что будут устойчивы молекула водорода (все электроны молекулы размещаются на связывающей орбитали), ион Н2– (на связывающей орбитали два электрона, на разрыхляющей — один). Не может существовать молекула He2, так как число электронов на связывающей орбитали равно числу электронов на разрыхляющей орбитали.
Молекула аммиака. В образовании молекулы аммиака принимает участие восемь электронов; пять от атома азота (два внутренних электрона 1s2 не принимают участие в образовании химических связей) и три электрона от трех атомов водорода. Число АО — семь; от атома азота: 2s орбиталь, 2px, 2py, 2pz орбитали; от атомов водорода — три 1s орбитали. Требование о равенстве числа связывающих и разрыхляющих орбиталей может быть удовлетворено, если три орбитали окажутся связывающими, три — разрыхляющие и одна займет промежуточное положение (энергия электронов на этой орбитали выше, чем на чистой связывающей орбитали, но ниже, чем на разрыхляющей орбитали).
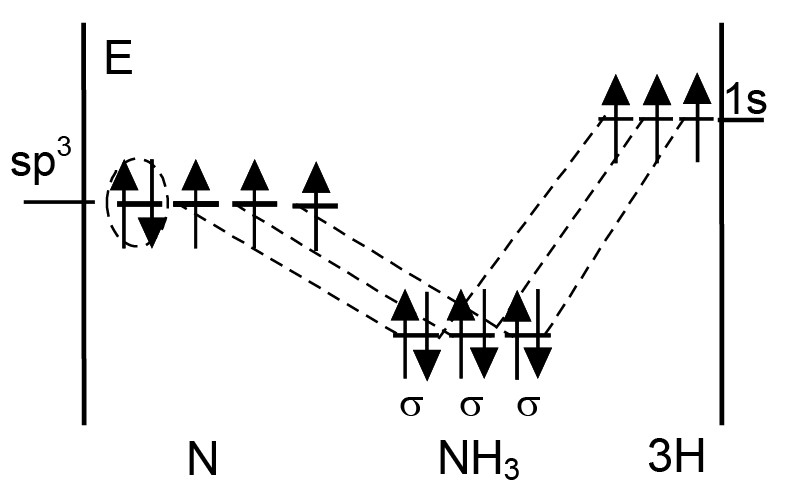
Рис. 2.7. Энергетическая диаграмма молекулы аммиака
С помощью семи АО мы можем получить семь МО. Все молекулярные орбитали σ-типа. При построении энергетической диаграммы для молекулы аммиака имеет смысл принять во внимание тетраэдрический характер связей в молекуле: угол между связями в молекуле ~107° и имеется не поделенная электронная пара. Поэтому описанием молекулы будет более точным, если мы примем во внимание sp3-гибридизацию атома азота. На рисунке 2.7 приведена энергетическая диаграмма молекулы аммиака с учетом гибридизации атома азота. На рисунке 2.8 приведено относительное расположение энергетических уровней электронов в основном состоянии атома азота, [а] и после гибридизации атомных орбиталей [б]. Два спаренных электрона (внутри эллипса) образуют не поделенную электронную пару, которая не принимает участие в образовании химической связи.
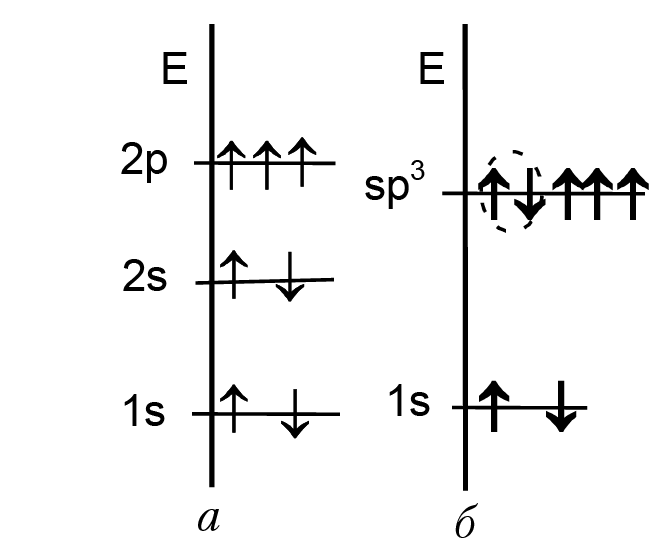
Рис. 2.8. Относительное расположение энергетических уровней в атоме азота
Полярность химической связи. Если в образовании химической связи участвуют разные атомы, то вклад их АО в образование молекулярной орбитали может быть неодинаковым (в методе МО ЛКАО это учитывается автоматически, так как квадраты коэффициентов перед атомными волновыми функциями пропорциональны вероятности обнаружить электроны около соответствующего атома). От этого зависит так называемая полярность химической связи. Например, в молекуле LiH атомные орбитали атомов сильно отличаются по своим параметрам, (см. таблицы электроотрицательности атомов). Это приводит к тому, что на атоме лития возникает избыточный отрицательный заряд, а на атоме водорода — избыточный положительный заряд. Смещение центра тяжести электронной плотности к атому лития приводит к возрастанию вклада электрического взаимодействия в энергию молекулы. В этом случае говорят о возрастании полярности химической связи. Мерой полярности служит величина дипольного момента связи: µ = l × δe, l — расстояние между центрами тяжести положительных и отрицательных зарядов. Для молекулы LiH µ = 5,83 Д (1 Дебай = 3,34 × 10–30 Кл×м), для HF µ = 1,826 Д.
2.8. Строение отдельных молекул
В зависимости от строения АО валентных электронов атомы соединяются в молекулы различными способами. Для одних атомов необходима предварительная гибридизация АО, для других этого не требуется. Все определяется выигрышем в энергии при образовании молекулы из атомов.
Молекула азота. Для атома азота электронная конфигурация электронов может быть записана в виде: 1s22s22(pх1, py1, pz1), т. е. наличие в основном состоянии трех не спаренных р-электронов. За счет перекрывания трех р-АО образуется молекула азота N2 : при этом образуется одна σ-связь за счет перекрывания px АО и две π-связи за счет перекрывания py и pz атомных орбиталей (см. рис. 2.8).
Вода. Интересно сравнить строение молекул воды и сероводорода. В ряду ковалентных гидридов H2O–H2S–H2Se–H2Te вода резко отличается по своим свойствам от остальных трех гидридов. Отличается и строение молекулы воды от строения молекул трех остальных гидридов. Проследим эти отличия на примере воды и сероводорода H2S.
Электронная конфигурация атома кислорода: 1s22s22p4
Электронная конфигурация атома серы: 1s22s22p63s23p4.
Атом кислорода, так же как и атом серы, имеет два неспаренных (валентных) электрона на px и py орбиталях. Если атом кислорода будет присоединять к себе два атома водорода, находясь в основном электронном состоянии, тогда угол между связями должен быть равен 90° (угол между px и py орбиталями — 90°). Чтобы объяснить валентный угол в молекуле воды (106°), необходимо предположить, что имеет место sp3-гибритизация АО валентных электронов атома кислорода. В этом случае мы получаем четыре sp3-гибридных атомных орбитали, на которых располагаются 6 электронов: две гибридные орбитали заняты двумя парами электронов, спины которых скомпенсированы (неподеленные электронные пары), две другие гибридные орбитали занимают два валентных электрона. Четыре sp3-гибридных орбитали получаются как линейные комбинации трех 2р-орбиталей и одной 2s- орбитали. Два электрона будут задействованы для образования ковалентной химической связи с атомами водорода, две неподеленные электронные пары участвуют в образовании водородной связи с другими молекулами воды. Наличие водородной связи деформирует угол между атомами кислорода и водорода, уменьшая его от классического значения ≈ 109° до 106°. В отличие от кислорода, атом серы присоединяет атомы водорода, оставаясь в основном электронном состоянии, в котором валентные электроны располагаются на 3px и 3py-орбиталях. Поэтому угол между связями в молекуле сероводорода H2S — 90°.
В силикатах, представляющих собой кислородные соединения кремния, основу структуры составляют связанные между собой через общие атомы кислорода тетраэдрические группы [SiO44–]. Для атома кремния Si характерна sp3-гибридизация атомных орбиталей, ориентированных в пространстве к четырем вершинам правильного тетраэдра. Данный тип гибридизации получается при возбуждении 3s-электрона на 3р АО:
1s22s22p63s23p2 — исходная электронная конфигурация атома кремния;
1s22s22p63s13p3 — возбужденная электронная конфигурация атома кремния.
При образовании связи с кислородом в силикатах кремний использует свои 4 гибридные sp3 АО. Атом кислорода использует одну из своих валентных 2р АО для связи с атомом кремния. В этом случае угол Si–O–Si должен быть прямым («чистые» р–АО задают прямой угол между связями). Но рентгенографические и нейтронографические исследования показывают, что угол связи Si-O-Si изменяется в различных силикатах от 120° до 180°. Это означает, что в образовании связи Si–O участвуют гибридные АО атома кислорода, причем с разной степенью гибридизации: от sp до sp3-гибридизации (табл. 2.5).
Таблица 2.5. Угол между связями Si–O–Si в силикатах
|
Модификация кварца |
Угол связи (градусы) |
|
Кварц низкотемпературный (α-кварц) Кварц высокотемпературный (β-кварц) Кристобалит высокотемпературный |
143...147 146...155 152...180 |
2.9. Строение неорганических кристаллических веществ
Рассмотрим строение твердых тел, в которых атомы и молекулы объединяются в структуру, которая называется кристаллической решеткой. Структурной единицей кристаллической решетки могут быть атомы, молекулы, ионы. Атомы могут объединяться в ковалентные кристаллы (например, фуллерены, алмаз, графит), или образовывать кристаллические металлические вещества (например, железо, магний и т. д.). В алмазе связь между атомами образуется за счет перекрывания sp3-гибридных орбиталей атомов углерода. Данный тип ковалентной связи обеспечивает наибольшее количество атомов на единицу объема и самую большую в природе твердость вещества. В металлах перекрывание атомных орбиталей приводит к образованию связывающих и разрыхляющих молекулярных орбиталей. При увеличении числа атомов расширяется интервал энергий молекулярных орбиталей с одновременным увеличением числа уровней энергии в этом интервале. Это приводит к тому, что разница между энергиями молекулярных орбиталей непрерывно уменьшается и образуется почти непрерывный энергетический спектр, образуется энергетическая полоса. Электроны, участвующие в образовании связи, заполняют преимущественно связывающие молекулярные орбитали, охватывающие весь металл. Отметим, что незаполненные молекулярные орбитали лежат очень близко к заполненной энергетической полосе (уровню Ферми). Это приводит к тому, что для возбуждения электронов с уровня Ферми требуется малое количество энергии, что обеспечивает исключительную подвижность электронов в пределах поверхностного слоя металла. Если принимать во внимание возможность гибридизации атомных орбиталей при образовании химических связей в металле, то число образующихся молекулярных орбиталей будет значительно превышать число электронов, которые могут заполнять эти орбитали. Отметим, что для ковалентных кристаллов (например, для алмаза) энергетическая полоса расщепляется на две зоны — зону, образованную связывающими молекулярными орбиталями и разрыхляющими молекулярными орбиталями. Разница между энергиями этих зон называется энергия запрещенной зоны. Наличие запрещенной зоны приводит к локализации валентных электронов в пределах структурной единицы кристалла, т. е. к серьезным ограничениям в подвижности электронов. В зависимости от ширины запрещенной зоны соответствующие вещества являются или изоляторами (алмаз), или полупроводниками (германий). Для алмаза ширина запрещенной зоны порядка 700 кДж/моль, для германия — 70 кДж/моль. В ионных кристаллических веществах структурной единицей является ион, например Na+, Cl– в кристаллах галита. Природа химической связи между ионами в кристаллической решетке — это электростатическое взаимодействие заряженных частиц с учетом квантомеханических эффектов, которые всегда надо принимать во внимание при анализе взаимодействия частиц на расстояниях порядка размеров атомов или молекулы.

