Ядерные рецепторы – ДНК-связывающие факторы транскрипции с консервативной доменной организацией, чья активность контролируется липофильными лигандами, фосфорилированием и другими белками. Большинство ядерных рецепторов вне зависимости от наличия лиганда локализовано в клеточном ядре, однако рецепторы стероидов в отсутствие гормона могут располагаться и в цитоплазме. После связывания лиганда рецепторы всех типов перераспределяются внутри ядра между нуклеоплазмой и хроматином. В надсемействе ядерных рецепторов наиболее изучены две группы:
- рецепторы стероидных гормонов;
- рецепторы тиреоидных гормонов и ретиноевой кислоты.
В настоящее время надсемейство ядерных рецепторов насчитывает до 200 членов, лиганды многих из них до сих пор неизвестны. К известным лигандам ядерных рецепторов относятся как гормональные соединения (напр., 9-цис-ретиноевая кислота, тестостерон, эстрадиол и др.), так и обычные низкомолекулярные метаболиты (напр., оксипроизводные холестерола – для SF-128 и LXR, специфичного для печени). Обнаружение сиротских рецепторов и их лигандов изменило представление о сигнальных функциях разных метаболитов. Оказалось, что одно и то же соединение способно параллельно использовать два пути проведения сигнала: через мембранные и ядерные рецепторы. Так действуют, например, некоторые эйкозаноиды (через сопряженные с G-белками мембранные рецепторы и через рецепторы активаторов пролиферации пероксисом).
Рецепторы стероидных гормонов
К гормонам стероидной структуры относятся эстрогены, прогестины, андрогены, глюко- и минералокортикоиды. Они синтезируются в гонадах, надпочечниках, а также «нетрадиционных» гормон-продуцирующих тканях (напр. жировой). К мишеням этих соединений относятся репродуктивные органы, опорно-двигательная, сердечно-сосудистая, иммунная, нервная и другие системы. Эффекты стероидных гормонов на клетку можно подразделить на «кратковременные» (секунды-минуты) и «долговременные» (часы-дни), отличающиеся по механизмам воздействия.
Быстрые эффекты осуществляются через мембранные рецепторы29, белковые взаимодействия или негеномные/нетранскрипционные киназные сигнальные пути, влияющие на текучесть мембран. Так эстрогены уменьшают воспалительное повреждение клеток, стабилизируя билипидные мембраны, а нетранскрипционный эффект андрогенов связывают с активацией системы G-белков. Однако вызванный G-белками рост внутриклеточного [Ca2+] способен запускать Ca2+-зависимые транскрипционные факторы (NFAT30 или гены с Ca2+-чувствительными промоторными участками).
Долговременные эффекты осуществляются на уровне генома через ядерные стероидные рецепторы, синтез которых подавляется под действием соответствующих гормонов. Эти рецепторы состоят из шести доменов (A-F), каждый из которых выполняет собственную функцию.
В структуре рецептора различают две активаторные функции (AF): постоянно активную проксимальную AF-1, регулирующую расположение рецептора на ДНК, и активируемую лигандом AF-2, отвечающую за димеризацию рецептора на цепи ДНК и взаимодействие с корегуляторами.
- А/В – вариабельный участок, зависящий от гена, с которого синтезировался данный рецептор. Содержит AF-1 и определяет изоформу рецептора (см. рис. 27);
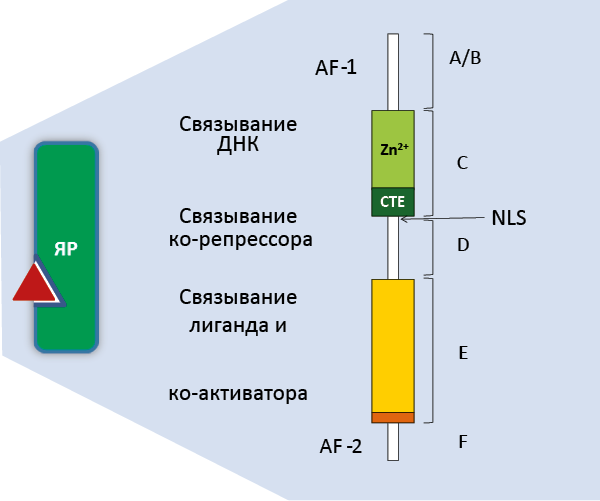
Рис. 27. Структура ядерного рецептора
- С – консервативный участок связывания с ДНК, содержащий Zn2+- связывающие структуры31;
- NLS32 – последовательность между С и D, отвечающая за ядерную локализацию рецептора;
- D – шарнирный домен между С и Е
- Е – консервативный участок связывания лиганда, содержащий AF-2;
- F – домен, необходимый для связывания лиганда рецепторами прогестинов, глюкокортикоидов и андрогенов. Отвечает за различение рецептором агонистов и антагонистов.
В клетке стероидные рецепторы находятся в комплексе с различными белками. Существуют общие комплексообразующие белки, одинаковые для всех рецепторов этого класса, и специфичные для последовательности молекулы. Одной из общих молекул является шаперон Hsp90, который удерживает рецептор в цитоплазме, готовя его к взаимодействию с гормоном, и одновременно препятствует его самопроизвольной активации.
Важную роль в нормальном функционировании рецепторов играют многочисленные кофакторы, которые можно разделить на коактиваторы и корепрессоры (рис. 28). Коактиваторы (напр. SRC связывается с AF-2 областью рецептора и через CREB-связывающий белок предаёт сигнал на основной транскрипционный аппарат) участвуют в образовании комплекса агонист-рецептор и необходимы для обеспечения доступа к ДНК и поддержания транскрипции. Корепрессоры связываются с комплексом антагонист-рецептор, подавляя активацию транскипции через гистондеацетилазы.
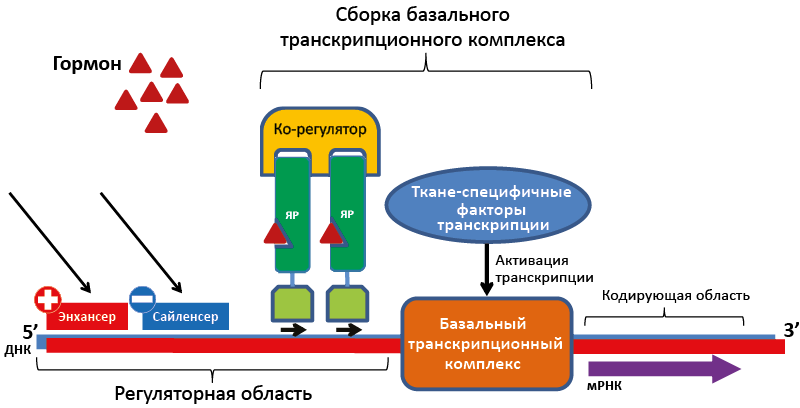
Рис. 28. Схема работы ядерного рецептора
Ядерные стероидные рецепторы связываются со специфическими участками ДНК – гормончувствительными элементами (HRE). HRE представляют собой две нуклеотидные последовательности (палиндромы, прямые или обратные повторы), разделённые опеределенным количеством оснований. С каждой из последовательностей связывается по одному стероидному рецептору, которые вместе образуют гомо- или гетеродимер.
HRE стероидных гормонов можно разделить на три группы:
- Палиндромы33;
- Прямые повторы;
- Обратные повторы;
Последовательности, образующие эти HRE, практически идентичны. HRE для рецепторов эстрогенов отличаются отсутствием гидрофобной метильной группы у нуклеотида в третьем положении, которая необходима для связывания PR, MR, GR и AR. Таким образом у ER (соответственно, эстрогенов) есть свои собственные мишени на ДНК, независимые от AR.
Рецепторы андрогенов
Рецепторы андрогенов – группа ядерных рецепторов половых стероидов, естественными агонистами которых являются тестостерон и дигидротетстостерон (DHT). Состоят из 6 доменов (A-F) и существуют в двух изоформах – многочисленной длинной (AR-В) и малочисленной короткой (AR-A). HRE для рецепторов андрогенов (ARE) преимущественно располагаются в участках вблизи промоторной области гена, однако эффективны только содержащие полный ARE или его половину (оба варианта функциональны, но активность полных ARE34 выше). ARE способны регулировать синтез иРНК белков не только напрямую, но и опосредованно, например, через транскрипцию Mef2с (стимулирует синтез белков саркомера).
Андрогены напрямую регулируют транскрипцию генов микроРНК, отвечающих за деление и дифференцировку клеток. Делению мышечных клеток-сателлитов35 способствуют микроРНК133, снижающая уровень необходимого для дифференцировки SRF36, и микроРНК221/222, ингибирующие р57 (ингибитор клеточного цикла). В дальнейшем андрогены стимулируют синтез микроРНК206, направляя клетки по пути дифференцировки. Эта микроРНК ингибирует α-субъединицу ДНК-полимеразы, препятствуя пролиферации.
Рецепторы эстрогенов
Рецепторы эстрогенов связаны с эстрогенчувствительными элементами (ERE) на целевых генах и изменяют их экспрессию, взаимодействуя с факторами транскрипции и прочими кофакторами (вплоть до связывания дополнительных лигандов).
На сегодняшний день известно два типа ER: ERα37 и ERβ. Они имеют сходную аминокислотную последовательность, но разные уровни экспрессии в тканях. Было показано, что в костной ткани ERβ снижает транскрипцию генов, регулируемую ERα. Основываясь на этих сведениях, была предложена модель «Инь-Янь» взаимоотношений между этими изоформами. Есть свидетельства, что ER способны к гетеродимеризации, причём образуются не только ERα+ERβ гетеродимеры, но и ERα+AR.
Рецепторы глюкокортикоидов
В интактном состоянии рецептор глюкокортикоидов располагается в цитоплазме, но после связывания с гормоном образует гомодимеры и проникает в ядро. Узнавание целевых генов происходит за счёт α-спирали в основании цинкового пальца рецепторной молекулы. Иммуносупрессивные свойства глюкокортикоидов во многом связаны с подавлением ядерного фактора NF-kB, отвечающего за синтез провоспалительных белков. NF-kB и активный рецептор глюкокортикоидов физически взаимодействуют, инактивируя друг друга (то же наблюдается и для других стероидных рецепторов).
Рецепторы минералокортикоидов
В цитоплазме и ядре клеток-мишеней выявляются рецепторы, с высокой аффинностью связывающие альдостерон, причём концентрация рецепторов в цитоплазме до 100 раз выше, чем в ядре, однако ядерные рецепторы связывают гормон с гораздо большей аффинностью и специфичностью. Рецепторы глюко- и минералокортикоидов – структурно близкие молекулы, причём минералокортикоидные рецепторы с равным сродством связывают как глюко-, так и минералокортикоиды (специфичность достигается путём тканевой инактивации глюкокортикоидных гормонов). После связывания лиганда рецепторы связываются комплексом регуляторных ядерных белков, запуская транскрипцию зависимых участков ДНК, в том числе генов аквапоринов и ионных каналов.
Рецепторы тиреоидных гормонов
Отличительная особенность рецепторов тиреоидных гормонов в том, что они постоянно связаны с ДНК, репрессируя активность соответствующих генов. Связывание гормона активирует рецептор, запуская стимулирующую активность и подавляя ингибирующую, причём сродство рецептора к трийодтиронину (Т3) в 10 раз превышает сродство к Т4. Тиреоидные гормоны взаимодействуют и с низкоаффинными связывающими участками в цитоплазме, предположительно необходимыми для удержания гормонов поблизости от истинных рецепторов. В клетке тиреоидные гормоны индуцируют митохондриальную α-глицерофосфатдегидрогеназу, увеличивают экспрессию Na+/K+-АТРазы и гормона роста, стимулируя энергообмен и общий синтез белка.
Рецепторы ретиноидов
Рецепторы ретиноевой кислоты (RAR) – ядерные белки, у млекопитающих присутствующие в трёх изоформах – α, β и γ. Близки им по структуре Х рецепторы ретиноидов (RXR), реагирующие только на высокие концентрации лигандов. Как и стероидные рецепторы, рецепторы ретиноидов после связывания лиганда могут формировать гетеродимеры, связывающиеся со специфическими последовательностями ДНК и запускающие экспрессию соответствующих генов. Ретиноиды стимулируют опосредованную клетками цитотоксичность и образование антител к опухолевым антигенам, а также влияют на синтез специфических кератинов, на уровне генов снижают продукцию холестеролсульфата и липидов, подавляют экспрессию трансглутаминазы I типа.
Рекомендуемая литература
1. Spiegel A.M., Shenker F., Weinstein L.S. 1992 Receptor-effector coupling by G-proteins: implications for normal and abnormal signal transduction. Endocr Rew 13:536-565
2. Landis C.A., Masters S.B., Spada A., Pace A.M., Bourne H.R., Vallar L. 1989 GTPase inhibiting mutations activate the α chain of Gs and stimulate adenylyl cyclase in human pituitary tumours. Nature 340:692-696
3. Graziano M.P., Gilman A.G. 1989 Synthesis in Escherichia coli of GTPase-deficient mutants of Gsα. J Biol Chem 264:15475-15487
4. Мasters S.B., Landis C.A., Bourne H.R. 1990 GTPase-inhibiting mutations in the α subunit of Gs. Adv Second Messenger Phosphoprotein Res 24:70-75
5. Vallar L., Spada A., Giannattasio G. 1987 Altered Gs and adenylate cyclase activity in human GH-secreting pituitary adenomas. Nature 330:566-568
6. Lyons J., Landis C.A., Harsh G., Vallar L., Grunewald K., Feichtinger H., Duh Q-Y., Clark O.H., Kewasaki E., Bourne H.R., McCormick F. 1990 Two G-protein oncogenes in human endocrine tumors. Science 249:655-659
7. Castrillo J-L., Theill L.E., Karin M. 1991 Function of the homeodomain protein GFH1 in pituitary cell proliferation. Science 253: 197-199
8. Sondek J., Lambright D.G., Noel J.P., Hamm H.E., Sigler P.B. 1994 GTPase mechanism of G-proteins from the 1.7-Å crystal structure of transducin α-GDP-AlF4-. Nature 372:276-279
9. Wall M.A., Coleman D.E., Lee E., Iniguez-Lluhi J.A., Posner B.A., Gilman A.G., Sprang S.R. 1995 The structure of the G protein heterotrimer Giα1β1γ2. Cell 83:1047-1058
10. Muca C., Vallar L. 1994 Expression of mutationally activated Gαs stimulates growth and differentiation of thyroid ERTL5 cells. Oncogene 9:3647-3653
11. Zeiger M.A., Saji M., Gusev Y., Westra W.H., Takiyama Y., Dooley W.C., Kohn L.D., Levine M.A. 1997 Thyroid-specific expression of cholera toxin A1 subunit causes thyroid hyperplasia and hyperthyroidism in transgenic mice. Endocrinology 138:3133-3140
12. Pomerance M., Abdullah H-B., Kamerji S., Correze C., Bloundeau J-P. 2000 Thyroid stimulating hormone and cyclic AMP activate p38 mitogen-activated protein kinase cascade. Involvement of protein kinase A, Rac1, and reactive oxygen species. J Biol Chem 275:40539-40546
13. Williamson E.A., Johnson S.J., Foster S., Kendall-Taylor P., Harris P.E. 1995 G protein gene mutations in patients with multiple endocrinopathies. J Clin Endocrinol Metab 80:1702-1705
14. Yoshimoto K., Iwahana H., Fukuda A., Sano T., Itakura M. 1993 Rare mutations of the Gsα subunit gene in human endocrine tumors: mutation detection by polymerase chain reaction-primer-introduced restriction analysis. Cancer 72:1386-1393
15. Vessey S.J.R., Jones P.M., Wallis S.C., Schofield J., Bloom S.R. 1994 Absence of mutations in the Gsα and Gi2α genes in sporadic parathyroid adenomas and insulinomas. Clin Sci 87:493-497
16. Reincke M., Karl M., Travis W., Chrousos G.P. 1993 No evidence for oncogenic mutations in guanine nucleotide-binding proteins of human adrenocortical neoplasms. J Clin Endocrinol Metab 77:1419-1422
17. McCune D.J. 1936 Osteitis fibrosa cystica; the case of a nine year old girl who also exhibits precocious puberty, multiple pigmentation of the skin and hyperthyroidism. Am J Dis Child 52:743-744
18. Albright F., Butler A.M., Hempton A.O., Smith 1937 Syndrome characterized by osteitis fibrosa disseminate, areas of pigmentation and endocrine disfunction, with precocious puberty in females. N Engl J Med 216:727-746
19. Tidball, J.G., Inflammatory processes in muscle injury and repair. Am J Physiol Regul Integr Comp Physiol, 2005. 288 (2): p. R345-53.
20. Velders, M. and P. Diel, How sex hormones promote skeletal muscle regeneration. Sports Med, 2013. 43 (11): p. 1089-100.
21. Saclier, M., et al., Differentially activated macrophages orchestrate myogenic precursor cell fate during human skeletal muscle regeneration. Stem Cells, 2013. 31 (2): p. 384-96.
22. Wyce, A., et al., Research Resource: The androgen receptor modulates expression of genes with critical roles in muscle development and function. Mol Endocrinol, 2010. 24 (8): p. 1665-74.
23. Beato, M. and J. Klug, Steroid hormone receptors: an update. Hum Reprod Update, 2000. 6 (3): p. 225-36.
24. Pietras, R.J. and C.M. Szego, Specific binding sites for oestrogen at the outer surfaces of isolated endometrial cells. Nature, 1977. 265 (5589): p. 69-72.
25. Bhasin, S., L. Woodhouse, and T.W. Storer, Proof of the effect of testosterone on skeletal muscle. J Endocrinol, 2001. 170 (1): p. 27-38.
26. Pizza, F.X., et al., Comments on Point:Counterpoint: Estrogen and sex do/do not influence post-exercise indexes of muscle damage, inflammation, and repair. J Appl Physiol (1985), 2009. 106 (3): p. 1016-20.
28 Стероидогенный фактор 1.
29 По данным Pietras и Szego рецепторы эстрогенов обнаружены в мембранах и мембранных структурах.
30 Ядерный фактор активированных Т-клеток.
31 Структурно близки «цинковым пальцам».
32 NuclearLocalizationSignal – Сигнал Локализации в Ядре.
33 Последовательности нуклеотидов, одинаково считываемые в обоих направлениях.
34 В клетках мышечной ткани эффективны до 90% ARE.
35 Мышечные клетки-предшественники.
36 Фактор ответа сыворотки.
37 Отмечается участие ERα в развитии рака молочной железы и с этой целью были разработаны селективные эстроген-рецепторные модуляторы (SERM), напр. Базедоксифен и Лазофоксифен.