Общие замечания. Начиная с этого типа соединений мы будем иметь дело с минералами, резко отличающимися по своим свойствам от рассмотренных до сих пор. В подавляющей массе это будут уже соединения с типичной ионной или ковалентной полярной связью, обусловливающей совсем другие свойства минералов. Наиболее яркими представителями их являются галоидные соединения металлов.
С химической точки зрения относящиеся сюда минералы представлены солями кислот: HF, HCl, HBr и HJ; соответственно этому среди данных минералов различают фториды, хлориды, бромиды и иодиды. Галогеносоли являются комплексными соединениями, из которых здесь рассматриваются фторалюминаты. Кроме того, существуют водные соли и более сложные соединения, содержащие добавочные кислородсодержащие анионы: [ОН]1–, О2–, изредка [SO4]2– и [JO3]1–. Это так называемые оксигалоидные соединения, переходные к типичным кислородным соединениям.
Как показано на рис. 133, главные элементы, образующие галогениды, в противоположность тому, что мы наблюдали в ранее рассмотренных минералах, расположены в левой половине менделеевской таблицы, преимущественно в I и во II группах. Галоидные соединения тяжелых металлов, наоборот, играют совершенно ничтожную роль в минералогии природных образований и возникают в особых условиях.
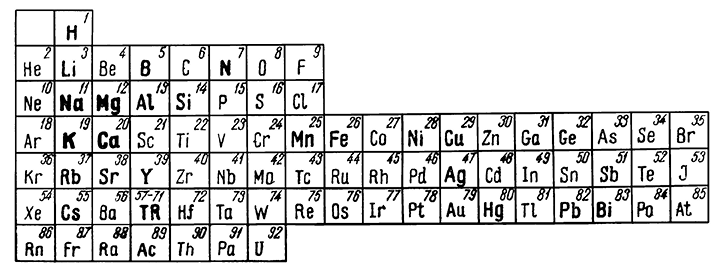
Рис. 133. Элементы, для которых характерны соединения с галоидами
(выделены жирным шрифтом)
Кристаллохимические особенности галоидных соединений. Установлено, что галогениды легких металлов характеризуются структурами с типичной гетерополярной (ионной) связью, тогда как в соединениях тяжелых металлов, катионы которых обладают сильной поляризацией, возникают гомополярные (ковалентные) или переходные к ним связи между ионами. В соответствии с этим находятся и физические свойства минералов.
Так как в галогенидах с типичной ионной связью принимают участие катионы легких металлов с малыми зарядами и большими ионными радиусами, а в связи с этим с весьма слабой способностью к активной поляризации, то естественно, что эти минералы обладают прозрачностью, бесцветностью (наблюдаемые окраски, как правило, являются аллохроматическими), малыми удельными весами, а также такими свойствами, как необычайно легкая растворимость многих галогенидов в воде, низкие показатели преломления, а следовательно, и слабый стеклянный блеск минералов.
Что касается катионов тяжелых металлов с 18-электронной наружной оболочкой (Cu, Ag и др.), склонных к сравнительно резко выраженной поляризации окружающих анионов и к образованию кристаллических структур с ковалентной связью, то здесь мы наблюдаем уже существенные отличия в свойствах галогенидов: высокие удельные веса, наличие у ряда соединений хотя и слабой, но идиохроматической окраски, сильно повышенные показатели преломления, алмазный блеск, резко пониженная растворимость этих минералов и др.
Теперь перейдем к характеристике свойств, зависящих от главных анионов в галогенидах: F1–, Cl1–, Вr1– и J1–.
Прежде всего следует отметить, что анион F1– значительно отличается по своим размерам от остальных анионов, как это видно из сопоставления их радиусов (в ангстремах):
|
F1– |
Cl1– |
Вr1– |
J1– |
|
1,33 |
1,81 |
1,96 |
2,19 |
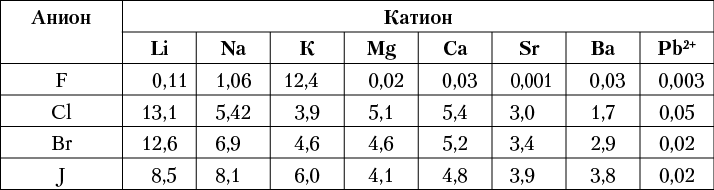
Это обстоятельство весьма существенно сказывается на выборе тех или иных катионов для образования соединений (в соответствии с координационными числами и типом кристаллической структуры), на их устойчивости, а в связи с этим и на физических и химических свойствах. Не случайно главная масса фтора в земной коре связана с Са и отчасти с Аl и Si (в галогеносолях), тогда как хлор и резко подчиненные ему по распространенности бром и йод в основном связаны с Na, К, (Rb), (Cs) и Mg (в водных солях). В противоположность хлоридам, бромидам и иодидам тяжелых металлов (Аu, Ag, Hg и др.) их фториды вовсе не встречаются в природных условиях. Хлориды легких металлов чрезвычайно легко растворяются в водной среде, тогда как их фториды в большинстве своем устойчивы по отношению к воде. Насколько велика разница в растворимости этих типов соединений, можно видеть из данных, приводимых в таблице 7.
Таблица 7. Растворимость галоидных соединений в воде
при 18 °С (в молях на литр насыщенного раствора)
Температуры плавления и кипения фторидов несравненно выше, чем хлоридов тех же металлов. Например, температура кипения SnF4 равна 705 °С, a SnCl4 — 114 °С, фторид алюминия AlF3 кипит при температуре выше 1000 °С, а его хлорид АlСl3 — при температуре всего лишь 81 °С и т. д.
Об особенностях поведения галогенов в природе. Крайне интересны геохимические черты галогенов F, Cl, Br и J, выражающиеся в поведении их при различных геологических процессах.
При магматических процессах не создается условий для концентрации этих элементов в сколько-нибудь значительных количествах. Фтор и хлор лишь в качестве добавочных анионов входят в ряд минералов, преимущественно силикатов и фосфатов (большей частью в пегматитах и контактово-метасоматических образованиях). Главная масса этих элементов, очевидно в виде летучих соединений с металлами, переходит в гидротермальные рас-творы. О том, что хлор и фтор действительно являются составной частью летучих погонов магм, свидетельствуют выделения НСl и HF в газообразных продуктах вулканических извержений, иногда в весьма значительных количествах. Например, на Аляске в долине, известной под названием «Десять тысяч дымов», в 1919 г., по подсчетам, выделилось 1,25 млн т газообразной НСl и 0,2 млн т HF вместе с парами Н2О.
Из галогенидов во многих гидротермальных образованиях широко представлен CaF2 (флюорит), отчасти фторалюминаты, однако хлориды металлов не встречаются, если не считать крайне редких находок NaCl (галита) в виде микроскопических кристалликов в капельках растворов, обнаруживаемых в виде включений в некоторых минералах (кварце, галените).
Зато в экзогенных условиях хлориды Na, в меньшей степени хлориды, К, Mg и других металлов, образуются, нередко в огромных массах, в усыхающих соленосных бассейнах вместе с сульфатами, иногда боратами и другими растворимыми в воде соединениями. Вместе с хлором соответствующая концентрация наблюдается также для брома и йода. В настоящее время 70–75 % всего имеющегося в земной коре хлора (и, очевидно, брома), а также свыше 90 % йода сосредоточено в океанической воде. В противовес этому фториды в соленосных осадках в сколько-нибудь существенных количествах не наблюдаются. Гигантскими коллекторами растворенных хлоридов, как известно, являются океанические и морские бассейны. Однако содержание фтора в морской воде совершенно ничтожно: около 0,8 г на 1 м2, причем, как установлено, этот элемент частично усваивается организмом и входит в состав костяка высших животных, особенно в состав зубной эмали, состоящей почти исключительно из фтористого кальция.
Для миграции фтора в экзогенных условиях характерна еще одна особенность. В процессе выветривания горных пород и рудных месторождений в общей сложности наряду с хлором освобождаются немалые количества этого элемента, но химическое сродство его с кальцием настолько велико, что по пути следования к морским бассейнам он в значительной мере выпадает из растворов с образованием труднорастворимого соединения CaF2 и задерживается в континентальных осадках. Этим и объясняется совершенно незначительное содержание его в морской воде.
О классификации галогенидов. Таким образом, все, что сказано о свойствах галогенидов и геохимической роли галогенов при процессах минералообразования, заставляет все минералы, относящиеся к данному разделу, разбить на два класса.
· Класс 1. Фториды и соли комплексных фторных кислот.
· Класс 2. Хлориды, бромиды и иодиды.

