Мембранные рецепторы – мембранные гликозилированные белки трёхдоменной структуры с мультирецепторным принципом действия, инициирующие метаболические и транскрипционные эффекты в клетках. После связывания лиганда рецепторы сначала активируются, передавая сигнал внутрь клетки, затем происходит гормонзависимая инактивация рецептора. Эту группу рецепторов можно разделить на:
- Рецепторы, не обладающие собственной ферментативной активностью:
– Ассоциированные с G-белками;
– Ассоциированные с тирозинкиназами класса Janus (JAK-киназами);
– Рецепторы, сопряженные с адапторными белками;
– Рецепторы с доменом смерти;
– Рецепторы адипонектина;
- Рецепторы, обладающие ферментативной активностью:
– тирозинкиназы;
– серинтреонинкиназы;
– гуанилатциклазы.
Рецепторы без ферментативной активности
Рецепторы без ферментативной активности – подтип трансмембранных рецепторов, которым для воздействия на каскад вторичных мессенджеров необходимо активировать или связать цитоплазматический или мембранный фермент. После активации рецепторы запускают несколько сигнальных путей, однако лишь один из них является доминирующим, в то время как остальные играют второстепенные роли, например, обеспечивая перекрёстное взаимодействие8 между рецепторами. Спустя некоторое время после связывания гормона рецептор десенситизируется и временно теряет активность. Это происходит за счёт фосфорилирования внутриклеточной петли рецепторного белка киназой, после чего фосфорилированный конец связывается с β-аррестином. Это даёт возможность собрать вокруг будущей везикулы клатриновое покрытие и отделить везикулу с помощью динамина.
Рецепторы, ассоциированные с G-белками
Рецепторы, ассоциированные с G-белками – один из наиболее изученных классов мембранных рецепторов. Белки этой группы состоят из внеклеточного домена, семидоменной трансмембранной части и внутриклеточного домена. С такими рецепторами связан ассоциированный с мембраной адапторный белок с ГТФазной9 активностью (G-белок)10 (рис. 18). При связывании лиганда рецептор претерпевает конформационные изменения, передающиеся на G-белок. Тот, в свою очередь, воздействует на эффекторные молекулы, изменяя концентрации вторичных мессенджеров в цитоплазме.
G-белки – гетеротримерные комплексы, состоящие из (рис. 18):

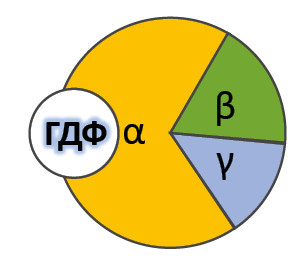
Рис. 18. G-белок
Ферментативной (ГТФазной) активностью обладает только α-субъединица G-белка. В неактивной форме она связана с ГДФ, но при взаимодействии с комплексом гормон-рецептор ГДФ заменяется на ГТФ, снижая сродство G-белка к рецептору. Из-за этого белок отсоединяется от рецептора и диссоциирует на α- и βγ-субъединицы11. Далее до гидролиза ГТФ α-субъединица успевает осуществить свою специфическую функцию, а после – вновь объединяется с βγ-субъединицами с образованием исходного G-белка (рис. 19).
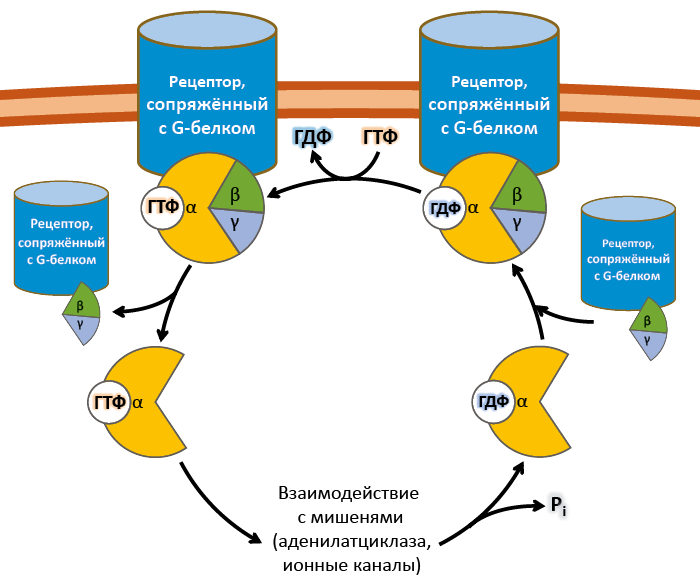
Рис. 19. Цикл активностиG-белков
Несмотря на консервативность структуры и небольшую молекулярную массу, βγ-субъединицы не менее важны. В неактивном G-белке они связываются с α-субъединицей, удерживая её в неактивном (связанном с ГДФ) состоянии, и регулируют сродство рецептора к лиганду. А после диссоциации – активируют фосфолипазу А2, регулируют активность аденилатциклазы, ионных каналов и фосфорилирование рецепторов, обеспечивая «cross-talking» рецепторных систем.
Так как β- и γ-субъединицы достаточно консервативны, классификация G-белков происходит на основании их α-субъединиц, определяющих специфическую функцию белкового комплекса.
Выделяют следующие G-белки:
- Gs1 – активируют аденилатциклазу, L-Ca2+– каналы, ингибируют Na+-каналы;
- Gi1-3 – ингибируют аденилатциклазу, активируют K+– каналы и фосфолипазу C;
- Gq, G11, G14 – активируют фосфолипазу Сβ и Сδ;
- Gt и Gt1 – активируют фосфодиэстеразу;
- Gh – взаимодействуют с α-адренорецепторами;
- G12 – активирует систему малой ГТФазы Rho – протеинкиназ;
- Gx – предположительно активирует фосфолипазу С;
- G0 – предположительно активируют K+-каналы и фосфолипазу C, ингибируют Ca2+ – ПЗК12;
- p100 – предположительно участвет в эндоцитозе рецепторов.
Для прикладной физиологии имеют значение три хорошо изученные группы G-белков, регулирующих основные сигнальные системы:
- Gs – активируют аденилатциклазную систему;
- Gi – ингибируют аденилатциклазную систему;
- Gq – активируют фосфолипазу С и фосфоинозитидную систему.
G-белки не способны свободно передвигаться в цитоплазме. Они заякорены на внутренней поверхности цитоплазматической мембраны двумя углеводородными якорями: миристоевой кислотой (связывает α-субъединицу) и близкой холестерину геранил-гераниловой цепью (связывает βγ-субъединицы). Эти «якоря» одновременно обеспечивают и удержание белка на мембране, и его латеральную подвижность в плоскости мембраны.
Несмотря на многообразие G-белков, их работа завязана на ограниченном наборе эффекторных систем клетки, регулируя которые, они осуществляют свою функцию. Сигнализация преимущественно осуществляется через аденилатцикланую и фосфоинозитидную системы.
Аденилатциклазная система
Работа аденилатциклазной системы (рис. 20) связана с ферментом аденилатциклазой и его продуктом – цАМФ13. цАМФ, в свою очередь, активирует цАМФ-зависимую протеинкиназу А14, фосфорилирующую эффекторные белки (ионные каналы, транспортеры, белки цитоскелета и т. д.). Эту систему активируют рецепторы, сопряжённые с Gs-белками, а ингибируют – сопряженные с Gi-белками.
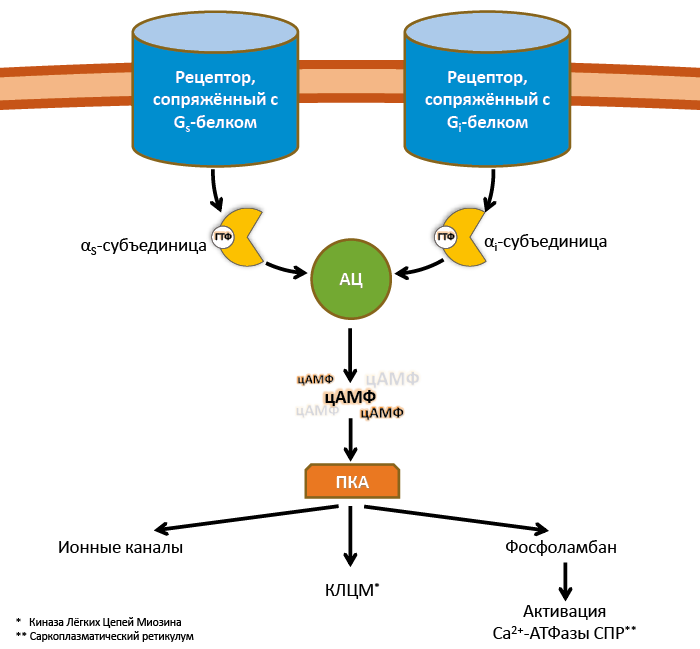
Рис. 20. Аденилатциклазная система
Фосфоинозитидный путь
Часть рецепторов передаёт сигнал через мессенджеры на основе фосфатидилинозитолов: диацилглицерола (ДАГ) и инозитолтрифосфата (IP3) – ключевых участников фосфатидилинозитольного пути (рис. 21). Эти вещества образуются под действием гормональных сигналов из мембранного полифосфоинозида – фосфатидилинозитол-4,5-бифосфата (PIP2). βγ-субъединицы G-белков, а также вторичные мессенджеры тирозинкиназных рецепторов (см. далее) активируют фосфатидилинозитол-3-киназу 1 типа (PI3K1), превращающую фосфатидилинозитолбифосфат в фосфатидилинозитолтрифосфат (PIP3), и активируют фосфолипазы Сβ и Сγ15. α-субъединица Gq-белков стимулирует фосфолипазу Сδ, которая вместе с Сβ и Сγ изоформами обеспечивает образование ДАГ и IP3. Выделившийся в цитоплазму IP3 активирует Ca2+ – IP3-зависимые каналы эндоплазматического ретикуллума, повышая внутриклеточную [Ca2+].
Высокая внутриклеточная концентрация Ca2+ активирует фосфолипазу А2, отвечающую за активность каскада арахидоновой кислоты (и, соответственно, синтез простагландинов, лейкотриенов и тромбоксана), а также кальмодулин16. Остающийся в мембране ДАГ совместно с цитоплазматическим Ca2+ активирует протеинкиназу С (ПКС), фосфорилирующую зависимые белки. Помимо этого, мембранный PIP3 отвечает за активацию протеинкиназ Сγ и Сε, ингибирующих апоптоз, и эффекторных протеинкиназ (Akt и др.) также обеспечивающих выживание клетки.
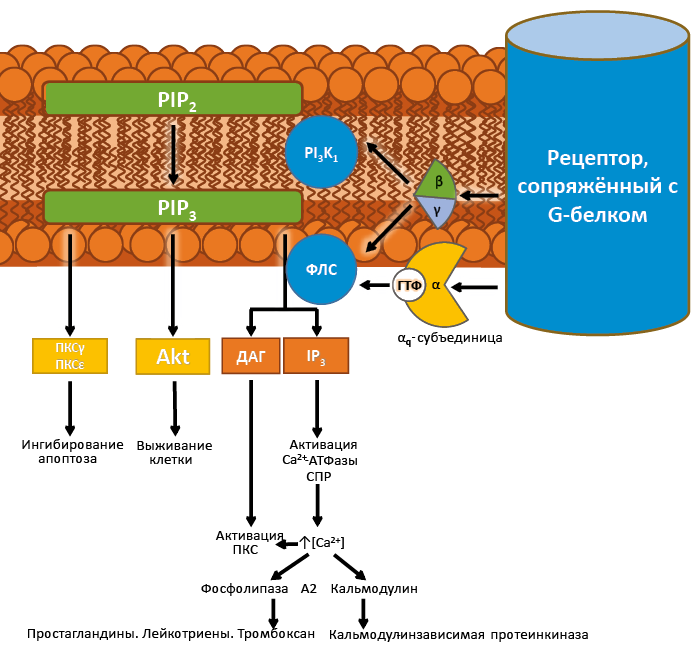
Рис. 21. Фосфатидилинозитольнный путь
МАР-киназный путь
Помимо указанных выше, для рецепторов, сопряженных с G-белками, существует важный дополнительный сигнальный путь – каскад митоген-активируемых протеинкиназ (МАР-киназ), регулирующих выживание, дифференцировку и апоптоз (рис. 22). Принцип их действия заключается в поэтапном фосфорилировании МАР-киназами верхнего уровня МАР-киназ нижнего уровня. Сначала комплекс лиганд-рецептор активирует малые ГТФазы, которые запускают киназы киназ МАР-киназ (МАРККК). Те, в свою очередь, активируют киназы МАР-киназ (МАРКК), которые запускают эффекторные МАР-киназы (МАРК). Далее МАРК фосфорилирует факторы, определяющие будущее клетки – дифференцировку или апоптоз.
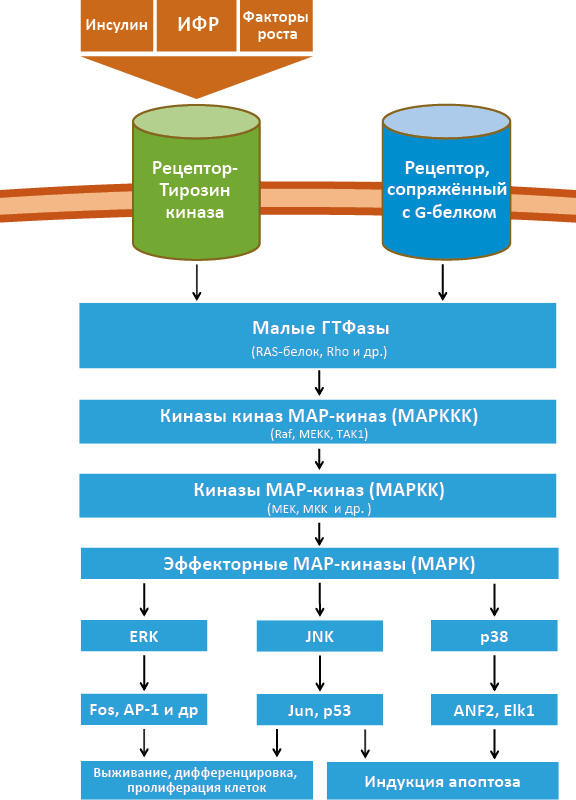
Рис. 22. МАР-киназный путь
MAP-киназный путь у человека устроен сложнее, чем каскад у модельных организмов, за счёт того, что его участники представлены не одним белком, а группой структурно близких ферментов, которые кодируются несколькими генами (например, ERK1, ERK2 и др.). Кроме того, дополнительное разнообразие ферментов достигается альтернативным сплайсингом.
Рецепторы, ассоциированные с тирозинкиназами класса Janus
Принципиально отличным классом рецепторных молекул являются рецепторы, сопряженные с тирозинкиназами класса Janus (Jak-киназами)17. В отличие от описанных ранее молекул, для эффективной передачи сигнала с таких рецепторов необходима их димеризация вокруг молекулы- агониста. При малой18 концентрации гормона он связывается с двумя молекулами рецептора, позволяя их внутриклеточным доменам сблизить Jak-киназы, которые начинают фосфорилировать друг друга, активируя передачу сигнала. Однако при равной концентрации агониста и рецептора передача сигнала по такому механизму невозможна, так как каждый рецептор связан с лигандом, что препятствует их димеризации.
К рецепторам, сопряжённым с JAK-киназами относятся три семейства:
- Семейство рецепторов группы СТГ, лептина, эритропоэтина и интерлейкинов (кроме IL-10);
- Семейство рецепторов интерферонов и IL-10;
- Семейство рецепторов Т- и В-лимфоцитарных антигенов.
Структурно каждый мономерный рецептор, ассоциированный с тирозинкиназой класса Janus, состоит из 3 частей (рис. 23):
- Внеклеточная часть, связывающая гормон, содержащая:
– Остатки Cys, связывающие лиганд;
– WSXWS-бокс, обеспечивающий свёртывание, транспортировку и димеризацию;
- Трансмбранная гидрофобная часть;
- Внутриклеточная часть, содержащая:
– Участок связывания Jak-киназ;
– Участок фосфорилирования Jak-киназами19.
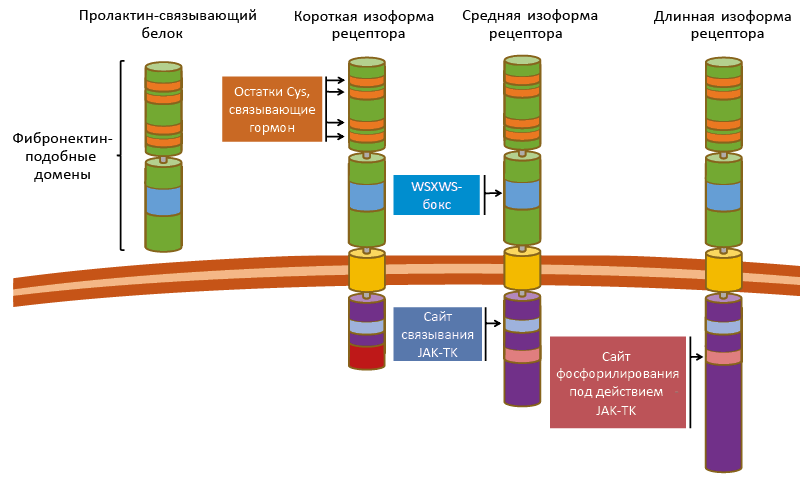
Рис. 23. Доменная организация рецепторов, сопряжённых с Jak-киназами
(на прим. рецептора пролактина)
Рецепторы, ассоциированные с тирозинкиназами класса Janus, передают сигнал по нескольким сигнальным каскадам: STAT, МАР-киназному и фосфатидилинозитольному путям.
STAT20-путь
Активированные Jak-киназы передают сигнал по STAT-пути (рис. 24). После связывания гормона, димеризации рецепторов и фосфорилирования их внутриклеточных доменов JAK-киназами на них садятся STAT-белки. Под действием Jak-киназ они претерпевают активирующее фосфорилирование, после чего направляются в ядро, где активируют транскрипцию генов-мишеней (гены дифференцировки, роста и др.) и генов, кодирующих ингибиторы STAT-пути (белки SOCS, CIS и PIAS).
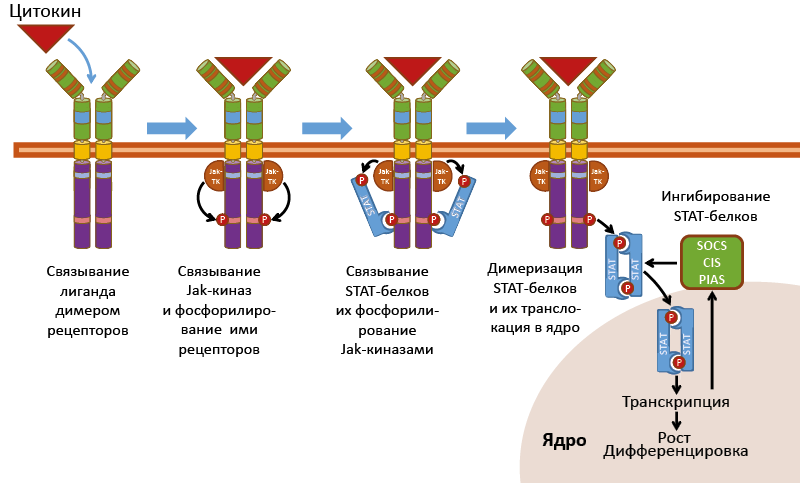
Рис. 24. STAT-путь передачи сигнала
Важно отметить, что пути передачи сигнала зависят от изоформ рецептора, образовавших гомодимер. Так короткие изоформы рецептора пролактина активируют только МАР-киназный путь, в то время как длинные – и МАР-киназный и STAT-пути. Однако обе изоформы задействуют фосфоинозитидный путь через PI3K (фосфатидилинозитид-3-киназу) и активацию эффекторных протеинкиназ (Akt и др.).
МАР-киназный путь (см. рис. 22)
Фосфоинозитидный путь (см. рис. 21)
Рецепторы с ферментативной активностью
Рецепторные тирозинкиназы
Рецепторные тирозинкиназы – трансмембранные белки с ферментативной активностью и одним трансмембранным доменом, связывающие инсулин, ИФР21 и другие ростовые факторы. Как и рецепторы, связанные с Jak-киназами, рецепторные тирозинкиназы димеризуются вокруг лиганда, после чего фосфорилируют друг друга. Однако, в отличие от описанных ранее молекул, рецепторные тирозинкиназы не нуждаются в цитоплазматических Jak-киназах, так как сами обладают тирозинкиназным доменом.
Специфичность связывания факторов роста рецепторными тирозинкиназами достигается за счёт вариабельности внеклеточного домена, который может содержать:
- Ig-подобные последовательности;
- Богатые цистеином домены фибронектина III;
- Домены, богатые лейцином;
- EGF-подобные домены (подобные эпидермальному фактору роста).
Передача сигнала рецепторными тирозинкиназами осуществляется по фосфоинозитидному (за счёт активации фосфолипазы Сγ) и MAP-киназному каскадам. Общий механизм передачи сигнала на эти пути заключается в связывании адапторных белков, которые после фосфорилирования тирозинкиназным доменом рецептора активируют сигнальные каскады (рис. 25). Особенностью таких белков является наличие SH2 и SH3 доменов22, позволяющих взаимодействовать с фосфорилированными остатками тирозина. Рецепторы семейства ErbB также способны запускать STAT-путь, связывая цитоплазматические тирозинкиназы класса Janus и белок Src.
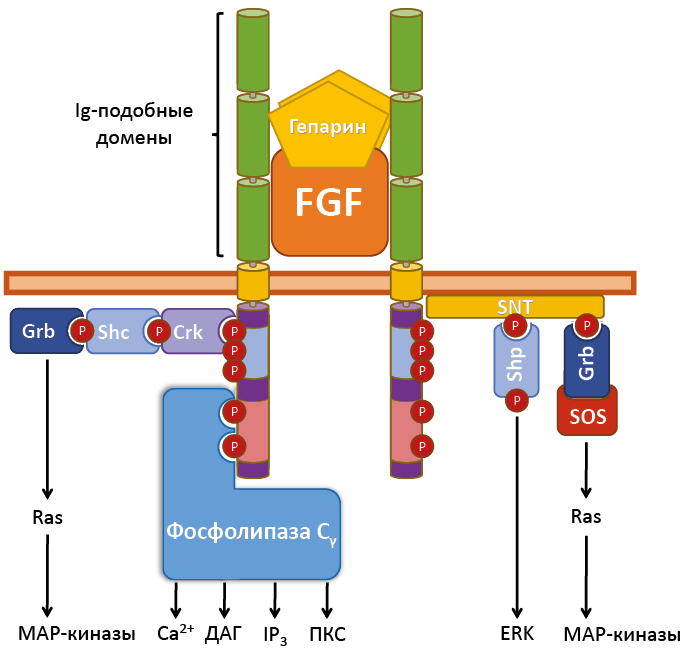
Рис. 25. Пути передачи сигнала с рецепторной тирозинкиназы на примере рецептора FGF
Фосфоинозитидный путь
Фосфоинозитидный путь стимулируется тирозинкиназными рецепторами на нескольких этапах. Фосфорилированные остатки тирозина в молекуле рецептора прямо активируют фосфодипазу Сγ. Помимо этого через адапторный белок IRS123 стимулируется PI3K, обеспечивающая образование фосфатидилинозитолтрифосфата из фосфатидилинозитол-4, 5-бифосфата (см. рис. 21).
МАР-киназный путь
После фосфорилирования рецептора на появившиеся фосфатные группы садятся адапторные белки (Crk, SNT24), которые после модификации тирозинкиназным доменом рецептора прямо или через Shc25 белок активируют Grb. Grb в присутствии фактора SOS заменяет ГДФ на ГТФ в Ras (малая ГТФаза), позволяя ему активировать МАР-киназный путь (см. рис. 22). Примечательно, что для связывания каждого следующего адапторного белка, предыдущий должен быть фосфорилирован тирозинкиназным доменом рецепторной молекулы. Также предполагают, что рецептор FGF способен активировать ERK (один из эффекторных белков МАР-киназного пути, отвечающий за выживание клетки) через адаптерный белок Shp (рис. 25).
Рецепторные серинтреонинкиназы
Рецепторные серинтреонинкиназы – трансмембранные белки с ферментативной активностью, связывающие димерные лиганды (TGFβ, активины, ингибины, АМГ26, белки морфогенеза кости, миостатин) и состоящие из рецепторов двух типов: пары рецепторов с конститутивной активностью (рецепторы II типа) и пары рецепторов с индуцибельной активностью, активируемых фосфорилированием (рецепторы I типа). После связывания димера гормона парой рецепторов II типа они фосфорилируют пару рецепторов I типа, активируя их каталитическую активность.
Рецепторные серинтреонинкиназы преимущественно проводят сигнал по Smad и TAK путям (рис. 26).
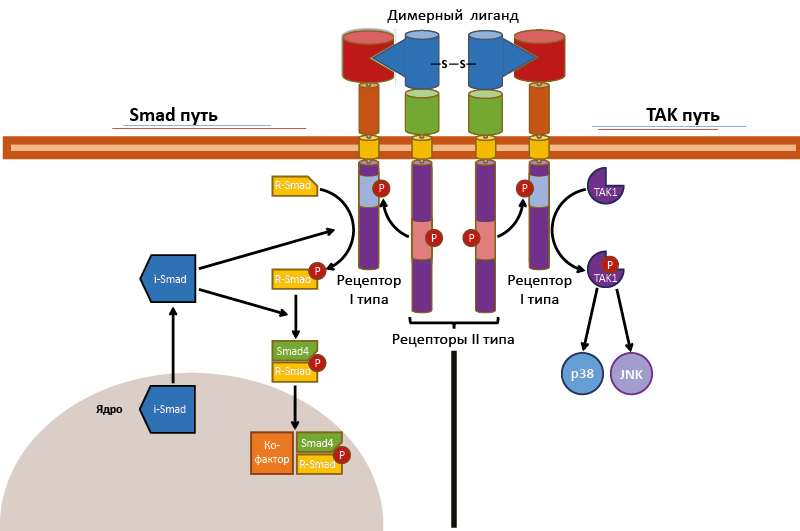
Рис. 26. Пути передачи сигнала с рецепторной серинтреонинкиназы
Smad-путь
После взаимодействия с димером сигнальной молекулы рецепторы II типа активируют рецепторы I типа, позволяя тем связать и активировать фосфорилированием R-Smad (регуляторный Smad27). Фосфорилированный R-Smad, объединяясь со Smad4, проникает в ядро, где в комплексе с кофакторами воздействует на гены-мишени (в т.ч. гены-активаторы МАР-киназного пути). Для предотвращения гиперактивности Smad-пути в клетке постоянно присутствует белок ингибитор – i-Smad, блокирующий фосфорилирование R-Smad и его последующее объединение со Smad4.
TAK путь
Активированный рецептор фосфорилирует ТАК1-киназу (также активируется через рецепторы с доменами смерти), которая активирует JNK-киназу (входит в МАР-каскад) и белок p38, которые отвечают за выживание/гибель клетки.
Рецепторные гуанилатциклазы
Рецепторные гуанилатциклазы – трансмембранные белки, способные индуцировать синтез цГМФ, связывающие натрийуретические пептиды, гуанилины и термостабильный бактериальный энтеротоксин. Отличительной чертой рецепторов являются система из 3 петель во внеклеточном домене, образованных дисульфидными связями, и внутриклеточный домен, содержащий примембранный киназа-гомологичный домен и С-концевой гуанилатциклазный домен. Рецепторы с гуанилатциклазной активностью классифицируются на основании входящего в их состав гуанилатциклазного домена (NPR-А, NPR-В, NPR-С). Причём рецептор NPR-С обладает коротким внутриклеточным доменом и существует для связывания избытка сигнального соединения.
Механизм работы рецепторных гуанилатциклаз заключается в связывании киназогомологичными участками молекул АТФ, что позволяет гуанилатциклазным доменам сблизиться и начать выполнять свою функцию. Однако синтез цГМФ прекращается, как только киназогомологичные домены теряют эту способность.
8 Т. н. «cross-talking».
9 Способностью гидролизовать ГТФ до ГДФ.
10 G-белки входят в надсемейство гуанозиннуклеотидсвязывающих белков, к кторому также относятся малые ГТФазы (напр., Ras-белки), контролирующие форму, деление и дифференцировку клеток.
11 В физиологических условиях диссоциации β- и γ-субъединиц не происходит.
12 Потенциалзависимые каналы.
13 Циклический Аденозинмонофосфат.
14 В литературе и далее в книге обозначается как ПКА.
15 Фосфолипаза Сβ активируется βγ-субъединицами G-белков, фосфолипаза Сγ – вторичными мессенджерами тирозинкиназных рецепторов.
16 Кальмодулин – Ca2+-связывающий белок, активирующийся после взаимодействия с ионами кальция.
17 К ним относятся Tyk2, JAK1, JAK2 (экспрессируются многими клетками) и JAK3 (экспрессируется Т-лимфоцитами).
18 Число молекул гормона много меньше числа рецепторов.
19 Именно за наличие в структуре двух киназных доменов эти соединения назвали Janus-киназами – в честь древнеримского бога двуликого Януса.
20 Англ. «Signal Transducers and Activators of Transcription».
21 Инсулиноподобный Фактор Роста.
22 SH – от «Src-homology», гомологичности белку Src, в котором впервые была обнаружена последовательность, связывающая фосфорилированные остатки тирозина.
23 Англ. InsulinReceptorSubstrate 1– субстрат рецептора инсулина 1.
24 Гомолог субстрата рецептора инсулина (IRS).
25 Цитоплазматическая тирозинкиназа.
26 АнтиМюллеров Гормон.
27 Англ. Smad – «Similar to Mothers Against Decapentaplegic».

