Общие замечания. Необходимо прежде всего напомнить, что геохимия серы характеризуется своеобразными особенностями, не свойственными многим химическим элементам. Помимо того что этот элемент способен давать электрически нейтральные 8-атомные молекулы S8 (см. о самородной сере), он образует различно заряженные положительные и отрицательные ионы. Как мы знаем, существуют отрицательно заряженные ионы S2– (аналог O2–) и [S2]2– как продукты электролитической диссоциации H2S. С этими анионами связано образование сульфидов. В окислительной обстановке сера может давать молекулярное соединение SO2 (сернистый газ), а в растворах — комплексные анионы [SO3]2– и в более окислительной среде [SO4]2–, в которых участвуют катионы S4+ и S6+ соответственно. Кристаллические образования, представляющие собой соединения металлов с этими анионами, называются сульфитами (всего два минеральных вида) и сульфатами (широко распространены в природе).
Таким образом, возникновение сернокислых солей металлов может происходить лишь в условиях повышенной концентрации кислорода или, как говорят, при повышенном парциальном давлении кислорода в окружающей среде и при относительно низких температурах. Такие условия в земной коре, как известно, создаются вблизи земной поверхности, где и встречается подавляющая масса этих соединений как эндогенного, так и экзогенного происхождения.
Хотя среди минералов этого класса мы наблюдаем большое разнообразие соединений, однако число устойчивых и широко распространенных в земной коре сульфатов сравнительно невелико.
Для такого крупного комплексного аниона, каким является [SO4]2–, стойкие кристаллические структуры возможны лишь при сочетании этого аниона с крупными двухвалентными катионами. Действительно, как мы увидим, наиболее устойчивы сульфаты Ba, Sr и Pb. Катионы с меньшими ионными радиусами входят в состав сульфатов лишь в гидратированном состоянии, т. е. будучи одеты в «рубашку» из молекул Н2О. При этом чем меньше катион, тем большее количество молекул Н2О способно с ним связаться. Для богатых водой сульфатов количество Н2О для одного и того же типа соединения может меняться в зависимости от давления паров Н2О во внешней среде. Так, например, для сульфата закиси железа существуют соли с семью, шестью, пятью и одной молекулами Н2О. Все они отличаются друг от друга особенностями кристаллических структур.
Одновалентные катионы щелочных металлов в состав простых сульфатов входят, естественно, в двойном количестве или в ассоциации с Н+. Они образуют слабые кристаллические структуры и легко растворяются в воде (так же как и сульфаты двухвалентных малых катионов).
Сульфаты трехвалентных металлов, главным образом Аl3+ и Fe3+, встречаются только в виде водных соединений.
Широко распространены двойные и более сложные соли одно-, двух- и трехвалентных металлов. Очень часто встречаются сульфаты с добавочными анионами, чаще всего [ОН]1–, иногда Сl1–, [СО3]2–, [РО4 ]3– и др. Чаще всего это имеет место, когда в состав соединения входят трехвалентные металлы или сильно поляризующие катионы Cu2+.
В заключение отметим некоторые общие для минералов этого класса физические свойства. Прежде всего обращает внимание, так же как и в карбонатах, отсутствие минералов с высокой твердостью. Среди сульфатов мы не знаем минералов с твердостью выше 3,5. Для богатых водой минеральных видов она снижается даже до 2. Из оптических свойств сульфатов по сравнению с ранее рассмотренными классами солей характерны гораздо более низкие величины двупреломления (Ng–Np). Встречаются даже оптически изотропные минералы. Объясняется это тем, что тетраэдрические группы SO4 по сравнению с плоскими группами СО3 и NO3 представляют собой изометрические структурные единицы. Весьма характерно, что в тех сульфатах, которые в качестве дополнительного аниона содержат ион [СО3]2–, двупреломление значительно повышается (примером может служить каледонит — Pb5Cu2[SO4]3[CO3][OH]6).
При описании мы будем объединять минералы в группы, как обычно, по химическому составу и типам кристаллических структур. Однако таких групп для безводных минералов оказывается очень немного. Остальные, довольно многочисленные и разнородные по составу минералы наиболее целесообразно сгруппировать по признакам валентности катионов, объединив вместе безводные и водные сульфаты.
Сюда относятся сернокислые соединения Sr, Ba и Рb, не встречающиеся в природе в виде водных сульфатов. Безводный сульфат кальция (ангидрит) хотя кристаллизуется в той же ромбической сингонии, что и указанные сульфаты, но существенно отличается от них как по кристаллической структуре, так и по формам кристаллов, что связано с меньшей величиной радиуса иона Ca2+. Так как ангидрит по условиям образования в природе чрезвычайно тесно связан с водным сульфатом кальция (гипсом), то подробную характеристику его мы дадим отдельно, вместе с гипсом.
БАРИТ — Ba[SO4]. От греч. барос — тяжесть. Большой удельный вес этого минерала легко ощутим в руке. Среди очень немногочисленных бариевых минералов барит является главным, а среди безводных сульфатов — наиболее распространенным после ангидрита.
Химический состав. BaO — 65,7 %, SO3 — 34,3 %. В виде изоморфных примесей устанавливаются Sr и Са. Разновидность с высоким содержанием стронция называется баритоцелестином. Изредка встречаются разности, богатые Рb и Ra (хокутолит). Из посторонних примесей устанавливаются иногда Fe2O3, глинистые, органические и прочие вещества.
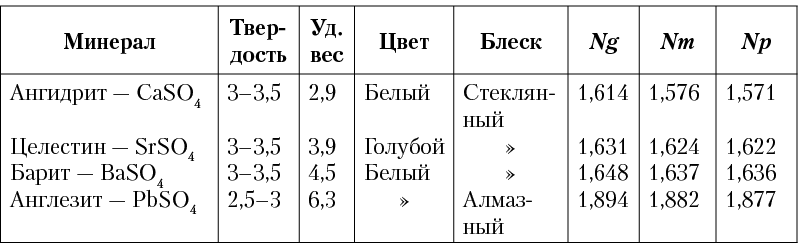
Сингония ромбическая, ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Pnma(D162h). а0 = 8,85, b0 = 5,43; с0 = 7,13. Кристаллическая структура. На рисунке 232 показана проекция элементарной ячейки структуры на плоскость (010). Ионы Ba2+ и S6+ располагаются на расстояниях 1/4 и 3/4 высоты b (см. цифры).
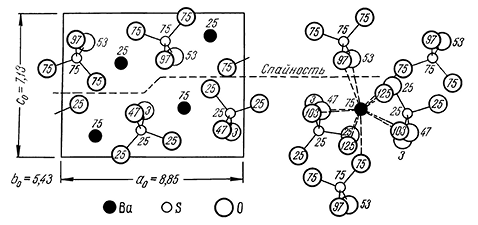
Рис. 232. Кристаллическая структура барита
в проекции на плоскость (010)
Группы SO4 представляют собой не совсем правильные тетраэдры и, как можно видеть по цифрам, ориентированы неодинаково. Каждый ион Ba окружен двенадцатью кислородными ионами, принадлежащими к семи различным группам SO4 (рис. 232).
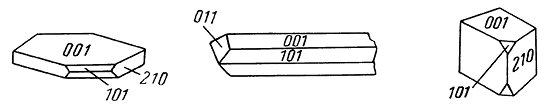
Рис. 233. Кристаллы барита
Облик кристаллов. Часто встречающиеся кристаллы барита обычно обладают таблитчатым обликом (рис. 233а) вследствие развития грани {001}. Реже распространены призматические, столбчатые (рис. 233б), обычно образованные господствующими гранями призм {011} или {101} в комбинации с {001}, и изометрические кристаллы (рис. 233в). Часто чрезвычайно богаты комбинациями. Двойники редки; обычно наблюдаются полисинтетические двойники, обусловливающие штриховатость на гранях. Характерны расщепленные кристаллы, иногда имеющие форму розы. Агрегаты чаще зернистые, реже плотные, скрытокристаллические, землистые. Наблюдаются также в виде сталактитов и других натечных форм с концентрически-зональным строением. Известны шаровидные и эллипсоидальные конкреции с радиально-лучистым строением. В пустотах часто удается наблюдать эффектные друзы небольших кристаллов.
Цвет. Встречаются бесцветные водяно-прозрачные кристаллы. Большей же частью барит посторонними примесями окрашен в белый или серый (микроскопическими включениями газов и жидкостей), красный (окисью железа), желтый или бурый (вероятно, гидроокислами железа), темно-серый и черный (битуминозными веществами), иногда голубоватый, зеленоватый и другие оттенки. Блеск стеклянный, на плоскостях спайности {010} перламутровый. Ng = 1,648, Nm = 1,637 и Np = 1,636.
Твердость 3–3,5. Хрупок. Спайность по {001} совершенная, по {210} средняя и по {010} несовершенная. Уд. вес 4,3–4,5.
Диагностические признаки. Среди наиболее широко распространенных сульфатов барит обладает самым большим удельным весом (лишь у англезита удкльный вес выше). Характерны совершенная спайность в одном направлении, нерастворимость в HCl даже при нагревании (отличие от всех карбонатов). От некоторых силикатов, похожих на него по спайности и другим признакам, отличается значительно меньшей твердостью. Без химических реакций трудно отличим от целестина.
П. п. тр. растрескивается, сплавляется лишь в тонких осколках по краям, причем пламя окрашивается в желто-зеленый цвет (характерно для бария). С содой на платиновой пластинке сплавляется в прозрачную массу, которая по охлаждении становится мутной (при сплавлении на угле эта масса расплывается и впитывается внутрь). В отличие от целестина сернистый барий, получающийся в восстановительном пламени п. п. тр., после смачивания HCl окрашивает пламя не в карминно-красный, а в желто-зеленый цвет. В концентрированной H2SO4 в порошкообразном состоянии медленно растворяется. От прибавления воды раствор мутнеет, т. е. снова выделяется Ba[SO4].
Происхождение и месторождения. Барит в природе образуется различными путями, но лишь в условиях повышенного парциального давления кислорода и при относительно низких температурах. Поэтому он, подобно всем другим безводным сульфатам, не встречается как магматогенный минерал в изверженных, а также в глубинных метаморфических породах.
В гидротермальных месторождениях он довольно обычен. В качестве спутника устанавливается во многих месторождениях сульфидных, марганцевых (с манганитом, браунитом), железных (с сидеритом, гематитом) и других руд. Известны золото-баритовые жилы. Встречаются почти чисто баритовые, барито-кальцитовые, барито-флюоритовые жилы с небольшой примесью кварца и редких сульфидов (галенита, сфалерита, халькопирита, иногда киновари и др.).
Барит в небольших количествах, главным образом в виде конкреций, распространен также в осадочных породах, но в иных условиях, чем ангидрит, гипс и целестин. Он, например, никогда не встречается в соляных месторождениях, крайне редок в известняках, но зато часто устанавливается в осадочных месторождениях марганца (в окисных и карбонатных рудах), железа, в глинистых, песчанистых и других осадках прибрежных зон морей. Объясняется это тем, что растворимые соли бария, приносимые с суши поверхностными водами, при первой же встрече с ионами [SO4]2– в морских водах образуют практически нерастворимый сульфат бария. Желваки барита обнаруживаются среди илов и в современных морях.
В зонах выветривания горных пород и рудных месторождений в районах с сухим климатом при внимательном изучении мелкие кристаллы барита часто столбчатого облика нередко устанавливаются в ассоциации с гипсом и гидроокислами железа.
Барит — химически устойчивый минерал, поэтому устанавливается в элювии, нередко в крупных обломках, а также 6 шлихах, получаемых при промывке россыпей. Однако как все минералы, обладающие хорошей спайностью и невысокой твердостью, по мере продвижения в россыпи быстро измельчается и постепенно исчезает.
Из многочисленных месторождений барита в России укажем лишь гидротермальные месторождения Белореченское (Краснодарский край) и Джаланкол (Карачаево-Черкесия).
В Западной Грузии имеется ряд жильных баритовых месторождений в Кутаисском, Болнисском и других районах, среди туфов и эффузивных пород (порфиритов). Сплошные баритовые массы симметрично полосчатого или колломорфного строения в виде примесей содержат: кальцит, в очень небольшом количестве кварц, изредка пирит, халькопирит и галенит. На полуострове Мангышлак (Западный Казахстан) в крупном по запасам месторождении Аурташ барит осадочного происхождения образует пласт в известняках мощностью до 0,5 м, распространенный на огромной площади на глубине до 3 м. Месторождения Каракалинского района в Туркмении (в горах Копетдага) также представлены целой серией жил в осадочных породах (песчаниках, глинистых сланцах и др.). В ряде жил (Арпаклен) барит находится в ассоциации с витеритом — Ва[СО3], который местами псевдоморфно развивается по бариту.
К числу крупнейших иностранных месторождений барита принадлежит Мегген в Вестфалии (Германия). Здесь огромной длины (до 7 км) платообразная залежь, местами сопровождающаяся залежью сульфидов, главным образом пирита, располагается на границе между средне- и верхнедевонскими осадками. Происхождение этой залежи точно не выяснено. Красивые кристаллы и розы барита известны в Стоунхэме в Колорадо (США).
Практическое значение. Барит находит широкое применение в различных отраслях промышленности.
1. В виде тонкоизмельченного порошка как утяжелитель вводится в состав глинистых растворов, используемых для цементации рыхлых пород при бурении нефтяных залежей с целью борьбы с газовыми выбросами и укрепления стенок скважин.
2. В химической промышленности является сырьем для изготовления различных солей и препаратов, используемых в пиротехнике, кожевенном деле (для удаления шерсти), сахарном производстве, при изготовлении фотобумаги, в керамике для производства эмалей, для выплавки специальных стекол, обладающих высоким коэффициентом преломления, в медицине и т. д.
3. В резиновой и бумажной промышленности применяется в качестве наполнителя и утяжелителя.
4. В лакокрасочной промышленности употребляется для производства высокосортных белил (в смеси с ZnO и ZnS), цветных красок и др.
5. Как главная составная часть штукатурки для стен рентгеновских лабораторий употребляется с целью защиты работников от вредного действия рентгеновских лучей.
6. Металлический барий применяется для изготовления некоторых радиоламп.
ЦЕЛЕСТИН — Sr[SO4]. От лат. celestis — небесный (первые найденные образцы этого минерала имели нежно-голубой оттенок). Относительно редко встречается, но среди минералов стронция является главным.
Химический состав. SrO — 56,4 %, SO3 — 43,6 %. Иногда содержит Са и Ba (нередко в значительных количествах).
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Pnma(D162h). а0 = 8,36; b0 = 5,36; с0 = 6,84.
Кристаллическая структура совершенно аналогична структуре барита. Облик кристаллов. Встречающиеся кристаллы очень похожи на кристаллы барита. Обычно имеют таблитчатый, столбчатый или призматический (рис. 234) облик, нередко проявляют блочность и склонны к расщеплению. Агрегаты чаще зернистые, реже шестоватые, жилковатые и скорлуповатые. Встречается в виде желваков и секреций, причем в пустотах наблюдаются друзы кристаллов.
Рис. 234. Кристалл целестина
Цвет целестина голубовато-белый или голубовато-серый, реже с красноватым или желтоватым оттенком. Иногда обнаруживаются бесцветные, водяно-прозрачные кристаллы. Блеск стеклянный, на плоскостях спайности — перламутровый отлив. Ng = 1,631, Nm = 1,624 и Np = 1,622. Твердость 3–3,5. Хрупок. Спайность по {001} совершенная, по {210} средняя и по {010} несовершенная. Уд. вес 3,9–4.
Диагностические признаки. В зернистых массах от карбонатов Mg, Са, Sr, Ba и др. отличим по поведению в кислотах (карбонаты при растворении с нагреванием выделяют СО2). По цвету иногда похож на ангидрит, но отличается направлениями спайности и большим удельным весом. От барита часто трудно отличим. Очень характерна реакция на стронций.
П. п. тр. плавится в белый шарик, окрашивая пламя в интенсивный карминно-красный цвет, особенно после смачивания НСl (реакция на стронций). На угле с содой дает серную печень. В крепкой H2SO4 растворяется. Раствор мутится при прибавлении воды.
Происхождение и месторождения. Целестин в более или менее значительных массах в виде желваков, гнезд, иногда сплошных залежей встречается в толщах осадочных пород (в доломитах, известняках, гипсоносных глинах, мергелях и др.). Его находки нередко бывают приурочены к определенным горизонтам среди этих пород.
Он был также установлен в морских организмах, в частности в скелетах одной группы радиолярий. Иногда он встречается в раковинах аммонитов и в других окаменелостях как результат позднейшего отложения в них.
Известны, правда, очень редкие, но типичные гидротермальные жилы целестина, содержащие галенит, сфалерит и другие сульфиды. Наблюдался также в миндалинах изверженных пород.
Целестин довольно часто встречается в виде секреций в осадочных гипсоносных породах пермского возраста, распространенных в Архангельской области (долина р. Пинега), в Верхнем и Среднем Поволжье с самородной серой (Водинское), в Башкирии, Оренбургской области и др. Значительное количество пунктов нахождения известно также в Закаспии (в Туркмении (Бейнеу-Кыр, Арик), на п-ове Мангышлак (Унгозя)) и других районах Средней Азии.
Из иностранных месторождений отметим крупные месторождения целестина в районах Бристоля (Англия), Вестфалии и Вальдека (Германия).
Практическое значение. Целестин является главным источником солей стронция, употребляемых в пиротехнике (для получения яркого карминно-красного пламени) и в химической промышленности: сахарной (в виде окиси стронция для удаления сахара из меломассы), стекольной и керамической (для изготовления иризирующих стекол, особых глазурованных кирпичей) и пр. В последнее время начали применять стронций в виде металла при производстве специальных сплавов, например в качестве присадки к меди с целью повышения ее прочности и однородности (электропроводность при этом не снижается).
АНГЛЕЗИТ — Pb[SO4]. Впервые был установлен на о. Англези (Уэльс), откуда и произошло его название.
Химический состав. PbO — 73,6 % (Pb — 68,3 %), SO3 — 26,4 %. От примесей обычно свободен. Известна разность, богатая BaO (8,45 %).
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Pnma (D162h). а0 = 8,45; b0 = 5,38; с0 = 6,93. Кристаллическая структура совершенно аналогична структуре барита. Облик кристаллов. Кристаллы англезита часто весьма богаты комбинациями граней. Обычно имеют таблитчатый облик (рис. 235), реже короткостолбчатый или пирамидальный. Крупные кристаллы вообще редки. Агрегаты. Чаще встречается в виде кристаллических корочек на галените, друз мелких кристаллов, в плотных зернистых или землистых массах.
Рис. 235. Кристалл англезита: s {232}, m {210}, z {211}
Цвет. Бесцветен и часто водяно-прозрачен. Нередко окрашен в серый, желтоватый или бурый цвет (гидроокислами железа). Наблюдающийся иногда черный цвет обусловлен микроскопическими включениями неразложившегося галенита. Блеск алмазный. Ng = 1,894, Nm = 1,882 и Np = 1,877.
Твердость 2,5–3. Весьма хрупок. Спайность по {001} средняя, по {210} и {010} несовершенная. Уд. вес 6,1–6,4.
Диагностические признаки. Для англезита характерны высокий удельный вес, алмазный блеск, в окисленных рудах тесная ассоциация с галенитом и поведение перед паяльной трубкой.
П. п. тр. растрескивается и легко плавится. На угле с содой дает серную печень и затем в восстановительном пламени — королек свинца. В концентрированной H2SO4 растворяется лишь при нагревании. Однако полностью растворяется в КОН (отличие от целестина и барита).
Происхождение и месторождения. Как труднорастворимый продукт окисления галенита и других сернистых соединений свинца англезит образуется главным образом в зонах окисления свинцово-цинковых сульфидных месторождений, очень часто в ассоциации с гораздо более распространенным церусситом Pb[CO3].
Как показывает изучение под микроскопом, англезит является первым кислородным соединением свинца, которое возникает при окислении галенита по периферии и вдоль направлений спайности по реакции: PbS + O4 = PbSO4. Однако англезит под влиянием углекислоты в свою очередь легко переходит в карбонат свинца — церуссит (Pb[CO3]). Оба эти минерала в силу низкой их растворимости в воде обычно образуют вокруг кусков сплошного галенита белую корку, предохраняющую от дальнейшего окисления центральные участки галенита1. Этим объясняется тот факт, что при разбивании округлых белых желваков, казалось бы, нацело окисленных свинцовых руд в центральных частях, нередко обнаруживается сплошной галенит.
Характерно также, что общее содержание свинца в зонах окисления всегда выше, чем в первичных сульфидных рудах. Это обусловлено тем, что постоянный спутник галенита — сфалерит — и сульфиды меди при окислении переходят в легкорастворимые сульфаты и выносятся, за счет чего и происходит обогащение окисленных руд свинцом.
Англезит может образоваться и гидротермальным путем, правда в особых условиях. В виде прекрасно образованных, часто довольно крупных кристаллов он встречается в таких свинцово-цинковых месторождениях, отложение руд которых, судя по парагенезису минералов и формам минеральных агрегатов, могло происходить вблизи дневной поверхности (вероятно, при смешении с вадозовыми насыщенными свободным кислородом водами). Таковы, например, месторождения Райбл и Бляйберг в Каринтии (Восточные Альпы), где кристаллы англезита в пустотах встречаются наряду с нетронутыми окислением сульфидами Fe, Zn и Pb.
В тех или иных количествах англезит всегда удается установить в зонах окисления всех галенитсодержащих сульфидных месторождений. Останавливаться на перечислении их не будем. Укажем лишь, что в нашей литературе описаны хорошо образованные кристаллы из месторождений: Березовского золоторудного (Урал), ряда алтайских, нерчинских (Восточное Забайкалье) и др.
Практическое значение. При разработке зон окисления свинцовых месторождений англезит вместе с другими кислородными соединениями свинца идет в плавку.
Обобщение. Подведем итог главнейшим отличительным свойствам минералов группы барита, включая сюда и ангидрит. Как можно видеть из данных таблицы 12, сульфат свинца сильно отличается по своим свойствам от других аналогичных сульфатов металлов. Он существенно отличен и по условиям образования в природе. Сульфаты Са, Sr и Ba друг от друга заметно отличаются по удельному весу и коэффициентам преломления.
Таблица 12. Главные свойства минералов группы барита
Оба эти минерала по физическим и химическим свойствам стоят особняком среди безводных и водных сульфатов, но тесно связаны друг с другом по условиям нахождения и образования. Поэтому мы опишем их вместе. Легко получающийся искусственным путем так называемый полугидрат кальция (бассанит) в природных условиях также установлен, однако является редким минералом.
АНГИДРИТ — Ca[SO4]. Название минерала (от греч. «безводный») указывает на отсутствие в нем воды в отличие от гипса.
Химический состав. CaO — 41,2 %, SO3 — 58,8 %. В виде примеси довольно часто содержит стронций.
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Стст(D172h). a0 = 6,94; b0 = 6,97; с0 = 6,20. Кристаллическая структура ангидрита изображена на рисунках 236 и 237, а модель структуры — на рисунке 238. Ионы S6+ располагаются в центрах тетраэдрических групп О2–, а каждый ион Са2+ находится в восьмерном окружении ионов кислорода.
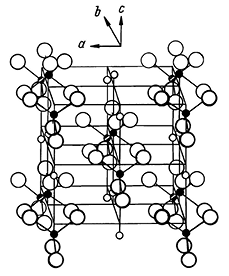
Рис. 236. Кристаллическая структура ангидрита
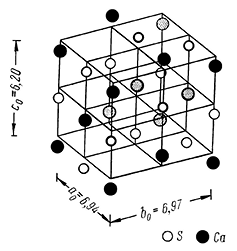
Рис. 237. Положение в кристаллической структуре ангидрита ионов
серы и кальция. Залитые кружочки ионов кальция
соответствуют ионам кальция, видным на рисунке 238
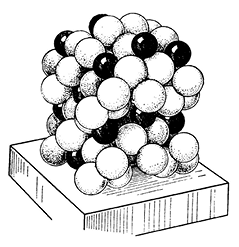
Рис. 238. Модель кристаллической структуры ангидрита
в ориентировке, показанной на рисунке 237
(ср. положение катионов кальция)
Характерно, что размеры а и b в элементарной ячейке почти одинаковы. Однако структура не может считаться псевдотетрагональной по оси с, так как расположение ионов на плоскости (010) — слева на рисунке 237 — и на плоскости (100) — ближе к наблюдателю — неодинаково. Грань (010) центрирована, в то время как на грани (100) ионы Са2+ и [SO4]2– не образуют горизонтальных рядов. Облик кристаллов толстотаблитчатый или призматический (рис. 239). Хорошо образованные кристаллы редки. Агрегаты. Обычно наблюдаются в сплошных зернистых массах, иногда в шестоватых агрегатах.
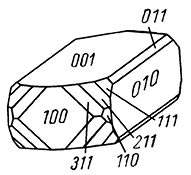
Рис. 239. Кристалл ангидрита
Цвет ангидрита белый, часто с голубым, фиолетовым, сероватым, иногда красноватым оттенком. Встречаются бесцветные прозрачные кристаллы. Блеск стеклянный, на плоскостях спайности (010) — перламутровый отлив. Особенно он проявляется при нагревании образцов. Ng = 1,614, Nm = 1,576 и Np = 1,571.
Твердость 3–3,5. Спайность по (010) совершенная, по {100} и {001} средняя. По этим трем взаимно перпендикулярным направлениям из кристаллов довольно легко получаются кубические выколки. Уд. вес 2,8–3 (для прозрачных разностей 2,96). Прочие свойства. В присутствии воды при атмосферном давлении постепенно переходит в гипс, сильно увеличиваясь в объеме (до 30 %). С увеличением внешнего давления этот переход затрудняется.
Диагностические признаки. От других сульфатов рассматриваемой группы ангидрит отличается наименьшим удельным весом и направлениями плоскостей спайности, а также оптическими свойствами (особенно по двупреломлению). От мраморизованных масс карбонатов (кальцита, доломита магнезита) отличается тем, что не выделяет CO2 при действии кислот. От гипса отличается по твердости (не царапается ногтем).
П. п. тр. плавится в белую эмаль, окрашивая пламя в красновато-желтый цвет. С содой не плавится и не впитывается углем (отличие от барита), однако разлагается и дает серную печень, чернящую серебряную пластинку. В порошкообразном состоянии растворим в H2SO4. При этом в отличие от безводных сульфатов Ba, Sr и Pb раствор от умеренного прибавления воды не мутится. В HCl растворим слабо.
Происхождение и месторождения. Огромные массы ангидрита встречаются в осадочных толщах горных пород. Как продукт химических осадков (в лагунных и отмирающих морских бассейнах) ангидрит почти постоянно сопровождается гипсом. В гипс он сравнительно легко переходит при выходе ангидритовых пластов на поверхность. Установлено, что этот переход, по данным многочисленных буровых скважин и горных выработок, имеет место до глубины 100–150 м от поверхности (ниже следуют ангидритовые массы). Очевидно, на значительных глубинах давление вышележащих горных пород настолько велико, что не может происходить увеличение объема горной массы, сопровождающее превращение ангидрита в водный сульфат — гипс.
Очень часто ангидрит встречается в соляных месторождениях как в виде отдельных кристаллов, так и в виде пластов и пропластков, иногда необычайно тонких (толщиной в бумажный лист), переслаивающихся с галитом, сильвином, карналлитом и др.
Сравнительно редко он наблюдается в некоторых жильных гидротермальных и изредка в контактово-метасоматических месторождениях. Следует также указать на находки ангидрита в пустотах среди лав в районах вулканической деятельности.
Весьма вероятно, что мощные ангидритовые толщи, устанавливаемые в гипсоносных районах, произошли путем обезвоживания под большим давлением вышележащих пород первоначально отложившихся в соленосных бассейнах толщ гипса. Однако в более глубинных метаморфических породах ангидрит, как и другие сульфаты, отсутствует вообще.
Постмагматический ангидрит, с цеолитами, пренитом, апофиллитом и гипсом, встречается в гидротермально минерализованных полостях габбро-долеритов Талнаха (Норильская группа месторождений, Красноярский край). Крупные залежи ангидрита на глубине распространены в гипсоносных толщах пермского возраста вдоль всего Западного Приуралья, в Архангельской, Вологодской, Самарской, Нижегородской областях и других местах.
Практическое значение. Ангидрит, так же как и гипс, используется главным образом в производстве вяжущих веществ (цементов). Плотные тонкокристаллические разности, кроме того, употребляются для всевозможных поделок.
ГИПС — Ca[SO4] . 2H2O. Гипс — старое греческое название минерала.
Химический состав. CaO — 32,5 %, SO3 — 46,6 %, Н2О — 20,9 %. Обычно чист. В виде механических примесей устанавливаются: глинистое вещество, органические вещества (пахучий гипс), включения песчинок, иногда сульфидов и др.
Сингония моноклинная; призматический в. с. L2PC. Пр. гр. А2/п (C 62h). а0 = 10,47; b0 = 15,12; с0 = 6,28; β = 98°58′. Кристаллическая структура. Согласно данным рентгенометрии, отчетливо выступает слоистая структура этого минерала. Два листа анионных групп [SO4]2–, тесно связанные с ионами Са2+ (рис. 240), слагают двойные слои, ориентированные вдоль плоскости (010). На рисунке эти слои располагаются перпендикулярно плоскости чертежа и следуют в вертикальном направлении (пограничные линии показаны пунктиром). Молекулы Н2О занимают места между указанными двойными слоями. Этим легко объясняется весьма совершенная спайность, столь характерная для гипса. Каждый ион кальция окружен шестью кислородными ионами, принадлежащими к группам SO4, и двумя молекулами воды. Каждая молекула воды связывает ион Са с одним ионом кислорода в том же двойном слое и с другим ионом кислорода в соседнем слое (см. рис. 240).
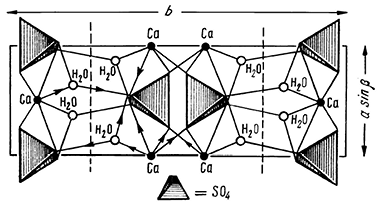
Рис. 240. Проекция кристаллической структуры гипса
на плоскость, перпендикулярную оси с.
Пунктирные линии — направления спайности
Облик кристаллов. Кристаллы благодаря преимущественному развитию граней {010} имеют таблитчатый (рис. 241), редко столбчатый или призматический облик. Из призм наиболее часто встречаются {110} и {111}, иногда {120} и др. Грани {110} и {010} часто обладают вертикальной штриховкой. Двойники срастания часты и бывают трех типов: 1) галльские по (100), 2) парижские по (101) и 3) по (209). Отличить их друг от друга не всегда легко. Два первые типа напоминают ласточкин хвост (рис. 242). Галльские двойники (рис. 243) характеризуются тем, что ребра призмы m{110} располагаются параллельно двойниковой плоскости, а ребра призмы l{111} образуют входящий угол, в то время как в парижских двойниках ребра призмы l{111} параллельны двойниковому шву (рис. 244).
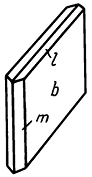
Рис. 241. Пластинчатый кристалл гипса: b {010}, l {111}, т {110}

Рис. 242. «Ласточкин хвост» — прозрачный двойник гипса
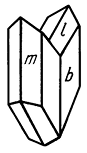
Рис. 243. Гальский двойник срастания
по (100): m {110}, l {111}, b {010}
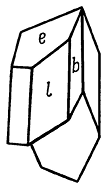
Рис. 244. Парижский двойник срастания
по (101): l {111}, b {010}, e {103}
Агрегаты. В пустотах встречается в виде друз кристаллов. Обычны плотные тонкокристаллические агрегаты. В трещинах иногда наблюдаются асбестовидные параллельно-волокнистые массы гипса с шелковистым отливом и расположением волокон перпендикулярно к стенкам трещин. На Урале такой гипс называют селенитом. В тех случаях когда гипс кристаллизуется в рыхлых песчаных массах, он в своей среде содержит множество захваченных песчинок, отчетливо заметных на плоскостях спайности крупных кристаллических индивидов (так называемый репетекский гипс).
Цвет гипса белый. Отдельные кристаллы часто водяно-прозрачны и бесцветны. Бывает окрашен также в серый, медово-желтый, красный, бурый и черный цвета (в зависимости от цвета захваченных при кристаллизации примесей). Блеск стеклянный, на плоскостях спайности — перламутровый отлив. Ng = 1,530, Nm = 1,528 и Np = 1,520.
Твердость 2 (царапается ногтем). Весьма хрупок. Спайность по {010} весьма совершенная, по {100} и {011} ясная; спайные выколки имеют ромбическую форму с углами 66 и 114°. Уд. вес 2,3. Прочие свойства. Обладает заметной растворимостью в воде. Замечательной особенностью гипса является то обстоятельство, что растворимость его при повышении температуры достигает максимума при 37–38 °С, а затем довольно быстро падает (рис. 245). Наибольшее снижение растворимости устанавливается при температурах свыше 107 °С вследствие образования полугидрата — Ca[SO4] . 1/2 H2O.
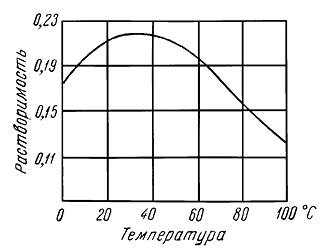
Рис. 245. Зависимость растворимости гипса от температуры
При нагревании в условиях атмосферного внешнего давления, как показывают термограммы, гипс начинает терять воду при 80–90 °С и при температурах 120–140 °С полностью переходит в полугидрат, так называемый модельный, или штукатурный, гипс (алебастр). Этот полугидрат, замешанный с водой в полужидкое тесто, вскоре твердеет, расширяясь и выделяя тепло.
Диагностические признаки. Для кристаллического гипса характерны весьма совершенная спайность по {010} и низкая твердость (царапается ногтем). Плотные мраморовидные агрегаты и волокнистые массы узнаются также по низкой твердости и отсутствию выделения пузырьков CO2 при смачивании HCl.
П. п. тр. теряет воду, расщепляется и сплавляется в белую эмаль. На угле в восстановительном пламени дает CaS. В воде, подкисленной H2SO4, растворяется гораздо лучше, чем в чистой. Однако при концентрации H2SO4 свыше 75 г/л растворимость резко падает. В HCl растворим очень мало.
Происхождение и месторождения. Гипс в природных условиях образуется различными путями.
1. В значительных массах он отлагается осадочным путем в озерных и морских соленосных отмирающих бассейнах. При этом гипс наряду с NaCl может выделяться лишь в начальных стадиях испарения, когда концентрация других растворенных солей еще невысока. При достижении некоторого определенного значения концентрации солей, в частности NaCl и особенно MgCl2, вместо гипса будут кристаллизоваться ангидрит и затем уже другие, более растворимые соли. Следовательно, гипс в этих бассейнах должен принадлежать к числу более ранних химических осадков. И действительно, во многих соляных месторождениях пласты гипса (а также ангидрита), переслаиваясь с пластами каменной соли, располагаются в нижних частях залежей и в ряде случаев подстилаются лишь химически осажденными известняками.
2. Весьма значительные массы гипса возникают в результате гидратации ангидрита в осадочных отложениях под влиянием действия поверхностных вод в условиях пониженного внешнего давления (в среднем до глубины 100–150 м) по реакции:
CaSO4 + 2H2O = CaSO4 . 2H2O.
При этом происходит сильное увеличение объема (до 30 %) и в связи с этим многочисленные и сложные местные нарушения в условиях залегания гипсоносных толщ. Таким путем возникло большинство крупных месторождений гипса на земном шаре. В пустотах среди сплошных гипсовых масс иногда встречаются гнезда крупнокристаллических, нередко прозрачных кристаллов («шпатоватый гипс»).
3. В полупустынных и пустынных местностях гипс очень часто встречается в виде прожилков и желваков в коре выветривания самых различных по составу горных пород. Нередко образуется также на известняках под действием на них вод, обогащенных серной кислотой или растворенными сульфатами. Встречается, наконец, в зонах окисления сульфидных месторождений, но не в столь больших количествах, как этого можно было бы ожидать. Дело в том, что в подавляющем большинстве случаев в сульфидных рудах в том или ином количестве присутствуют пирит или пирротин, окисление которых (особенно первого) существенно увеличивает содержание серной кислоты в поверхностных водах. Подкисленные же серной кислотой воды значительно увеличивают растворимость гипса. Поэтому в ряде месторождений гипс более обычен в верхних частях зон первичных руд, где он в трещинах встречается вместе с другими сульфатами.
4. Сравнительно редко гипс наблюдается как типичный гидротермальный минерал в сульфидных месторождениях, образовавшихся в условиях низких давлений и температур. В этих месторождениях он иногда наблюдается в виде крупных кристаллов в пустотах и содержит включения халькопирита, пирита, сфалерита и других минералов.
Многократно устанавливались псевдоморфозы по гипсу кальцита, арагонита, малахита, кварца и других минералов, так же как и псевдоморфозы гипса по другим минералам.
Редким примером эндогенного (гидротермального) гипса могут служить прозрачные монокристальные массы, наросшие поверх щеток кристаллов цеолитов в полостях габброидов Талнахского месторождения (Норильская группа, Красноярский край).
Осадочные месторождения гипса распространены по всему земному шару и приурочены к отложениям различного возраста. На перечислении их останавливаться не будем. Укажем лишь, что на территории России мощные гипсоносные толщи пермского возраста распространены в Западное Приуралье, в Башкирии и Татарии, Архангельской, Вологодской, Нижегородской и других областях. Многочисленные месторождения позднеюрского возраста устанавливаются на Северном Кавказе, в Дагестане, Туркмении, Таджикистане, Узбекистане и др.
Практическое значение гипса велико, особенно в строительном деле.
1. Модельный, или лепной (полуобожженный), гипс применяется для получения отливок, гипсовых слепков, лепных украшений карнизов, штукатурки потолков и стен, в хирургии, бумажном производстве при выделке плотных белых сортов бумаги и пр. В строительном деле он употребляется как цемент при кирпичной и каменной кладке, для набивных полов, изготовления кирпичей, плит для подоконников, лестниц и т. п.
2. Сырой (природный) гипс находит применение главным образом в цементной промышленности в качестве добавки к портланд-цементу, как материал для ваяния статуй, различных поделок (особенно уральский селенит), в производстве красок, эмали, глазури, при металлургической переработке окисленных никелевых руд и др.
Здесь мы опишем, кроме безводного и водного сульфатов натрия (тенардита и мирабилита), также двойные соли с щелочноземельными металлами (полигалит и каинит).
ТЕНАРДИТ — Na2[SO4]. Химический состав. Na2O — 43,7 %, SO3 — 56,3 %. Иногда содержит в небольших количествах К2О, а в виде механических примесей — CaSO4.
Сингония ромбическая, ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Fddd(D242h). а0 = 9,75; b0 = 12,29; с0 = 5,85. Кристаллы имеют дипирамидальный облик (рис. 246), иногда таблитчатый благодаря развитию пинакоида {001} и призмы {101}. Двойники часты (рис. 246). Нередко наблюдаются в друзах или зернистых агрегатах.
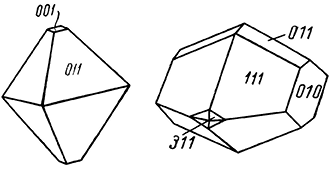
Рис. 246. Дипирамидальный кристалл и двойник тенардита
Цвет. Бесцветный, прозрачный, иногда с красноватым оттенком. Блеск стеклянный. Ng = 1,485, Nm = 1,474 и Np = 1,464.
Твердость 2–3. Хрупок. Спайность по {010} совершенная, по {101} ясная и по {100} несовершенная. Уд. вес 2,66. Прочие свойства. Растворим в воде. Из пересыщенных растворов (в чистой воде) выпадает лишь при температурах выше 32,5 °С. Ниже этой температуры кристаллизуется мирабилит Na2SO4 . 10Н2О. Поэтому при комнатной температуре в условиях влажного воздуха тенардит подвергается гидратации и покрывается белой коркой водного сульфата натрия. С течением времени распадается в порошок.
Диагностические признаки. В кристаллах от других ассоциирующих с ним минералов (мирабилита, астраханита и др.) отличается по сингонии, а в зернистых агрегатах — по химическим реакциям.
П. п. тр. плавится и окрашивает пламя в интенсивный желтый цвет (реакция на Na). В воде легко растворяется. Вкус солоноватый.
Происхождение и месторождения. Образуется в некоторых усыхающих соленосных озерах вместе с мирабилитом, непосредственно выпадая в виде кристаллов из пересыщенной ионами Na и SO4 рапы. Возникает также путем дегидратации мирабилита, например в верхнем слое выброса его на берег во время штормов (в Каспийском море) или в ископаемых (т. е. несовременного образования) залежах сульфата натрия, а также в пустынных жарких местностях.
В России отмечается в осадках озера Эльтон (Нижнее Поволжье).
Как продукт деятельности фумарол встречается в некоторых вулканических районах (Везувий).
Крупное месторождение Кюрен-Даг ископаемого тенардита в осадках плиоценового возраста находится в Закаспии около ст. Азун-Су. Вместе с мирабилитом залегает в виде линз в песчано-глинистых отложениях. Известен также в современных озерах Кулундинской степи (Северо-Восточный Казахстан), к северу от Каспийского моря (Шашинское оз. и др.), в Шемахинском районе (Закавказье) и пр.
Практическое значение. Добывается вместе с мирабилитом и употребляется в стекольном, содовом и других производствах.
МИРАБИЛИТ — Na2[SO4] . 10H2O. Старинное название: sal mirabile Glauberi (удивительная соль Глаубера). Синоним: глауберова соль.
Химический состав. Na2O — 19,3 %, SO3 — 24,8 %. H2O — 55,9 %. С обилием кристаллизационной воды связаны многие свойства минерала.
Сингония моноклинная; призматический в. с. L2PC. Кристаллы обладают короткостолбчатым обликом по оси b или по оси с (рис. 247). Обычно встречается в сплошных зернистых агрегатах, а также в виде корок и налетов.
Рис. 247. Кристалл мирабилита
Цвет. Бесцветный и прозрачный, но иногда мутный, белый с желтоватым, синеватым или зеленоватым оттенком. Блеск стеклянный. Показатели преломления очень низкие: Ng = 1,398, Nm = 1,396 и Np = 1,394.
Твердость 1,5–2. Весьма хрупок. Спайность по {100} совершенная. Излом по другим направлениям раковистый. Уд. вес 1,48. Прочие свойства. В сухом воздухе постепенно теряет всю воду и, превращаясь в тенардит, становится белым порошковатым веществом. Обладает охлаждающим слабым горько-соленым вкусом.
Диагностические признаки. Как минерал, богатый молекулами Н2О, связанными в кристаллической структуре, из всех легкорастворимых водных сульфатов и хлоридов обладает наименьшим удельным весом и наиболее низкими показателями преломления. От соды (Na2CO3 . 10H2O) отличается тем, что при действии HCl не выделяет углекислоты. При нагревании выше 32 °С плавится, вернее, растворяется в собственной кристаллизационной воде.
Происхождение и месторождения. В больших массах образуется в насыщенных натрием и сульфатными анионами соляных озерах при испарении воды при температурах ниже 33 °С (если в растворе отсутствуют другие растворимые соли) либо при понижении температуры в осеннее и зимнее время. Если испарение воды для раствора того же состава будет происходить при более высоких температурах, чем 33 °С, то будет кристаллизоваться безводный сульфат натрия — тенардит. В присутствии растворенного хлористого натрия, что почти всегда имеет место в соляных озерах, тенардит в процессе испарения воды выпадает при более низких температурах.
Многочисленные мелкие высохшие озера Северного Прикаспия, Северо-Восточного Казахстана (Кулундинская степь), Северного Кавказа (к югу от Ставрополя), Закавказья, Крыма и др. содержат большие массы мирабилита с тенардитом, с пластами галита, иногда гипса и др. В заливе Кара-Богаз-гол (Каспийское море) в зимние месяцы, когда температура воды опускается ниже 6 °С, на дно в огромных количествах оседает мирабилит, который штормами частью выбрасывается на берег, образуя белые валы соли. В летнее время мирабилит в самом заливе вновь переходит в раствор, а выброшенный на берег в верхних слоях обезвоживается, превращаясь в тенардит.
Из иностранных месторождений, содержащих мирабилит, упомянем о Большом Соленом озере (Солт-Лэйк) в штате Юта (США), озерах Мексики и Аргентины.
Практическое значение. Используется главным образом для приготовления соды по способу Леблана (сплавлением с известняком и углем), а также в стекольной, красочной и других отраслях промышленности. В медицине употребляется как слабительное средство.
ПОЛИГАЛИТ — K2MgCa2[SO4]4 . 2H2O. Сингония триклинная, пинакоидальный в. с. С. Кристаллы редки, обычно таблитчатой формы. Наблюдается в плотных волокнистых, шестоватых агрегатах.
Цвет белый с сероватым или желтоватым оттенком, а также кирпично-красный. Блеск стеклянный. Ng = 1,567, Nm = 1,562 и Np = 1,548.
Твердость 2,5–3. Спайность по {101} совершенная. Уд. вес 2,72–2,78. П. п. тр. легко теряет воду и плавится в непрозрачный шарик. Вода выщелачивает соли К и Mg и оставляет осадок, отвечающий по составу гипсу.
Образуется из рассолов, богатых Mg, К и Са, в сравнительно широком диапазоне температур: 0–80 °С. В месторождениях в районе Штассфурта слагает особый «полигалитовый ярус», располагающийся между ангидритовым и кизеритовым. Иногда переслаивается тонкими слоями галита. Встречается также в соляных залежах в Ишле, Халльштадте (Австрия), в Техасе, Нью-Мексико (США) и в других местах.
Как калийная соль идет на производство искусственных удобрений.
КАИНИТ — KMg[SO4]Cl . 3H2O или MgSO4 . KCl . 3H2O. Сингония моноклинная, призматический в. с. L2PC. Пр. гр. C2/m (C32h). а0 = 19,76; b0 = 16,26; с0 = 9,57. Обычен в плотных зернистых массах. Редко встречающиеся кристаллы имеют таблитчатый или призматический облик.
Цвет желтовато- или серовато-белый, иногда красный. Блеск стеклянный. Ng = 1,516, Nт = 1,505 и Np = 1,494. Твердость 2. Спайность по {001} совершенная. Уд. вес 2,1.
П. п. тр. плавится. В воде легко растворяется. Вкус горько-соленый. Не гигроскопичен (отличие от карналлита).
Распространен в соляных месторождениях Штассфурта в ассоциации с шёнитом — K2Mg[SO4]2 . 6H2O, карналлитом, кизеритом, галитом и др. В значительных массах встречается у Калуша (Западная Украина).
Имеет практическое значение как сырье для получения искусственных удобрений и производства калийных солей.
4. Водные сульфаты двухвалентных металлов
Здесь мы рассмотрим некоторые, главным образом богатые Н2О, сульфаты магния, железа и меди.
ЭПСОМИТ — Mg[SO4] . 7Н2О. Название дано по минеральным источникам Эпсом в Англии. Синоним: горькая соль.
Химический состав. MgO — 16,3 %, SO3 — 32,5 %, Н2О — 51,2 %. Иногда в виде изоморфных примесей присутствуют Mn2+ и Fe3+. Установлены разновидности, довольно богатые двухвалентным железом (Fe-эпсомит), а также никелем (Ni-эпсомит).
Сингония ромбическая; ромбо-тетраэдрический в. с. 3L2. Пр. гр. Р212121 (D 42). a0 = 11,94; b0 = 12,13; с0 = 6,865. Искусственно может быть получена также малоустойчивая моноклинная модификация в виде псевдогексагональных табличек. Образующиеся из рассолов кристаллы имеют псевдотетрагональный призматический (рис. 248) или игольчатый облик. Встречается также в плотных натечных, иногда землистых агрегатах.
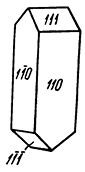
Рис. 248. Кристалл эпсомита
Цвет белый; иногда бесцветен и прозрачен. Блеск стеклянный. Ng = 1,461, Nm = l,455 и Np = 1,433.
Твердость 2–2,5. Весьма хрупок. Спайность по {010} весьма совершенная, по {101} ясная. Уд. вес 1,68. Прочие свойства. Вкус горький, солоноватый. В сухом воздухе постепенно теряет воду и мутнеет. Дегидратация происходит скачками: при температуре около 100 °С теряет пять молекул воды, шестая уходит при 132 °С и последняя — при 218– 238 °С. В сухом воздухе, теряя одну молекулу Н2О, переходит в шестиводный сульфат магния.
Диагностические признаки. По свойствам похож на многие другие водные сульфаты более сложного состава, от которых его можно отличить лишь химическим путем. Характерен горький солоноватый вкус.
При нагревании выделяет воду. При прокаливании дает неплавкую белую массу. Легко растворим в воде.
Происхождение и месторождения. Эпсомит образуется при усыхании рапы в богатых магнезией соляных озерах как один из первых по времени садки наиболее богатых водой сульфатов магния. По мере сгущения рапы семиводный сульфат магния вскоре становится неустойчивым, уступая место шестиводному сульфату магния — гексагидриту (Mg[SO4] · 6H2O).
Встречается в виде выцветов на поверхности горных пород, корок, волосистых или игольчатых кристаллов на стенках пещер в известковистых породах, старых выработок и прочих пустот вблизи поверхности, очевидно, как результат кристаллизации просачивающихся поверхностных магнезиально-сульфатных вод.
Наиболее часто эпсомит в виде кристаллических осадков образуется в магнезиально-сульфатных соляных озерах. Таковы, например, многие озера Нижневолжского края: Эльтон, Джелонское, Малиновское и др.; некоторые Крымские озера (Сасык-Сивашское и др.), Казахстанские (например, Джаман-Клыч у северной оконечности Аральского моря) и др. Аналогичные озера распространены и в других зарубежных странах: США, Мексике, Египте, Китае и др.
Практическое значение. Эпсомит, как и другие сульфаты магния, используется в текстильной, бумажной, сахарной, химической, фармацевтической и других отраслях промышленности.
ГЕКСАГИДРИТ — Mg[SO4] · 6H2O. Сингония моноклинная; призматический в. с. L2PC. Пр. гр. C2/c (C 62h). а0 = 10,11; b0 = 7,21; с0 = 24,41. Синоним: сакиит. Встречается в толстотаблитчатых, копьевидных кристаллах или волокнистых массах. Двойники по (001) и (110).
Цвет белый, иногда со светло-зеленым оттенком. Блеск перламутровый. Ng = 1,456, Nm = 1,453 и Np = 1,426.
Твердость 2. Спайность по {100} совершенная. Уд. вес 1,75. В воде легко растворяется.
Встречается в магнезиально-сульфатных соляных озерах Астраханской области, Крыма и др. Выделяется при сгущении рапы после эпсомита.
КИЗЕРИТ — Mg[SO4] . H2O. Химический состав. MgO — 29 %, SO3 — 58 %, Н2О — 13 %.
Сингония моноклинная; призматический в. с. L2PC. Пр. гр. A2/a (C62h). а0 = 7,52; b0 = 7,69; с0 = 6,89. Встречающиеся кристаллы имеют дипирамидальный облик. Обычен в плотных кристаллически-зернистых агрегатах.
Цвет. Редко бесцветен и прозрачен; обычно мутный, белый, с желтоватым оттенком. Блеск стеклянный. Ng = 1,584, Nm = 1,533 и Np = 1,520.
Твердость 3,5. Хрупок. Спайность по призмам {110} и {111} совершенная. Уд. вес 2,57. Прочие свойства. Во влажном воздухе постепенно переходит в эпсомит. Истертая масса, будучи замешана с небольшим количеством воды, твердеет подобно обожженному гипсу.
Диагностические признаки. От сходных водных сульфатов (эпсомита, каинита и др.) отличается по оптическим константам и составу.
П. п. тр. растрескивается, теряет воду и легко плавится. Медленно растворяется в воде. Из сложных, концентрированных богатых магнезией сульфатных рассолов кристаллизуется при температурах выше 18—20 °С в числе последних минералов.
Происхождение и месторождения. В соляных озерах кизерит как продукт непосредственной кристаллизации из богатой магнезией сульфатной рапы образуется в очень редких случаях (поле устойчивости этого соединения при относительно низких температурах весьма небольшое).
Обычно он встречается в ископаемых соляных месторождениях, где мог образоваться в результате дегидратации под давлением за счет более богатых водой сульфатов магния (эпсомита и гексагидрита).
В значительных количествах (до 30 % всей массы) кизерит встречается в Штассфуртских соляных месторождениях (Германия) в ассоциации с галитом, карналлитом, полигалитом, ангидритом и др.
Практическое значение. Употребляется для приготовления горькой соли (эпсомита), о применении которой было сказано выше.
МЕЛАНТЕРИТ — Fe[SO4] . 7Н2О. От греч. мелантерос — более черный. По всей вероятности, первоначально была установлена редко встречающаяся в природе серовато-черная разность; кроме того, минерал легко дает черную краску.
Химический состав. FeO — 25,9 %, SO3 — 28,8 %, Н2О — 45,3 %. Устанавливаются изоморфные примеси: Mg, Ni, Zn, Сu, иногда Mn.
Сингония моноклинная; призматический в. c. L2PC. P21/c(C52h). a0 = 15,34; b0 = 2,98; с0 = 20,02. Облик кристаллов ромбоэдрический, иногда игольчатый волосистый. Чаще наблюдается в сплошных массах в виде прожилков или в натечных формах.
Цвет мелантерита светло-зеленый, изредка темно-серый или серовато-черный. Блеск стеклянный. Ng = 1,486, Nm = 1,478, и Np = 1,471.
Твердость 2. Весьма хрупок. Спайность по {001} совершенная, по {110} ясная. Уд. вес 1,8–1,9.
Диагностические признаки. От других легкорастворимых сульфатов с уверенностью можно отличить лишь по данным химических анализов. Характерно нахождение железа в двухвалентной форме.
При нагревании расплывается, растворяясь в собственной кристаллизационной воде. Теряя воду, превращается в порошковатую массу безводной сернокислой соли, которая на угле в окислительном пламени буреет (окисление двухвалентного железа).
Происхождение и месторождения. Кристаллизуется из пересыщенных сульфатных вод в условиях недостатка кислорода. Поэтому в зонах окисления не встречается. Обычно наблюдается ниже зоны окисления в трещинах и полостях среди полуразложенных богатых пиритом руд в ассоциации с гипсом и другими сульфатами. Находят его и среди глин в каменноугольных месторождениях (первоисточником, вероятно, служит часто содержащийся в них пирит).
Мелантерит в очень небольших количествах встречен в ряде месторождений Сибири, Средней Азии и Казахстана. В Блявинском колчеданном месторождении (Южный Урал) он в виде прожилков и скоплений в пустотах наблюдается в верхних горизонтах полуразложенных пиритовых руд. Здесь встречены черные разности мелантерита.
Практическое значение. В природе редко встречается в больших количествах. Искусственно приготовляемый мелантерит применяется в красочном деле, в производстве синих (берлинская лазурь), темных и черных красок, употребляемых для окраски шерсти и кожи в черный цвет, а также для приготовления чернил, и в других отраслях химической промышленности. Следует отметить, что семиводный сульфат закисного железа с некоторыми дубильными органическими веществами дает устойчивую черную краску.
ХАЛЬКАНТИТ — Cu[SO4] . 5H2O. От греч. халькос — медь, анте — цветы («медные цветы»). Синоним: медный купорос.
Химический состав. CuO — 31,8 %, SO3 — 32,1 %, H2O — 36,1 %. Примеси: Fe, иногда Zn, Co и Mg (магнохалькантит).
Сингония триклинная; пинакоидальный в. с. Пр. гр. Р1–(С1i), а0 = 6,11; b0 = 10,673; с0 = 5,95; α = 97°35′; β = 107°10′; γ = 77°33′. Кристаллы встречаются редко в короткопризматических и таблитчатых формах. Обычно наблюдается в сплошных массах или в сталактитовых формах с радиально-волокнистым строением.
Цвет халькантита небесно-голубой, синий, иногда с зеленоватым оттенком. Блеск стеклянный. Ng = 1,543, Nm = 1,537 и Np = 1,514.
Твердость 2,5. Весьма хрупок. Спайность по {110} несовершенная. Излом раковистый. Уд. вес 2,1–2,3.
Диагностические признаки. Узнается по небесно-голубому цвету и легкой растворимости в воде, но более точное определение возможно лишь с помощью химического анализа.
При нагревании постепенно теряет воду, переходит сначала в трехводный сульфат, а затем в одноводный; при этом становится белым, непрозрачным. В воде растворяется, окрашивая раствор в синий цвет. При погружении в раствор железной иглы на ней выделяется металлическая медь.
Происхождение и месторождения. Образуется в зонах окисления медно-сульфидных месторождений в странах с сухим климатом. В виде сталактитов наблюдается на стенках старых заброшенных и непроветриваемых выработок, пройденных в зонах окисления медных месторождений.
В России халькантит встречался в ряде медных месторождений: Меднорудянском (у Нижнего Тагила), Турьинских рудниках (Северный Урал) и др. В больших массах крайне редок.
Практическое значение. Искусственно приготовляемый халькантит (медный купорос) употребляется для борьбы с вредителями виноградников, а также в химической, красильной и других отраслях промышленности.
Наличие этого минерала в рудах указывает на то, что рудничные воды богаты растворенным сульфатом меди и потому могут служить объектом добычи металлической меди, легко выделяющейся на железном ломе. С этой целью меденосные грунтовые воды пропускают через специальные бассейны, в которых происходит осаждение меди на железной стружке.
Здесь рассмотрим характерную группу основных двойных сульфатов Al и Fe с одновалентными (К, Na, NH4, Ag) и отчасти двухвалентными (РЬ) металлами.
Кристаллическая структура минералов этой группы близка к слоистой. Катионы Al3+ и Fe3+, координированные гидроксилом и кислородом по октаэдру, составляют ажурные слои, связываясь через ОН-вершины; связь между слоями осуществляется тетраэдрами [SO4], а в образующихся между слоями пустотах, координированные 12 анионами гидроксила и кислорода, расположены катионы щелочей (а также аммония, Ag и Pb). Характерно, что соединения с крупными одновалентными катионами (К, NH4), а также изредка с Pb2+ принадлежат к псевдокубическим, кристаллизуясь в дитригонально-пирамидальном в. с. (угол ромбоэдра β близок к 90°), тогда как соединения с менее крупными катионами (Na и Ag) —
к более низким по симметрии, псевдогексагональным.
АЛУНИТ — KAl3[SO4]2[OH]6. Синонимы: алюнит, квасцовый камень. Коллоидная разность, богатая адсорбированной водой, носит название левигита.
Химический состав. К2О — 11,4 %, Аl2О3 — 37 %, SO3 — 38,6 %, H2O — 13 %. Очень часто часть К2О иногда наполовину бывает замещена Na2O (натроалунит). В левигите порой устанавливаются редкие земли.
Сингония тригональная; дитригонально-пирамидальный в. с. L33P. Пр. гр. R3m (С53v). а0 = 6,96; c0 = = 17,35. Встречающиеся мелкие кристаллы имеют ромбоэдрический, псевдокубический или толстотаблитчатый облик (рис. 249). Обычно наблюдается в тонкозернистых, землистых, иногда волокнистых массах.
Рис. 249. Кристалл алунита
Цвет алунита белый с сероватым, желтоватым или красноватым оттенком. Блеск стеклянный, на плоскостях спайности иногда перламутровый. Ng = 1,592 и Nm = 1,572 (у натровой разности — 1,585).
Твердость 3,5–4. Спайность по {0001} ясная. Уд. вес 2,6–2,8.
Диагностические признаки. В тонкокристаллических массах его легко смешать со многими водными минералами белого цвета. Наиболее надежно можно отличить по химическим реакциям.
П. п. тр. растрескивается, но не плавится. Воду теряет лишь при прокаливании. С содой дает серную печень. Смоченный раствором азотно-кислого кобальта, принимает синий цвет (реакция на Al). В воде и HCl не растворим. В концентрированной H2SO4 растворяется с трудом. При обработке прокаленного алунита водой в раствор переходят квасцы.
Происхождение и месторождения. В значительных вкрапленных массах образуется при проработке низкотемпературными сернокислыми гидротермами изверженных горных пород, богатых щелочными полевыми шпатами, за счет которых он и образуется. Этот процесс изменения горных пород известен под термином «алунитизация». Встречается также в некоторых гидротермальных жилах.
Редкие конкреционные образования алунита встречались также в песках, глинах, бокситах, очевидно экзогенного происхождения.
В Журавлинском месторождении (на р. Чусовой, в 25 км вверх по течению от ст. Чусовская) алунит с гиббситом и каолином в виде гнезд и прожилков экзогенного происхождения встречается в зоне разрушения известняков. В виде желтоватых или розоватых включений неправильной формы алунит присутствует в сильно измененных туфах (обломочных породах изверженного происхождения) в районе с. Заглик (близ Гянджи, Азербайджан).
Практическое значение. Алунитсодержащие породы служат источником для получения квасцов и сульфата алюминия (о применении их см. квасцы). В последнее время алунит рассматривается как источник окиси алюминия.
ЯРОЗИТ — KFe3[SO4]2[OH]6. Назван по месту открытия — в Барранко Ярозо (Испания). Синоним: ютаит.
Химический состав. К2О — 9,4%, Fe2Os — 47,9%, SO3 — 31,9%, Н2О — 10,8%. Нередко присутствуют в небольших количествах натрий и селен, а в виде механических примесей также SiO2, Al2O3 и др.
Сингония тригональная; дитригонально-пирамидальный в. с. L33P. Пр. гр. R3m (С53v). а0 = 7,304; c0 = 17,268. Нередко наблюдается в сплошных зернистых или землистых массах, причем в пустотах часты друзы мелких ромбоэдрических кристалликов.
Цвет ярозита охристо-желтый, часто с явным бурым оттенком. Черта желтая. Блеск стеклянный, приближающийся к алмазному. Nm = 3,820 и Np = 1,715.
Твердость 2,5—3,5. Спайность по {0001} ясная. Уд. вес 3,15–3,26.
Диагностические признаки. По внешним признакам похож на охристый лимонит. Отличается по химическим реакциям, а также тем, что при растирании между пальцами дает ощущение жирной, салящей массы, тогда как лимонит производит впечатление жесткого, песчанистого вещества.
П. п. тр. в восстановительном пламени дает магнитную массу. В воде не растворяется. Растворим в HCl; из раствора BaCl2 высаживает осадок BaSO4. В закрытой трубке выделяет воду с кислой реакцией.
Происхождение и месторождения. Ярозит является довольно широко распространенным минералом и образуется в зонах окисления железносульфидных, главным образом пиритовых, месторождений, преимущественно в условиях сухого полупустынного климата, а также за счет пирита в некоторых осадочных породах.
В условиях умеренного климата при значительных атмосферных осадках он образуется очень редко: сульфиды железа, разлагаясь, переходят непосредственно в гидроокислы железа.
Как показывают опыты, ярозит выпадает из сульфатных вод, свободно соприкасающихся с кислородом воздуха и потому содержащих трехвалентное железо.
В водно-воздушной обстановке ярозит не вполне устойчив. Подвергаясь гидролизу, образует гидроокислы железа.
Довольно часто наблюдаются псевдоморфозы ярозита по вкрапленным в породах кубическим кристаллам пирита, а также по конкрециям марказита и пирита в глинах.
Значительные массы ярозита у нас встречены в Блявинском колчеданном месторождении (Южный Урал), где он сохранился в древней зоне окисления под зоной железной шляпы, представленной гидрогематитом и гематитом.
В зоне окисления ярозит с кварцем и баритом слагает так называемую сыпучку на золоторудном месторождении Майкаин (в Баянаульском районе, Центральный Казахстан).
Практическое значение. В случае наличия больших чистых ярозитовых масс может представлять интерес как сырье для получения полировальных порошков (Fe2O3), изготовляемых путем обжига в печах.
Квасцами называют нормальные двойные сульфаты Al и щелочей, кристаллизующиеся в кубической сингонии с 12 молекулами воды. Здесь же опишем галотрихит — сульфат Fe и Al с 22 молекулами Н2О.
КАЛИЕВЫЕ КВАСЦЫ — KAl[SO4]2 . 12H2O. Сингония кубическая; дидодекаэдрический в. с. 4L363L23PC. Химический состав. К2О — 9,9 %, Аl2О3 — 10,8 %, SO3 — 33,8 %, Н2O — 45,5 %.
Цвет. Бесцветны. Блеск стеклянный. N = 1,456 (часто анизотропны). Твердость 2. Уд. вес 1,76. П. п. тр. легко плавятся. Растворяются в воде. Растворимость при 20 °С составляет 151 г/л.
Встречаются в виде землистых масс, выцветов, корок, реже в сплошных зернистых агрегатах.
Наблюдались в «квасцовых землях» Тамбовской и Ульяновской областей, на Северном Кавказе (р. Зеленчук), в Дагестане, в Блявинском колчеданном месторождении на Урале (в низах зоны окисления вместе с другими сульфатами), на правом берегу р. Оки (приток Ангары, Сибирь), в Туркмении (Каракумы), Узбекистане (Шорсу) и др.
Калиевые квасцы могут иметь обширное применение: как протрава в красильном, типографском, кожевенном, бумажном производстве, в медицине, для приготовления лаковых красок и пр. Извлекаются выщелачиванием из «квасцовых земель» с последующим выпариванием растворов. Однако в главной своей массе квасцы приготовляются искусственно из бокситов или получаются в качестве побочного продукта в других химических производствах.
НАТРИЕВЫЕ КВАСЦЫ — NaAl[SO4]2 . 12Н2О. Синоним: сольфатарит. С полной достоверностью в природе не установлены. Легко получаются искусственно. Наблюдались в виде параллельно-волокнистых масс в трещинах пород.
Цвет. Бесцветны. Блеск стеклянный. Твердость 3. Уд. вес 1,73. N = 1,439 (для искусственного соединения). Изучавшиеся природные образцы оказывались оптически анизотропными либо в силу частичной дегидратации, либо в силу принадлежности к другой модификации — мендоциту. На воздухе обезвоживаются и переходят в тамаругит — NaAl[SO4]2 . 6H2O. Указываются в сольфатарах Поццуоли (близ Неаполя).
ГАЛОТРИХИТ — FeAl2[SO4]4 . 22H2O. Сингония моноклинная; диэдрический осевой в. с. L2. Часто наблюдается в асбестовидных прожилках снежно-белого цвета, с шелковистым блеском. Отсюда его название (в переводе (с греч.) «волосистая соль»).
Твердость 2–2,5. Уд. вес 1,89–2,04. В воде растворяется. В пламени свечи вскипает и затвердевает в каплевидных формах.
Образуется из сульфатных вод, богатых алюминием и закисным железом, в условиях явного недостатка свободного кислорода ниже зоны окисления колчеданных руд, как это имеет место в Блявинском месторождении (Южный Урал).
Встречается также в пиритоносных глинах, в пластах каменных углей, где образуется за счет разлагающегося в зоне окисления пирита и глинистого вещества, разлагаемого образующейся серной кислотой: на правом берегу р. Оки (приток Ангары, Сибирь), в Кизеловских каменноугольных копях на Урале и др.
1 На этом свойстве основано хранение серной кислоты в сосудах, внутренние стенки которых покрыты слоем металлического свинца: образующаяся нерастворимая тонкая оболочка PbSO4 столь плотна, что не допускает дальнейшего превращения свинца в сульфат.

