К этому классу относятся сложные сернистые соединения, по химической конституции похожие на соли. Их называют сульфосолями. Подобно оксосолям, в них различают сульфооснования и сульфоангидриды или катионы и комплексные анионы.
Несмотря на большое разнообразие относящихся сюда минералов, в их составе участвует очень небольшое число компонентов.
Роль сульфоангидридов в подавляющем большинстве сульфосолей играют As2S3, Sb2S3 и Bi2S3. Соответственно этому мы имеем и названия соединений: сульфоарсениты, сульфоантимониты и сульфовисмутиты.
Весьма показательно, что в сульфосолях всех этих трех типов в основания входят одни и те же металлы, большей частью Cu, Ag и Рb, т. е. наибольшим распространением в природе пользуются сульфосоли меди, серебра и свинца. Исключительно редко встречаются самостоятельные сульфосоли Tl, Hg и Fe, а в виде изоморфных примесей в существенных количествах наблюдаются лишь Zn и Mn.
В очень небольшом количестве устанавливаются также сульфованадаты, сульфоарсенаты и сульфоантимонаты меди, т. е. такие сульфосоли, в которых роль сульфоангидридов играют V2S5, As2S5 и Sb2S5 (пятивалентные ионы).
Все разнообразие сульфосолей обусловливается главным образом тем, что в качественно одинаковых типах соединений устанавливаются различные соотношения сульфооснований с сульфоангидридами. Так, например, для сульфоантимонитов серебра известны следующие соединения: 12Ag2S . Sb2S3, 9Ag2S . Sb2S3, 5Ag2S . Sb2S3, 3Ag2S . Sb2Ss, Ag2S . Sb2S3 и Ag2S . 6Sb2S3 или соответственно: Ag24Sb2S15, Ag9SbS6, Ag5SbS4, Ag3SbS3, AgSbS2 и Ag2Sb12S19. Все это совершенно определенные соединения, встречающиеся в кристаллах и имеющие разные кристаллические структуры.
Основные черты химизм сульфосолей подвержены изменениям в зависимости от атомного веса полуметалла, участвующего в их составе. Если сульфоарсениды обычно обладают относительно постоянным составом, то для сульфоантимонитов, а особенно для сульфовисмутитов, характерно непостоянство состава с замещением части серы селеном, свинца — висмутом и наоборот, что ведет к заметной нестехиометричности таких соединений.
Кристаллические структуры сульфосолей, подобно кислородным солям, в сравнении с окислами должны отличаться от простых сернистых соединений тем, что в сульфосолях в качестве структурных единиц должны участвовать, казалось бы, лишь компактные анионные группы, например [SbS4]5–, [SbS3]3– и т. д. В наиболее простых кубических и тригональных кристаллических структурах сульфосолей действительно установлены такие анионные группы, не вполне, впрочем, изолированные, а включенные в большинстве случаев в плотнейшую анионную упаковку, в той или иной степени искаженную или прореженную. Отклонению от обычной для сульфидов правильной координации служит распространенная форма сульфоанионов — тупых тригональных пирамид или «зонтиков» (подобно комплексным анионам [SO3]2– в сульфитах) [AsS3]3–, [SbS3]3– и [BiS3]3–, где As, Sb и Bi трехвалентны. Такие группы имеются, например, в структурах прустита (Ag3[AsS3]), пираргирита (Ag3[SbS3]), тетраэдрита (Cu3[SbS3]) и др. Такие зонтичные сульфоанионы обладают явной полярностью, имея в качестве одной из четырех вершин атом полуметалла. Вопрос о том, почему в описываемых сульфоанионах с неполновалентными полуметаллами As3+, Sb3+ и Bi3+ не реализуется плоскотреугольная координационная группировка серы, подобно тому, как это осуществляется в карбонат-ионе [CO3]2-, требует для ясного ответа рассмотрения электронной конфигурации полуметаллов.
Ковалентная полярная связь атомов в молекулах сульфидов As3+, Sb3+ и Bi3+ требует максимального взаимного удаления трех отрицательно заряженных связывающих электронных пар, направленных к атомным остовам S2-. От связывающих пар отталкивается и не участвующая в химической связи неподеленная электронная пара, принадлежащая каждому из катионов полуметалла, т. к. они не полновалентны (сравните As5+ и As3+, различающиеся как раз двумя электронами). Неподеленная пара занимает значительный объем, она и образует недостающую четвертую вершину в координационном тетраэдре, образовавшемся вокруг атома полуметалла при участии трех анионов S2-, дающих только три вершины. Не принимая во внимание неподеленную пару, мы описываем координацию полуметалла как пирамидальную, или «зонтичную».
Размещение неподеленных электронных пар осуществляется нередко за счет пропуска анионов S2- в плотнейших упаковках, наследуемых сульфосолями от структур родоначальных сульфооснований. Сразу отметим, что неподеленные пары, сцепленные с атомами полуметаллов, способны к образованию между собой слабых вандерваальсовских связей, чем способствуют соединению отдельных молекул в таких сульфидах полуметаллов, как аурипигмент, антимонит и висмутин. Поэтому неподеленные электронные пары, выталкиваясь из толщи молекул жестко локализованными связывающими парами, сами склонны к некоторой конденсации в промежутках между молекулами в структурах аурипигмента, антимонита и висмутина. При отсутствии неподеленных электронных пар (т. е. в случае полновалентных ионов элементов V группы периодической системы) формируются высокосимметричные тетраэдрические анионные группы [VS4]3–, [AsS4]3–, [SbS4]3–, где V, As и Sb пятивалентны.
В отличие от кислородных комплексных анионов комплексные сульфоанионы характеризуются нередко меньшей компактностью, что связано, очевидно, с более слабой поляризующей способностью катионов As3+, Sb3+, Bi3+, V5+, As5+ и др. Отдельные координационные группировки полуметаллов (особенно Sb и Bi) с серой не всегда остаются в изолированном виде, но могут конденсироваться с образованием сложных построек различной формы и строения — полианионов. Так, структуры многих висмутовых и сурьмяных сульфосолей содержат комплексные анионы в виде протяженных в одном или в двух измерениях фрагментов, как бы вырезанных из структур антимонита и висмутина. Катионные части структур также нередко отвечают фрагментам структур простых сульфидов, выступающих в качестве сульфооснований. Анионные и катионные фрагменты соединяются между собой достаточно прочными связями в относительно компактные блоки. Структурная группировка сульфосолей может быть произведена по топологии анионных и катионных мотивов в структуре с различением координационных, слоистых и ленточно-цепочечных сульфосолей.
Структурные типы различных сульфосолей формируются в результате довольно сложного компромисса, устанавливающегося между конкурирующими тенденциями, ведущими к переносу в результирующий мотив черт, присущих родоначальным структурам сульфооснований и сульфоангидридов в зависимости от количественного преобладания того или другого. В результате формируются устойчивые структурные блоки, состоящие из фрагментов структуры сульфооснований, «одетых» снаружи в слои анионных радикалов, близких по строению к структурам сульфоангидридов.
При этом в сульфосоли переходят из молекулярных структур сульфоангидридов и неподеленные электронные пары, стремящиеся нередко к конденсации в виде лент или слоев, требующих объема. При этом связь между электронейтральными блоками становится достаточно слабой. Поэтому мотивы взаимного расположения структурных блоков в таких сульфосолях напоминают узор паркета, что в какой-то мере согласуется с правилами акад. А. И. Китайгородского о взаимной укладке молекул в органических кристаллах: выступами одних к промежуткам между другими.
Физические свойства сульфосолей отличаются от свойств сульфидов металлов некоторыми особенностями. По сравнению с простыми сернистыми соединениями они в общей массе обладают меньшей твердостью (особенно сульфосоли низших сингоний, к которым принадлежат большинство минералов), гораздо более легкой разлагаемостью кислотами, относительно низкой отражательной способностью. Все эти свойства, несомненно, связаны с особенностями конституции этих соединений. Так, при переходе от сульфидов металлов — минералов с высоким средним атомным номером, повышающим степень металличности связи, к сульфосолям — соединениям с участием ковалентных сульфоангидридов, средний атомный номер понижается и металлические свойства (непрозрачность и высокая отражательная способность, ковкость и проводимость) могут проявляться в меньшей степени. Так, некоторые мышьяковые и сурьмяные сульфосоли Ag имеют алмазный блеск и просвечивают красным цветом. Твердость же падает по причине возрастания доли слабых связей и разрыхления структуры неподеленными парами, а конденсация последних вдоль определенных направлений приводит к появлению отчетливой спайности.
При классификации сульфосолей наиболее рациональным является разделение их на большие группы по металлам, участвующим в сульфооснованиях, и уже внутри таких групп можно проводить систематику по составу сульфоангидридов. При такой установке классификацию сульфосолей можно свести к следующему.
A. Сульфосоли меди, т. е. соединения типа nCu2S . X2S3, где X = As3+, Sb3+и Bi3+, и типа ЗСu2S . Х2S5, где X = V5+, As5+ и Sb6+. Таким образом, сюда войдут сульфоарсениты, сульфоантимониты и сульфовисмутиты меди, а также сульфованадаты, сульфоарсениты и сульфоантимонаты меди.
Б. Сульфосоли серебра: nAg2S . X2S3, где X = As3+, Sb3+ и Bi3+ — сульфоарсениты, сульфоантимониты и сульфовисмутиты серебра.
B. Сульфосоли свинца: nPbS . X2S3, где X = As3+, Sb3+ и Bi3+ — сульфоарсениты, сульфоантимониты и сульфовисмутиты свинца.
Также существует, разумеется, множество поликатионных сульфосолей, например двойных, которые здесь приходится рассматривать условно отнесенными к какому-либо из вышеперечисленных разделов по одному из металлов, принятому за главный.
1. Группа тетраэдрита (блеклые руды)
Относящиеся сюда минералы представлены обширной изоморфной группой так называемых блеклых руд с общей химической с приближенной формулой A3ХS3 или 3A2S . Х233, где A = Сu+, в меньшей степени Ag+, Cu2+, Zn2+, Fe2+, Hg2+, a X = As3+ и Sb3+, иногда Te5+ (в голдфилдите) и редко Bi3+ (в очень незначительных количествах). Сера изредка может в существенных количествах замещаться селеном (в хаките и жиродите).
Более точной формулой, согласно рентгенометрическим данным, должна быть: A+10A2+2Х4S13. С этим вполне согласуется некоторый избыток серы, устанавливаемый при точных химических анализах блеклых руд. Наконец, отметим, что из 12 позиций, отведенных для металлических катионов, две должны быть заполнены двухвалентными катионами. В этих двух позициях происходят изовалентные изоморфные замещения, не зависящие от изоморфизма в сульфоанионе (исключая замещение Te4+>X3+, требующее сопряженного изоморфизма в катионной группе для поддержания электронейтральности). Доминирование какого-либо из двухвалентных элементов в этих позициях приводит к необходимости выделения соответствующего минерального вида, что в сочетании с изоморфизмом полуметаллов в сульфоанионе приводит к значительному разнообразию.
Так как медь обладает валентностью один или два, то все позиции катионов могут быть заняты одним этим элементом; так в большинстве случаев и происходит. В зависимости oт того, какой из сульфоангидридов преобладает в таких соединениях, различают следующие два наиболее распространенных минеральных вида: теннантит (Cu12As4S13) и тетраэдрит (Cu12Sb4S13). Наибольшим распространением в породе пользуются так называемые смешанные блеклые руды состава Cu12(As, Sb)4S13.
Кристаллическая структура блеклых руд довольно сложная, но можетбыть в общих чертах выведена на основании кубической плотнейшей упаковки с расположением катионов в половине тетраэдрических пустот одной ориентации, что делает общий мотив структуры и облик кристаллов близкими к таковым у сфалерита.
Параметр кубической ячейки блеклых руд приблизительно вдвое больше параметра ячейки сфалерита. Содержимое элементарной ячейки блеклой руды, как показали рентгенография и измерения плотности, соответствует двум ее формулам A+10A2+2Х4S13. Структура сфалерита ZnS (см. рис. 94а) после выбора кубической ячейки вдвое большей по ребру содержит в восемь раз больше атомов: 32 катиона Zn2+ и 32 аниона S2–. Заменив третью часть металлических катионов Zn2+ катионами полуметалла X3+, а прочие катионы одновалентными A+, получим состав A+24X3+8S2–32. Теперь для обеспечения зонтичной тройной координации полуметаллов [X3+S2–3] вместо типичной для Zn в сфалерите четверной (тетраэдрической, см. рис. 94в), удалим восемь анионов S2–. Дефекты, образовавшиеся в плотнейшей упаковке, сосредоточим по четыре, в вершинах двух отдельных пустых тетраэдров, обладающих противоположной по отношению к заполненным тетраэдрам ориентацией (такие тетраэдры соответствуют пустым октантам сфалеритовой ячейки на рис. 94а). Место удаленных анионов S2- занимают неподеленные электронные пары, привнесенные полуметаллом X3+, они несколько стабилизируют нарушенную упаковку.
На этом этапе не только координация полуметаллов понижена до трех, но и половина всех ионов А+, прилегающих к двум пустым пока тетраэдрам, составленным неподеленными парами вместо S2–, лишена полноценного окружения, их координация по анионам S2– равна всего двум. Оставшаяся половина катионов А+ обладает по-прежнему четверной координацией (как у сфалерита). Общий состав элементарной ячейки блеклой руды теперь может быть выражен как A+24X3+8S2–24 или A+24[X3+S2–3]3–8.
Для окончательной стабилизации дефектной плотнейшей упаковки введем по одному дополнительному аниону S2– в центр каждого из двух пустых тетраэдров обратной ориентации, вокруг которых сосредоточены заменяющие серу неподеленные пары. Это повысит координацию половины атомов A+ от двух до трех. Но после введения 2S2– для соблюдения электронейтральности необходимо повысить заряд катионной части на четыре единицы, для чего четыре катиона А+ из числа трехкоординированных заменяются на катионы А2+. Теперь содержимое ячейки будет A+20A2+4[X3+S2–3]3–8S2, или иначе — A+20A2+4X3+4S2–26. Легко видеть, что это удвоенная точная формула блеклых руд, приведенная в начале описания группы. Итак, структуру блеклой руды можно, подобно структурам сфалерита или халькопирита, считать координационной, чем определяются многие ее свойства, от изометричного облика кристаллов до отсутствия спайности.
Все минеральные виды, относящиеся к данной группе, имеют много общего в физических свойствах, поэтому ниже мы дадим совместное описание лишь двух главных представителей группы.
ТЕННАНТИТ — Cu+10Cu2+2As4S13. Название по фамилии химика Теннанта.
ТЕТРАЭДРИТ — Cu+10Cu2+2Sb4S13. Название дано по форме встречающихся кристаллов, обычной вообще для блеклых руд разного состава.
Химический состав. В составе различных блеклых руд наблюдаются следующие колебания в содержании отдельных элементов (в %):
|
Cu — 22–53; |
Hg — 0–17; |
As — 0–20; |
|
Ag — 0–18; |
Ni — 0–3,5; |
Sb — 0–29,2; |
|
Zn — 0–9; |
Co — 0–4,2; |
Bi — 0–4,5 (13,07); |
|
Fe — 0–13; |
Mn — 0–1,5; |
S — 20,6–29,1. |
При замещении атомов одновалентной меди серебром на основе тетраэдрита можно получить фрайбергит — (Ag+,Cu)12Sb4S13; а при изоморфизме Zn2+→ Cu2+ или Hg2+ → Cu2+ — зандбергерит или швацит соответственно.
Сингония кубическая; гексатетраэдрический в. с. 3L24L36P. Пр. гр. I4–3m (T 3d). a0 = 10,196 (для теннантита) и 10,400 (для тетраэдрита). В изоморфной серии теннантит — тетраэдрит размер элементарной ячейки увеличивается по мере замещения мышьяка сурьмой и меди серебром. Кристаллическая структура см. выше, в описании группы.
Встречающиеся в пустотах кристаллы имеют тетраэдрический облик (рис. 129) с комбинацией форм: {11–1}, {111}, {110}, {112}, {100} и др. Обычно встречается в сплошных массах или в виде вкраплений неправильной формы зерен. Часты двойники по (111), реже по (100).
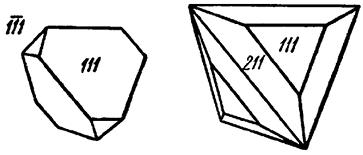
Рис. 129. Кристаллы тетраэдрита
Цвет стально-серый до железно-черного (богатых Fe разностей). Для богатой ртутью блеклой руды — швацита характерна побежалость в синих тонах. Черта имеет тот же цвет, иногда с буроватым и даже вишнево- красным оттенком (для теннантита). Непрозрачен. Блеск металлический, тусклый до полуметаллического.
Твердость 3–4. Обладает хрупкостью. Спайность практически отсутствует. Уд. вес 4,4–5,4. Мышьяковистые разности по сравнению с сурьмянистыми обладают меньшими удельными весами. Прочие свойства. Обладает слабой электропроводностью.
Диагностические признаки. Характерными особенностями являются следующие: блеклый тон в изломе и явно проявляющаяся хрупкость (при царапании ножом черта «пылится» и не оставляет блестящего следа, как это наблюдается у халькозина и аргентита, похожих по некоторым признакам на блеклые руды). По цвету и хрупкости похожи также на бурнонит (CuPb[SbS3]), обладающий меньшей твердостью и несколько более сильным блеском.
П. п. тр. на угле блеклые руды легко плавятся в серый королек с выделением As2O3 и Sb2O3. Королек дает реакцию на медь и часто на железо. В HNO3 разлагаются с выделением S и Sb2O3. Отношение к реагентам меняется в зависимости от состава.
Происхождение и месторождения. Блеклые руды, особенно тетраэдрит, принадлежат к числу сравнительно распространенных минералов среди различных типов гидротермальных месторождений меди. В подчиненных количествах они присутствуют в самых разнообразных по составу рудах. Парагенетически чаще всего связаны с халькопиритом, реже сфалеритом, галенитом, пиритом, арсенопиритом, бурнонитом и другими минералами.
При выветривании месторождений легко разлагаются, давая различные продукты изменений: ковеллин, малахит, азурит, лимонит; за счет мышьяка образуется скородит (Fe[AsO4] . 2H2O); за счет сурьмы — ее окислы и гидроокислы.
Блеклые руды на территории России широко распространены. Они встречаются во всех медных и свинцово-цинковых месторождениях, однако редко образуют крупные скопления. Наибольший интерес по богатству блеклыми рудами представляют месторождения, известные под названием Благодатные рудники (к северо-востоку от Екатеринбурга). С блеклыми рудами этих месторождений связано наибольшее обогащение золотом. В составе их участвуют сурьма и мышьяк. Они ассоциируют главным образом с пиритом, халькопиритом и отчасти с галенитом. Хорошо образованные кристаллы тетраэдрита встречаются в друзовых пустотах в Березовском золоторудном месторождении. Кристаллы теннантита встречались в полых трещинах во многих колчеданных залежах Среднего Урала. Блеклые руды составляют заметную часть вольфрамоносных высокотемпературных кварцевых жил Джидинского месторождения (Бурятия). Фрайбергит отмечен в рудах Лермонтовского месторождения (Приморье).
Тетраэдрит известен также в сульфидных жилах Нагольного кряжа (Украина) и Джезказгана (Казахстан).
Практическое значение. Крупные самостоятельные месторождения блеклых руд не встречаются. В промышленных месторождениях они вместе с другими медьсодержащими сернистыми соединениями являются источником меди. При плавке медных руд, содержащих теннантит, в отходящих газах улетучивается вредная примесь — мышьяк в виде As2O3. To же самое происходит, конечно, за счет арсенопирита, энаргита и других мышьяксодержащих соединений, встречающихся в рудах в виде примесей. На крупных производствах этот «газовый мышьяк» в целях обезвреживания продуктов возгона улавливается, и таким путем могут попутно получаться значительные количества этого вида сырья.
Эта группа представлена соединениями типа Cu3XS4 (2Cu3XS4 = 3Cu+2S+X2S5), где Х = V, As и Sb, пятивалентные. К этой группе принадлежат несколько минеральных видов, относящихся к структурным типам, родственным сфалериту и халькопириту, в их числе кубический сульванит Cu3[VS4] и тетрагональные люцонит Cu3[AsS4] и фаматинит Cu3[SbS4], образующие изоморфный ряд. Мы рассмотрим лишь энаргит, диморфный с высокотемпературным люцонитом.
ЭНАРГИТ — Cu+3[As5+S2-4]. Энаргис по-гречески — явственный (по-видимому, имелась в виду ясно выраженная спайность минерала).
Химический состав. Сu — 48,3 %, As — 19,1 %, S — 32,6 %. Примеси: Sb (до 6,5 %), Fe (до 5,7 %), в ничтожных количествах Pb, Zn и Ag (возможно, за счет включений посторонних минералов).
Сингония ромбическая; ромбо-пирамидальный в. с. L22P. Пр. гр. Pnm21(C 72v). a0 = 6,46; b0 = 7,43; с0 = 6,18. Кристаллическая структура похожа на структуру вюртцита, отличается упорядоченным размещением атомов металла и полуметалла по тетраэдрическим пустотам плотнейшей упаковки S2- и рассматривается как координационная псевдогексагональная. Одинаковая тетраэдрическая координация катионов металла и полуметалла позволяет считать энаргит и другие соединения его группы не столько сульфосолями, сколько двойными сульфидами (металла и полуметалла), так как здесь атом полуметалла не участвует в формировании комплексной анионной группировки, а исполняет одинаковую с металлом кристаллохимическую роль.
Встречающиеся кристаллы большей частью имеют столбчатый с вертикальной штриховкой, реже таблитчатый облик; образованы комбинациями следующих форм: {110}, {001}, {100}, {010} и др. Обычно встречаются в зернистых сплошных массах и в виде вкраплений.
Цвет энаргита стально-серый до железно-черного. Черта серовато-черная. Непрозрачен. Блеск полуметаллический, сильный.
Твердость 3,5. Хрупок. Спайность совершенная по {110}, довольно ясная также по {010}. Уд. вес — 4,4–4,5. Прочие свойства. Обладает слабой электропроводностью.
Диагностические признаки. По внешним признакам больше всего похож на черный сфалерит, от которого отличается по спайности, совершенной лишь в одном направлении, и более сильному блеску.
П. п. тр. на угле плавится, давая налет As2O3, а с содой — королек меди. В HNO3 растворяется с выделением всплывающей серы.
Происхождение и месторождения. Встречается иногда в значительных массах в гидротермальных месторождениях меди в ассоциации с блеклыми рудами, халькопиритом, галенитом, пиритом и другими минералами.
Нередко устанавливаются псевдоморфозы теннантита по энаргиту, называвшиеся зеленым энаргитом. Сравнивая химические формулы этих минералов, легко видеть, что при этом процессе, совершающемся в эндогенных условиях, происходит лишь превращение As2S5 в As2S3.
В зоне окисления месторождений легко разлагается, образуя малахит, азурит, оливенит (арсенат меди) и другие вторичные минералы.
В месторождениях России энаргит встречается в виде незначительной примеси в рудах месторождений преимущественно колчеданной формации (Средний Урал), а также в гидротермальных жилах оловорудного месторождения Хапчеранга (Читинская обл.). Отмечен в полиметаллическом месторождении Невское (Магаданская область) в парагенезисе с сульфоселенидами и сульфосолями свинца и серебра. Из иностранных месторождений, в которых энаргит представлял крупные промышленные скопления, отметим следующие: Бьютт, Монтана (США), Чукикамата (Чили), Цумеб (Намибия) и др.
Практическое значение. В тех случаях, когда встречается в больших количествах, является рудой на медь и мышьяк.
Сюда относятся двойные сульфосоли меди и свинца типа CuPbXS3— бурнонит и айкинит.
БУРНОНИТ — CuPbSbS3. Синоним: бертонит.
Химический состав. Сu — 13 %, Рb — 42,5 %, Sb — 24,7 %, S — 19,8 % Примеси: Fe (до 5 %), Ag (до 3 %), следы Zn и Mn.
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Pnm21(C 72v). а0 = 8,19; b0 = 8,67; с0 = 7,74. Хорошо образованные кристаллы наблюдаются только в пустотах и часто имеют псевдотетрагональный или толстотаблитчатый облик (рис. 130) с развитыми гранями форм {001}, {010}, {100}, {011}, {110} и др. Двойники по (110) часты. Нередко образует повторяющиеся крестообразные или колесоподобные кратные двойники (в старой русской литературе по минералогии бурнонит назывался колесной рудой). Обычно встречается в неправильных зернах или в сплошных массах. Кристаллическая структура: сходна со структурой антимонита: Сu сосредоточена в тетраэдрах анионной упаковки, место атомов Sb антимонита занято Pb и Sb через один.
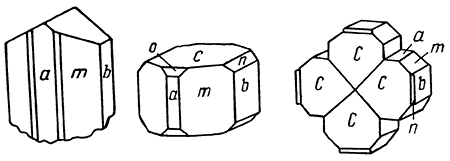
Рис. 130. Кристаллы и двойник бурнонита:
a {100}, n {011}, m {110}, b {010}, c {001}, o {101}
Цвет бурнонита стально-серый до свинцово-серого, нередко с томпаково-бурой побежалостью (на гранях кристаллов). Черта серая. Непрозрачен. Блеск металлический.
Твердость 2,5–3. Хрупок. Спайность несовершенная по {010}. Уд. вес 5,7–5,9. Прочие свойства. Электричество не проводит.
Диагностические признаки. По внешним признакам несколько похож на блеклые руды, но обладает более сильным блеском.
П. п. тр. на угле с содой легко плавится в черный шарик, который по удалении всего свинца (при осторожном сильном нагревании в сплаве борной кислоты) с трудом дает королек меди. Черный шарик при сильном нагревании с KJ дает желто-зеленый налет PJ2. В HNO3 растворяется с выделением S и Sb2O3.
Происхождение и месторождения. Встречается в гидротермальных месторождениях свинцово-сурьмяных руд. Обычно тесно ассоциирует с тетраэдритом и галенитом, выделяясь иногда в виде кайм на границах между ними.
В зоне окисления месторождений легко разлагается; за счет его могут образоваться малахит, церуссит (PbCO3) и окислы сурьмы.
В России бурнонит в заметных количествах встречается в Дарасунском золоторудном месторождении (Восточное Забайкалье) в рудах, состоящих из блеклой руды, галенита и др. Известен также с галенитом и буланжеритом в рудах Нежданинского месторождения в Верхоянье (Якутия).
Отмечен в кварцевых жилах Нагольного кряжа (Украина) в ассоциации с галенитом, блеклыми рудами, буланжеритом, джемсонитом и др. Среди иностранных месторождений в более значительных массах встречался в Пршибраме (Чехия), Клаусталле и Андреасберге в Гарце (Германия) и во многих месторождениях США, Мексики, Перу, Чили и др.
Практическое значение. В случае крупных скоплений представляет промышленный интерес как руда свинца и меди.
АЙКИНИТ — CuPbBiS3. Впервые был открыт на Урале в начале XIX в. Синоним: патринит.
Химический состав. Сu — 11 %, Рb — 36 %, Bi — 36,2 %, S — 16,8 %. Примеси: Те и Аu (последний в виде включений).
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Рптa(D162h). а0 = 11,364; b0 = 11,832; с0 = 8,05. Часто наблюдается в игольчатых и шестоватых кристаллах, вросших в кварц, иногда в сплошных массах. На гранях нередко заметна вертикальная штриховка.
Цвет айкинита свинцово-серый до стально-серого, нередко с буроватой или коричневатой побежалостью. Черта серовато-черная, блестящая. Непрозрачен. Блеск металлический.
Твердость 2–2,5. Хрупок. Спайность несовершенная по {010}. Уд. вес 6,1–6,7.
Диагностические признаки. Характерна игольчатая или шестоватая форма кристаллов, но без химических реакций на Bi, Pb и Сu узнать его трудно.
П. п. тр. легко плавится, дымится, покрывает уголь белым и желтым налетом. Оставляет металлический королек, который в сплаве борной кислоты с трудом дает королек меди. Реакция на Bi с KJ. В HNO3 растворяется, выделяя PbSO4 и серу.
Происхождение и месторождения. Минерал редкий. Встречается в кварцевых жилах гидротермального происхождения в ассоциации с пиритом, халькопиритом, блеклыми рудами, галенитом, арсенопиритом, самородным золотом, иногда шеелитом, вольфрамитом и другими минералами.
Большой известностью пользуются шестоватые и игольчатые кристаллы айкинита в прозрачных или полупрозрачных кристаллах кварца в Березовском золоторудном месторождении (к северо-востоку от Екатеринбурга). В парагенезисе с ним нередко наблюдаются галенит, блеклые руды, пирит, халькопирит и часто самородное золото. Отмечен с вольфрамитом, пиритом, сфалеритом, родохрозитом и триплитом в кварцевых жилах Джиды (Бурятия).
В зоне окисления неустойчив. В результате разрушения по айкиниту образуются землистые желтые или зеленовато-желтые массы так называемых висмутовой и свинцовой охр.
Практическое значение. Сам по себе представляет лишь минералогический интерес. В Березовском месторождении нахождение его в жилах служит хорошим признаком их золотоносности.
К данной группе относятся сульфоарсениты и сульфоантимониты серебра типа Ag3XS3, где X = As и Sb.
Из них более распространены в природе изоструктурные прустит и пираргирит. Несмотря на то что оба минерала имеют аналогичные химические формулы и кристаллизуются в одном виде симметрии, все же, судя по данным химических анализов, они не образуют непрерывного ряда изоморфных смесей. Лишь при высоких температурах, как показывают экспериментальные исследования, оба эти соединения неограниченно смешивают друг с другом.
Здесь же кратко опишем редкие сульфосоли серебра — стефанит и полибазит.
ПРУСТИТ — Ag3AsS3. Назван по фамилии химика Пруста, впервые установившего, что существуют раздельно мышьяковая и сурьмяная «красные серебряные руды».
Химический состав. Ag — 65,4 %, As — 15,2 %, S — 19,4 %. По имеющимся анализам, содержание Ag колеблется в пределах 63,4–67,6 %, As — 12,3–20,2 % и S — 13,1–20,2 %.
Сингония тригональная; дитригонально-пирамидальный в. с. L33Р. Пр. гр. R3с (C 63v). a0 = 10,77; с0 = 8,67. Кристаллическая структура характеризуется тем, что группы AsS3 занимают каждый угол ромбоэдрической ячейки и центр. Каждая такая группа представлена низкой пирамидой с вершиной As. Вершины всех пирамид направлены вдоль тройной оси, при этом пирамиды, не будучи связаны непосредственно между собой, образуют вертикальные колонки, соединенные между собой катионами серебра. Последние в свою очередь образуют вертикальные спиральные цепочки, чередуясь через один с анионами S2-, благодаря чему серебро имеет координацию 2 + 2 по причине смещения его из центра S2-4 -тетраэдра в направлении одного из ребер. В целом структуру можно охарактеризовать как островную субцепочечную. Облик кристаллов. Нередко встречается в кристаллах псевдоскаленоэдрического облика с острыми псевдоромбоэдрическими гранями (рис. 131). Главнейшие формы: гексагональная призма {110}, дитригональные пирамиды {21
1}, {11
4} и др. На гранях призмы характерна косая штриховка. Чаще наблюдается в виде вкрапленных зерен, иногда в сплошных массах. Цвет прустита ярко-красный (подобен цвету киновари). Черта ярко-красная, зеленеющая при растирании. Полупрозрачен. Блеск сильный алмазный. Для Li-света: Nm = 3,088, Np = 2,792.
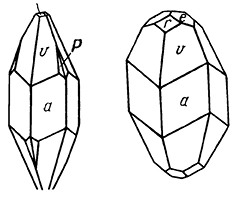
Рис. 131. Кристаллы прустита:
a {1020}, v {2131}, r {1011}, e {0112}, p {1562}, u {1014}
Твердость 2–2,5. Хрупок. Спайность отчетливая по {1011}. Излом раковистый. Уд. вес 5,57–5,64. Прочие свойства. Электричество не проводит.
Диагностические признаки. По внешним признакам очень трудно отличим от пираргирита. Как правило, несколько светлее, чем пираргирит. Кристаллы менее богаты гранями, чем кристаллы пираргирита. Главное отличие между ними все же в содержаниях As и Sb.
Из других минералов по цвету и блеску на прустит похожи: миаргирит (AgSbS2), киноварь, куприт (Сu2О) и цинкит (ZnO). Миаргирит, если встречается не в кристаллах, от прустита можно отличить по меньшей прозрачности, а от пираргирита — только по соотношению S : Sb, которое можно установить в результате химического анализа. Киноварь легко отличается по поведению п. п. тр. (улетучивается полностью). Для куприта характерны октаэдрические кристаллы, буровато-красная черта, а также парагенезис с самородной медью и другими минералами меди. Цинкит обладает оранжево-желтой чертой и повышенной твердостью (4–4,5).
П. п. тр. легко плавится, издает запах мышьяка и образует налет As2О3 и Sb2O3 (в случае присутствия сурьмы). Королек при добавлении соды в восстановительном пламени дает серебро. В HNO3 растворяется с выделением S и As2O3 (для пираргирита Sb2O3).
Происхождение и месторождения. Распространен в гидротермальных жилах свинцово-цинково-серебряных руд (так называемой благородной кварцево-кальцитовой формации). Встречается среди минералов, образующихся в последних стадиях гидротермальных процессов, иногда совместно с пираргиритом. В парагенезисе с этими минералами очень часто встречается галенит, иногда самородное серебро, а также различные по составу сульфоарсениты и сульфоантимониты свинца, серебра и меди. В некоторых месторождениях они ассоциируют с арсенидами никеля и кобальта.
В зоне окисления прустит и пираргирит разлагаются, иногда с образованием самородного серебра и аргентита. Обычно же серебро в виде неустойчивого Ag2SO4 способно мигрировать, особенно в присутствии свободной серной кислоты и сульфата окиси железа. В ряде случаев устанавливается обогащение серебром нижних горизонтов зоны окисления месторождений.
Среди свинцово-цинковых месторождений России прустит, так же как и пираргирит, наблюдается сравнительно редко, главным образом в микроскопических выделениях, устанавливаемых в полированных шлифах. Наиболее часто они встречаются в ряде свинцово-цинково-серебряных месторождений Западного Верхоянья (Якутия) — в Безымянском, Верхне-Эндыбальском, Березинском и др.
Из иностранных месторождений наиболее богаты ими месторождения Мексики (Цакатекас, Гуанахуато и др.), Чили, Перу, Боливии и др.
Практическое значение. Прустит и пираргирит принадлежат к числу наиболее широко распространенных серебросодержащих минералов и потому имеют значение как источники серебра. При плавке галенитовых концентратов, получаемых из свинцово-цинковых руд, серебро получается попутно.
ПИРАРГИРИТ — Ag3SbS3. Название происходит от греч. пирос — огонь и аргирос — серебро. Синонимы: темно-красная серебряная руда, серебряная обманка (рис. 132).
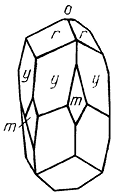
Рис. 132. Кристалл пираргирита:
o {0001}, r {1011}, m {1010}, y {3251}
Физические свойства этого минерала во многом аналогичны описанным выше для прустита. Отметим отличительные особенности. Цвет в отраженном свете темно-красный до железно-черного; на углах кристаллов и в обломках пираргирит просвечивает. Черта темная вишнево-красная. Уд. вес 5,77–5,86 (больше, чем прустита). Прочие диагностические признаки указаны выше (см. прустит).
В природе встречается в тех же условиях, что и прустит, но преимущественно с содержащими сурьму минералами.
СТЕФАНИТ — Ag5SbS4 или 5Ag2S . Sb2S3. Содержание Ag — 68,5 %. Сингония ромбическая; ромбо-пирамидальный в. с. L2PC. a0 = 7,72; b0=12,34; с0 = 8,50. Пр. гр. Сmс21 (C122v). Встречается в короткопризматических кристаллах и сплошных массах.
Цвет серовато-черный. Черта черная. Блеск металлический. Твердость 2–2,5. Хрупкий. Спайность по {010} средняя. Уд. вес 6,2–6,3.
П. п. тр. на угле плавится с растрескиванием, образуя налет Sb2O3. С содой дает королек серебра. Разлагается разбавленной HNO3 с выделением S и Sb2S3.
Вместе с другими минералами серебра, обычно в очень небольших количествах, встречается в жилах гидротермального происхождения. Описан в месторождениях Саксонии и Гарца (Германия), в ряде месторождений Мексики и в других местах.
ПОЛИБАЗИТ — (Ag,Cu)16Sb2S11 или 8(Ag,Cu)2S . Sb2S3. Содержание Ag — 62,1–74,9 %, Сu — 3–10 %. Сингония моноклинная; призматический в. с. L2PC. a0 = 26,17; b0=15,11; с0 = 23,89, β = 90°. Пр. гр. С2/m (C32h). Наблюдается в пластинчатых или короткопризматических кристаллах псевдотригонального или псевдогексагонального облика.
Цвет серовато-черный. Черта черная с красноватым оттенком. Блеск металлический. Твердость 2–3. Спайность по {001}. Уд. вес 6,27–6,33.
П. п. тр. на угле очень легко плавится в металлический шарик с выделением дыма и налета Sb2S3. При сплавлении с фосфорнокислой солью дает зеленовато-синий перл (медь).
Вместе с другими сульфосолями серебра встречается в низкотемпературных гидротермальных жилах в ряде районов: Яхимов и Пршибрам (Чехия), Банска-Штьявница (Словакия), Цакатекас, Гуанахуато и Дуранго (Мексика) и других местах.
Относящиеся сюда соединения представлены главным образом сульфоарсенитами, сульфоантимонитами и сульфовисмутитами свинца. Все эти соединения ведут себя обособленно от сульфосолей меди и серебра, лишь иногда образуя с ними двойные соединения.
Мы рассмотрим только два минерала — буланжерит и джемсонит.
БУЛАНЖЕРИТ — Pb5Sb4S11 или 5PbS . 2Sb2S3.
Химический состав. Рb — 55,4 %, Sb — 25,7 %, S — 18,9 %. Содержание Рb колеблется в пределах 54—58 %; часть его бывает связана с механической примесью галенита. Иногда содержит медь до 1 %.
Сингония моноклинная; призматический в. с. L2PC. Пр. гр. P21/a (С 52h). Кристаллы крайне редки. Обычно встречается в тонкозернистых или спутанно-волокнистых агрегатах.
Цвет буланжерита свинцово-серый до железно-черного. Черта серовато-черная с коричневатым оттенком. Непрозрачен. Блеск металлический.
Твердость 2,5–3. Хрупок. Спайность по {100} средняя. Уд. вес 6,23.
Диагностические признаки. Обычно бывают характерны тонковолокнистые агрегаты и коричневатый оттенок черты. Без данных химического анализа и рентгеновских исследований невозможно с уверенностью отличить от ряда других, более редко встречающихся сульфоантимонитов свинца.
П. п. тр. легко плавится. С содой на угле дает королек свинца и плотный белый налет Sb2O3 вблизи пробы. Растворяется в HNO3 и горячей НСl.
Происхождение и месторождения. Встречается в гидротермальных месторождениях свинцово-цинковых руд в сопровождении сульфоантимонитов свинца и меди, галенита, сфалерита, пирита, арсенопирита и др.
Отмечался в ряде месторождений Нерчинского района в Восточном Забайкалье: Алгачинском (в значительных количествах), Кличкинском, Дарасунском и др. В альпийских хрусталеносных жилах Приполярного Урала отмечен в виде игольчатых вростков в кварце. Встречается в Нагольном кряже (Украина) в ассоциации со сфалеритом, галенитом, бурнонитом, блеклой рудой и другими минералами.
В зоне окисления легко разрушается, образуя церуссит Pb[CO3] и гидроокислы сурьмы.
Практическое значение. В случае значительных скоплений представляет интерес как свинцовая руда.
ДЖЕМСОНИТ — Pb4FeSb6S14 или 4PbS . FeS . 3Sb2S3. Разновидность, не содержащая железа, носит название плюмозита.
Химический состав не всегда точно отвечает формуле. Содержит Рb — 40–50 %, Fe — до 10 %, Sb — около 30 %, S — около 20 %. В виде примеси часто присутствуют медь, цинк и серебро.
Сингония моноклинная; призматический в. с. L2PC. Пр. гр. P21/a (С 52h). Часто встречается в виде призматических, игольчатых и волосовидных кристаллов, иногда в виде вростков в кристаллах кварца, сфалерита и других, позднее кристаллизующихся минералов в друзовых пустотах.
Цвет джемсонита свинцово-серый. Черта серовато-черная. На гранях иногда наблюдается синевато-серая побежалость. Блеск металлический.
Твердость 2–3. Хрупкий. Излом неровный. Спайность по {001} средняя. Уд. вес 5,5–6.
Диагностические признаки. На глаз невозможно отличить от других сульфоантимонитов свинца, встречающихся в игольчатых формах. В случае параллельно-шестоватых агрегатов распознается благодаря базальной спайности, перпендикулярной к направлению развития индивидов. Для точной диагностики необходимы химический анализ и рентгеновские исследования.
П. п. тр. плавится. На угле получается королек свинца. С содой дает белый налет Sb2O3. В HNO3 легко растворяется.
Происхождение и месторождения. В России встречается в Саввинском месторождении (Забайкалье), в гидротермальных свинцово-цинковых рудах в ассоциации с кварцем, галенитом, иногда сфалеритом и другими минералами, в друзовых пустотах. Описан также в Дарасунском золоторудном месторождении (Забайкалье).
На Украине джемсонит известен в полиметаллических жилах Нагольного кряжа в ассоциации с кальцитом и в других местах. Из месторождений стран дальнего зарубежья в значительных количествах был встречен в Цимапане (Мексика).

