Общие замечания. В этом классе мы встречаем уже весьма значительное число минеральных видов, многие из которых пользуются сравнительно широким распространением в природе. Особенно это относится к Са[СО3], который нередко слагает огромные толщи осадочно-морского происхождения. Часто карбонаты являются также спутниками рудных минералов в месторождениях, а в ряде случаев сами представляют промышленный интерес как источники ряда важных металлов, например марганца (в виде родохрозита) и железа (в виде сидерита).
Анион [СО3]2– способен давать более или менее устойчивые соединения с катионами двухвалентных металлов, обладающими средними и большими ионными радиусами. Число таких металлов невелико. Главнейшие из них Mg, Fe, Zn Mn, Ca, Sr, Pb, Ba, а также Cu, Zn, Mn и др. с дополнительными анионами [ОН]1– и Cl1–.
Близкие к ним по размерам одновалентные катионы (Na, К, NH4) могут образовывать безводные карбонаты лишь при условии, что вместе с ними в кристаллическую структуру входит катион Н1+, т. е. в виде кислых солей. Водные карбонаты характерны и для катиона Mg2+, вообще склонного к гидратации в водных средах.
Карбонаты трехвалентных металлов известны для редких земель с дополнительным анионом F1–. Из числа малых трехвалентных катионов в карбонатах изредка встречается лишь Аl3+ и то в виде двойных и притом водных солей в сочетании с двухвалентными металлами (Cu, Pb).
Карбонатов четырех- и пятивалентных металлов не существует. Шестивалентный уран дает редкий безводный карбонат с добавочным анионом О2– — UO2(CO3) (рёзерфордит). Остальные известные карбонаты урана являются водными.
Из особенностей физических свойств карбонатов отметим следующие. Твердость безводных карбонатов никогда не бывает высокой. Обычно она колеблется от 3 до 5. Растворимость карбонатов в воде повышенная. Особенно это свойственно карбонатам щелочей и бикарбонатам тех элементов, катионы которых обладают либо относительно малыми ионными радиусами (например, Mg2+, Co2+), либо, наоборот, очень большими размерами (например, Ва2+). Карбонат Cu2+ встречается только в виде основных солей, что связано, очевидно, с особенностями строения самого катиона. Этим же, вероятно, объясняется и интенсивная окраска карбонатов меди в зеленый и синий цвета. Все остальные карбонаты либо бесцветны, либо окрашены в бледные тона. Из оптических свойств для карбонатов очень характерным является весьма высокое двупреломление (Ng–Np), обусловленное плоской формой аниона СО3.
Среди минералов этого класса мы прежде всего должны различать безводные и водные карбонаты. Среди тех и других выделим соответствующие группы по типам изоструктурных химических соединений. Остальные карбонаты, представленные единичными минеральными видами, сгруппируем по катионам.
Это семейство включает большое число минеральных видов, представляющих карбонаты двухвалентных металлов, образующих следующий морфотропный ряд (в порядке возрастания ионных радиусов): Mg, Zn, Fe2+, Mn2+, Ca, Sr, Pb и Ba. Характерно, что ионы с меньшим радиусом, чем Са, образуют широкие изоморфные ряды минералов, кристаллизующихся в тригональной сингонии, а ионы с большим радиусом, чем у Са, образуют карбонаты ромбической сингонии. Карбонат самого кальция является диморфным, т. е. может кристаллизоваться в той и другой сингониях.
|
Карбонаты: |
||||||||
|
тригональной сингонии |
Mg |
Zn |
Fe2+ |
Mn2+ |
Ca |
|||
|
0,74 |
0,83 |
0,80 |
0,91 |
1,04 |
||||
|
ромбической сингонии |
Ca |
Sr |
Pb |
Ba |
||||
|
1,04 |
1,20 |
1,26 |
1,38 |
|||||
Кристаллическая структура тригональной модификации Са[СО3] изображена на рисунках 208 и 209.
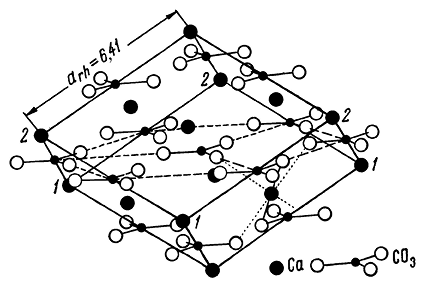
Рис. 208. Расположение ионов в ячейке спайного ромбоэдра {1011}.
Оба вида ионов располагаются как в гранецентрированных структурах
Если кубическую структуру NaCl сдавить вдоль тройной оси настолько, что углы между гранями станут равными 101°55′, то получится ромбоэдрическая гранецентрированная структура кальцита (см. рис. 209), причем ионы Са займут места Na, а группы [СО3] — места Cl. Таким образом, упаковка ионов в кальците отвечает несколько искаженной упаковке, произведенной по способу плотнейшей кубической кладки структурных единиц.
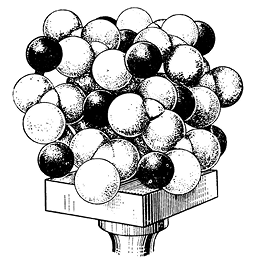
Рис. 209. Модель кристаллической структуры кальцита.
Черные шарики — катионы кальция; светлые треугольники — анионы СО3
Кристаллическая структура арагонита — ромбической модификации Са[СО3] — от структуры кальцита отличается лишь тем, что ионы Са2+ и [CO3]2– упакованы по способу плотнейшей гексагональной кладки (рис. 210). Этим обстоятельством обусловливается наблюдающаяся псевдогексагональная симметрия тройников кристаллов (углы между гранями призмы в единичных кристаллах лишь немного отличаются от 60 и 120°). В отличие от структуры кальцита в структуре арагонита каждый ион [СО3]2– окружен девятью ионами кальция. Насколько можно судить по разнице удельных весов, кристаллическая структура арагонита более плотна, чем структура кальцита.
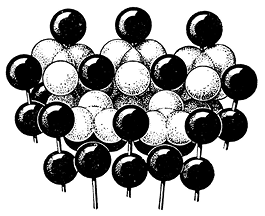
Рис. 210. Модель кристаллической структуры арагонита
Другой характерной особенностью минералов группы кальцита является склонность к образованию изоморфных смесей и двойных солей. В кальцитовом ряде, как и следовало ожидать согласно соотношениям размеров ионных радиусов катионов, широко замещают друг друга Mg, Zn и Fe2+.
Точно так же карбонаты Fe2+ и Mn2+ образуют непрерывный ряд изоморфных смесей. Что касается Са, то этот элемент в силу существенного отличия величины его ионного радиуса от предыдущих катионов (за исключением Mn2+) может образовывать лишь двойные соли с ними. Ионы кальция и магния (или другие малые катионы) в кристаллических структурах располагаются попеременно вдоль тройной оси. Благодаря этому симметрия двойных солей кальцитового ряда несколько снижается: вместо дитригонально-скаленоэдрического вида симметрии (L363L23PC) имеем ромбоэдрический (L36C), т. е. исчезают двойные оси, проходящие через центральный ион углерода и кислородные ионы, с ним связанные.
В этом семействе будут рассмотрены простые и двойные тригональные (ромбоэдрические) карбонаты, которым отвечают группы кальцита и доломита, а также простые ромбические карбонаты (группа арагонита). Сюда же условно включен паризит, являющийся карбонатом кальция и редких земель с участием дополнительного аниона F1– и имеющий полисоматическое строение.
КАЛЬЦИТ — Са[СО3]. Синоним: известковый шпат. Разновидности по изоморфным примесям представлены очень широко. Из разновидностей по физическим признакам следует упомянуть об исландском шпате — бесцветной прозрачной разности кальцита.
Химический состав. CaO — 56 %, СО2 — 44 %. Примеси Mg, Fe, Mn (до 8 %), гораздо реже Zn (до 2 %), Sr (стронциокальцит) и др.
Сингония тригональная; дитригонально-скаленоэдрический в. с. L36L23PC. Пр. гр. R3–c(D63d). а0 = 4,98; с0 = 17,02. Кристаллическая структура, как типическая, описана выше. Облик кристаллов, встречающихся исключительно в пустотах, может быть самым разнообразным. Наиболее часто встречаются скаленоэдрические кристаллы (рис. 211), реже таблитчатые (рис. 212) или пластинчатые, призматические или столбчатые, ромбоэдрические — чаще в виде острых, чем тупых ромбоэдров (рис. 213).
Рис. 211. Скалено-эдрический кристалл кальцита
Рис. 212. Таблитчатый кристалл кальцита
Рис. 213. Ромбоэдрические кристаллыкальцита
Число установленных на кристаллах простых форм достигает нескольких сотен. Чаще всего встречаются грани призмы {100}, ромбоэдров {10
1} (спайный ромбоэдр), {01
2}, {02
1}, {40
1} скаленоэдра {21
1}, пинакоида {0001} и др. Обычно двойниковой плоскостью является плоскость пинакоида (0001) (рис. 214) или грань тупого ромбоэдра (01
2), по которой нередко образуются полисинтетические двойники в мраморах и смятых известняках (такое двойникование может быть получено искусственно при давлении острия ножа на ребро выбитого по спайности осколка кальцита). Реже такой плоскостью является грань спайного ромбоэдра (10
1) (рис. 215) и др.
Рис. 214. Двойник кальцита по (0001)
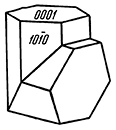
Рис. 215. Двойник кальцита по (101)
Агрегаты. Друзы кристаллов кальцита вместе с другими минералами наблюдаются, как уже указано, в пустотах. Довольно часто встречаются крупнозернистые агрегаты прозрачного или полупрозрачного кальцита с совершенной спайностью отдельных зерен, бросающейся в глаза. Редко наблюдается жилковатый с шелковистым блеском асбестовидный кальцит (атласный шпат), волокна которого располагаются перпендикулярно стенкам трещин в породах. Широко известны «натечные» образования кальцита в виде сталактитов и сталагмитов в пещерах среди известняков. Зернистые сплошные агрегаты в больших плотных массах называются мраморами. Плотные скрытокристаллические разности кальцитовых горных пород, нередко слоистых и богатых фауной, носят название известняков. Рыхлые известняки, содержащие мельчайшие раковинки фораминифер, известны под названием мела. Встречаются также оолитовые известняки — «икряной камень». «Известковым туфом», или травертином, называют ноздреватые образования углекислого кальция, возникающие в местах выхода как холодных, так и горячих насыщенных известью минеральных источников (кальцит в этих случаях образуется при перекристаллизации выпавших коллоидов СаСО3 или арагонита). Иногда в связи с отложением углекислой извести из горячих источников образуются замечательные по рисунку тонкополосчатые полупрозрачные плотные разности, известные под названием «мраморного оникса», впрочем, подобные образования бывают связаны и с холодноводными процессами (карст).
Цвет. Большей частью бесцветный или молочно-белый, но иногда окрашен примесями в различные (обычно светлые) оттенки серого, желтого, розового, красного, бурого и черного цветов. Блеск стеклянный. Nт = 1,658 и Np = 1,486.
Твердость 3. Хрупок. Спайность совершенная по {101}. Уд. вес 2,6–2,8, для химически чистых кристаллов 2,72 при 23 °С. Прочие свойства. При сжатии, сопровождающемся двойникованием, электризуется. Образцы некоторых месторождений обнаруживают явление люминесценции.
Диагностические признаки. В крупнокристаллических разностях легко узнается по ромбоэдру спайности, сравнительно низкой твердости (легко царапается острием ножа или иглы) и бурному выделению CO2 от капли HCl, положенной на минерал или на его порошок на предметном стекле.
П. п. тр. растрескивается с выделением СО2, т. е. диссоциирует на CaO и CO2. Образующаяся при этом CaO ярко светится и окрашивает пламя в оранжевый цвет. В разбавленной соляной кислоте легко растворяется даже на холоде с шипением (выделение СО2).
Происхождение и месторождения. Кальцит принадлежит к числу самых распространенных в земной коре минералов, слагая иногда целые массивы (известняковые горы). Этот минерал образуется при самых различных геологических процессах.
1. Среди эндогенного кальцита заслуживает внимания кальцит карбонатитов — существенно кальцитовых пород, содержащих форстерит, флогопит, пироксены, иногда магнетит и почти всегда минералы редких металлов: бадделеит, пирохлор, перовскит и др. Карбонатиты пространственно и генетически сопряжены с щелочными и ультраосновными породами, образуя комплексы массивов центрального типа. Происхождение по крайней мере части карбонатитов — магматическое, но, вероятно, возможно и метасоматическое их образование.
2. Широко распространены кристаллические образования кальцита гидротермального происхождения. В значительных количествах он образуется в контактово-метасоматических месторождениях путем переотложения или перекристаллизации известняков. В пегматитах он является одним из самых последних минералов, характеризующих гидротермальную стадию процесса. Характерно, что и в многочисленных рудоносных, главным образом сульфидных, жильных месторождениях кальцит, как правило, кристаллизуется одним из последних минералов.
К этой же категории образований принадлежат выделения кристаллического кальцита в миндалинах и жеодах среди эффузивных изверженных пород и отложения арагонита и кальцита из некоторых минеральных источников в виде «известковистого туфа» (вследствие бурного выделения из них СО2 под влиянием резкого понижения внешнего давления).
3. При процессах выветривания кальцит хотя и не встречается в больших скоплениях, однако в виде новообразований наблюдается довольно часто в трещинах и пустотах зон окисления рудных месторождений и горных пород. Источником для него в этих случаях служат разлагающиеся в коре выветривания эндогенные известьсодержащие минералы и углекислота воздуха. Нужно заметить, что вообще-то в процессе выветривания горных пород весьма значительные массы извести переходят в растворы в виде бикарбоната, который текучими водами может относиться очень далеко, вплоть до моря, если по пути следования не будут встречены условия, заставляющие его выпадать в виде кристаллического или коллоидного карбоната Са[СО3].
Сталактитовые образования в известняковых гротах являются результатом выпадения углекислой извести из насыщенных медленно просачивающихся к полым пространствам растворов. Эти растворы при нависании в виде капель с потолка путем испарения теряют воду, сильно пересыщаются и выделяют коллоидные или тонкодисперсные осадки в виде натечных масс, постепенно твердеющих и раскристаллизовывающихся при дальнейшей дегидратации.
4. Осадочным путем, особенно в морских бассейнах, образуются огромные массы Са[СО3], первоначально в виде известковистых илов, отмерших морских растений и беспозвоночных животных с известковым скелетом. Позднее все эти вещества превращаются в известняк. Оолитовые известняки, по всей вероятности, образуются путем коагуляции коллоидных растворов углекислой извести вокруг взвешенных в движущейся воде песчинок и газовых пузырьков. Современное образование оолитов в морских бассейнах приурочено к прибрежным мелководным зонам тропических и субтропических морей. Первоначально эти оолиты бывают сложены арагонитом, позднее превращающимся в кальцит.
Каким бы путем ни образовался кальцит, в коре выветривания он является сравнительно слабоустойчивым минералом. Благодаря легкой растворимости в кислотах он в зоне элювия, особенно в зонах окисления рудных сульфидных месторождений, переходит в растворы. При реакциях обменного разложения часто наблюдается замещение кальцита другими минералами (гипсом, доломитом, смитсонитом, малахитом и др.):
H2SO4 + СаСО3 + Н2О = CaSO4 . 2Н2О + СО2;
ZnSO4 + СаСО3 + 2Н2О = ZnCO3 + CaSO4 . 2H2O и т. д.
На поверхности известняков в зоне насыщенных известью грунтовых вод не только часто наблюдается отложение коагулятов гидроокислов железа, коллоидного кремнезема и др., но и сами известняки замещаются ими.
Крупные кристаллы прозрачного кальцита (исландского шпата) у нас в России известны в месторождениях по р. Нижней Тунгуске, приуроченных к эффузивным породам — траппам и мандельштейнам; здесь он совместно с пренитом и целлитами залегает в виде жил и гнезд с гигантскими размерами монокристальных индивидов. Так, месторождение Разлом известно кристаллами до полуметра, а Люку-Мункамбинское — до 2 м.
Многочисленные небольшие месторождения исландского шпата широко представлены в Средней Азии в Зеравшано-Гиссарском, Пскем-Угамском и других районах. Из иностранных месторождений наибольшей известностью пользуются крупнейшие месторождения Исландии среди эффузивных изверженных пород и др.
Мел в виде горных пород широко распространен в толщах карбонатных пород мелового возраста на территории Русской платформы и в других местах России. В больших масштабах он добывается главным образом для химической и цементной промышленности в районе Белгорода, близ Славянска, Краматорска (Донбасс, Украина) и в других местах.
Мраморы, отличающиеся красивыми расцветками, добываются в качестве облицовочных камней на Урале в Уфалейском, Златоустовском и других районах, в Карелии, Забайкалье и т. д. Месторождения оникс-мрамора желтоватых и зеленоватых расцветок известны в Закавказье на территории Грузии и Армении.
Из иностранных месторождений высококачественными мраморами славятся месторождения Каррары на восточном берегу Генуэзского залива (Италия) и Греции, служившие в свое время материалом для замечательных античных скульптур.
Практическое значение кальцита, особенно в виде горных пород, весьма разнообразно.
1. Исландский шпат благодаря высокому двупреломлению употребляется для изготовления различных оптических поляризационных приборов, главным образом николей для микроскопов, поляриметров, колориметров и др.; для этой цели пригодны бесцветные идеально прозрачные недвойникованные кристаллы или их обломки, лишенные трещин, размерами не меньше 1,5–2 см.
2. Асбестовидный атласный шпат и оникс-мрамор используются для ювелирных изделий и предметов искусства.
3. Известняки, в зависимости от их состава или физико-механических свойств, потребляются: а) химической промышленностью (чистые известняки) для получения необходимой в сельском хозяйстве извести, производства сахара, соды, едкого натра, хлорной извести и пр. с одновременным получением при обжиге жидкой или твердой углекислоты; б) металлургической промышленностью (бедные фосфором и серой известняки) как флюс при плавке руд в доменных печах; в) для приготовления различных сортов цемента — гашеной извести, портланд-цемента, роман-цемента и др.; г) в полиграфической промышленности, в которой применяются так называемые литографские камни, т. е. особые плотные скрытозернистые известняки с раковистым изломом, способные раскалываться на тонкие плиты.
4. Мраморы в полированном виде используются как строительный материал для облицовки стен внутренних помещений в зданиях, как материал для скульптурных работ, а также в электротехнике (распределительные щиты и др.).
5. Мел употребляется как пишущий красочный, полировальный материал, для производства цемента, в лакокрасочной, парфюмерной (зубной порошок), резиновой (наполнитель) и других отраслях промышленности.
АРАГОНИТ — Са[СО3]. Назван по местности Арагония (Испания), где был впервые установлен.
Химический состав такой же, как у кальцита: CaO — 56 %, СО2 — 44 %. Часто содержит примеси: Sr (до 5,6 %), Mg, Fe и Zn.
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Pmcn(D162h). а0 = 4,94; b0 = 7,94; с0 = 5,72. Кристаллическая структура (см. выше). Облик кристаллов призматический, часто псевдогексагональный, игольчатый. Форма головки кристаллов бывает долотчатой (рис. 216).
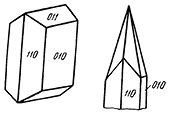
Рис. 216. Призматический и игольчатый кристаллы арагонита
Главные формы: призма {110}, пинакоиды {010} и {001}. Последний бывает покрыт штрихами параллельно оси а. Нередко встречаются следующие формы: призма {011}, заостряющая кристаллы наподобие долота, дипирамида {111}, в некоторых случаях очень острые дипирамиды в комбинации с призмами, вследствие чего кристаллы принимают копьевидную форму (рис. 216). Двойники часто наблюдаются по (110). Распространены также тройники псевдогексагонального облика (рис. 217 и 218), четверники и сложные полисинтетические двойники. При этом обычно образуются между гранями призм входящие углы в виде желобков. Несдвойникованные кристаллы очень редки. Агрегаты часто представлены шестоватыми, радиально-лучистыми и звездчатыми срастаниями индивидов. Наблюдается также в виде кристаллических корок, натечных, шаровидных форм и в массах оолитового строения («гороховые» и «икряные камни»). Очень оригинальны встречающиеся иногда пещерные образования в виде переплетенных и ветвящихся «стеблей» снежно-белого цвета (рис. 219).
Рис. 217. Арагонит. Тройник прорастания по (110)
Рис. 218. Границы срастаний индивидов в поперечном разрезе
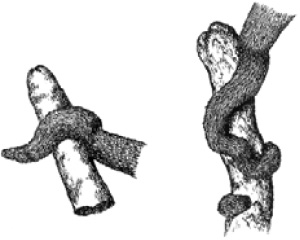
Рис. 219. Арагонитовые геликтиты огибают препятствие
(сталагмиты кальцита). Пещера «Зеленая», Хайдаркан (Киргизия).
Рисунок В. Слетова (с обложки I выпуска альбома «Рисуя минералы...»)
Наконец, внутренние перламутровые части большинства раковин моллюсков построены из тончайших пластинок арагонита, параллельных поверхности раковины. Как известно, попадающие внутрь раковины песчинки или другие посторонние тела облекаются слоями аналогичной углекислой извести с примесью органического вещества, в результате чего образуются желваки жемчуга.
Цвет арагонита белый, желтовато-белый, иногда светло-зеленый, фиолетовый и серый. Отдельные кристаллы часто прозрачны и бесцветны. Блеск стеклянный, в изломе жирный. В катодных лучах светится слабым бледно-фиолетовым, иногда оранжевым цветом. Ng = 1,686, Nm = 1,681 и Np = 1,530.
Твердость 3,5–4. Хрупок. Спайность ясная по {010} и едва заметная по {110} и {011}. Излом часто раковистый. Уд. вес 2,9–3 (больше, чем у кальцита, что свидетельствует о более плотной упаковке атомов). Прочие свойства. При обычной температуре неустойчив; в присутствии растворителя медленно переходит в кальцит, почему и не встречается в более древних осадках. При повышении температуры до 400 °С этот переход совершается быстро. Любопытно, что разности арагонита, не претерпевшие полиморфного превращения в кальцит, содержат более крупные ионы стронция (до нескольких процентов), что, по мнению Р. Ж. Гаюи и Н. В. Белова, оказывает, очевидно, стабилизирующее влияние на устойчивость этой модификации. В воде более растворим, чем кальцит.
Диагностические признаки. По цвету и поведению в HCl очень похож на кальцит, но отличается от него отсутствием спайности по ромбоэдру и обликом кристаллов с характерными, иногда тонкими желобками на гранях призмы и повышенной твердостью. Похожие на него цеолиты (водные силикаты Na, Ca и др.) не выделяют в соляной кислоте СО2. Витерит и стронцианит имеют больший удельный вес и плавятся перед паяльной трубкой.
П. п. тр. ведет себя так же, как кальцит. В кислотах разлагается с бурным выделением углекислоты. Порошок арагонита (так же как и стронцианита и витерита) в растворе азотнокислого кобальта при кипячении становится лиловым (реакция Мейгена), тогда как порошок кальцита почти не изменяется или окрашивается в синеватый или зеленоватый цвет, и то лишь при долгом кипячении.
Происхождение и месторождения. Арагонит в природе распространен гораздо реже, чем кальцит. Как один из самых низкотемпературных минералов, он довольно часто образуется при затухающих гидротермальных процессах. Таковы, например, его находки в трещинах среди серпентинизированных ультраосновных пород вне всякой связи с поверхностными процессами. К таким же образованиям относятся находки мелких игольчатых кристалликов арагонита в пустотах, среди не затронутых разложением базальтов, изредка в мраморах, лавах вулканов, отложениях из горячих, пересыщенных Са[СО3] минеральных источников в виде известкового туфа или оолитов («гороховый камень» карлововарских источников в Чехии) и др.
Однако в главной массе арагонит образуется при различных экзогенных процессах, часто при участии в них растворенных магнезиальных солей. В виде радиально-лучистых образований и натечных форм, нередко крупных размеров, он широко распространен в коре выветривания ультраосновных магнезиальных изверженных пород в ассоциации с доломитом, гипсом, глинистым веществом и другими минералами экзогенного происхождения. Наблюдается в пустотах среди бурых железняков в виде наросших мелких кристалликов и в виде «железных цветов», например в Бакальском месторождении (Южный Урал), в гипсоносных толщах, месторождениях самородной серы и др.
МАГНЕЗИТ — Mg[СО3]. Магнезия — область в Фессалии (Греция). Минерал известен с глубокой древности. Синоним: магнезиальный шпат.
Химический состав. MgO — 47,6 %, СО2 — 52,4 %. Из изоморфных примесей наиболее часто устанавливается Fe, иногда Mn, Са.
Сингония тригональная; дитригонально-скаленоэдрический в. с. L36 L23РС. Пр. гр. та же, что и кальцита. а0 = 4,584; с0 = 14,92. Кристаллическая структура та же, что у кальцита. Облик кристаллов обычно ромбоэдрический. Чаще распространен в виде крупнозернистых агрегатов (рис. 220). Для месторождений выветривания чрезвычайно характерны фарфоровидные скрытокристаллические массы, нередко напоминающие по форме цветную капусту.

Рис. 220. Мрамороподобный зернистый агрегат магнезита.
Саткинское месторождение (Южный Урал)
Цвет магнезита белый с желтоватым или сероватым оттенком, иногда снежно-белый. Блеск стеклянный, в скрытокристаллических агрегатах — восковой. Nm = 1,700 и Np = 1,509.
Твердость 4–4,5. Хрупок. Спайность совершенная по ромбоэдру {101}. Для плотных фарфоровидных разностей характерен раковистый излом с матовой поверхностью. Уд. вес 2,9–3,1.
Диагностические признаки. В кристаллических разностях, как и все карбонаты кальцитового ряда, отличим от других минералов по ромбоэдрической спайности. Внутри ряда его труднее всего отличить от доломита, анкерита и других карбонатов; приходится прибегать к оптическим и химическим исследованиям.
П. п. тр. растрескивается, но не плавится. Пламя не окрашивает. В кислотах растворяется лишь при нагревании. Капля HCl на холоде не вскипает. В горячих кислотах растворяется.
Происхождение и месторождения. Магнезит по сравнению с кальцитом в природе распространен значительно реже, но встречается иногда в больших сплошных массах, представляющих промышленный интерес.
Часть таких скоплений образуется гидротермальным путем. Сюда прежде всего следует отнести весьма крупные месторождения кристаллически-зернистых масс магнезита, пространственно связанных с доломитами и доломитизированными известняками. Как показывает геологическое изучение, эти залежи образуются метасоматическим путем (среди залежей иногда удавалось установить реликты известняковой фауны). Предполагают, что магнезия могла выщелачиваться из доломитизированных толщ осадочного происхождения и отлагаться в виде магнезита горячими щелочными растворами. В парагенезисе с магнезитом изредка встречаются типичные гидротермальные минералы.
Скопления скрытокристаллического («аморфного») магнезита возникают также при процессах выветривания массивов ультраосновных пород, особенно в тех случаях, когда при интенсивном выветривании образуется мощная кора продуктов разрушения. В процессе окисления и гидролиза магнезиальные силикаты под влиянием поверхностных вод и углекислоты воздуха претерпевают полное разрушение. Возникающие при этом труднорастворимые гидроокислы железа скопляются у поверхности. Магний в виде бикарбоната, а также освободившийся кремнезем (в виде золей) опускаются в нижние горизонты коры выветривания. Магнезит, часто обогащенный опалом и доломитом, в виде прожилков и скоплений натечных форм отлагается в сильно выщелоченных трещиноватых пористых серпентинитах в зоне застоя грунтовых вод.
Наконец, находки магнезита с гидромагнезитом (5MgO . 4CO2 . 5H2O), большей частью минералогического значения, наблюдаются среди осадочных соленосных отложений. Образование карбонатов магния связывают с реакцией обменного разложения сульфата магния с Na2[СО3].
Известное Саткинское месторождение кристаллического магнезита гидротермального происхождения находится на западном склоне Южного Урала (в 50 км к юго-западу от Златоуста). Укажем также Савинское месторождение в Ангаро-Илимском районе. Крупные магнезитовые залежи образовались здесь метасоматическим путем среди доломитовой осадочной толщи докембрийского возраста. Аналогичные месторождения известны на Дальнем Востоке, в Корее, Китае, Чехии, Австрии (Вейтш в Альпах, южнее Вены) и в других местах.
К месторождениям, образовавшимся в древней коре выветривания ультраосновных пород, относится Халиловское (Южный Урал).
Практическое значение. В металлургии «намертво» обожженный кристаллический магнезит употребляется для изготовления огнеупорных кирпичей, выдерживающих температуру до 3000 °С. Они идут в кладку нижних частей пода мартеновских печей, конверторов, цементных печей и др. Второй областью применения обожженного магнезита является изготовление так называемого цемента Сореля, используемого в абразивной промышленности (точильные круги) и в строительстве (стойкая штукатурка в смеси с песком, древесными опилками, диатомитом, тальком и другими наполнителями). Употребляется также для производства электроизоляторов, в бумажном, сахарном, резиновом и других производствах.
ДОЛОМИТ — CaMg[CO3]2. Химический состав. CaO — 20,4 %, MgO — 21,7 %, СО2 — 47,9 %. Содержания CaO и MgO часто колеблются в небольших пределах. Изоморфные примеси в дополнение к Mg: Fe2+ при доминировании приводит к другому виду группы доломита — анкериту, иногда Mn2+ (от нескольких процентов до доминирования, в кутногорите), изредка Zn, Ni и Со (в красном доломите из Пршибрама в Чехии содержание Со[СО3] достигало 7,5%). Известны случаи включений в кристаллах доломита битумов и других посторонних веществ.
Сингония тригональная; ромбоэдрический в. с. L36C. Пр. гр. R3– (С 23i). а0 = 4,822; с0 = 16,11 (при отношении Са : Mg = 1 : 1,1). Кристаллическая структура отличается тем, что ионы Са и Mg попеременно чередуются вдоль тройной оси. Облик кристаллов. Часто встречающиеся кристаллы имеют ромбоэдрический облик. В противоположность кальциту широким распространением пользуются ромбоэдры {101}, причем нередки седлообразно изогнутые грани (рис. 221) и сферокристаллы с искривленными поверхностями спайности. Встречаются двойники прорастания и полисинтетические двойники по (02
1). Агрегаты обычно кристаллически-зернистые, часто пористые, реже почковидные, ячеистые, шаровидные и пр.
Рис. 221. Кристалл доломита
с седлообразно изогнутыми гранями
Цвет доломита серовато-белый, иногда с оттенками: желтоватым, буроватым, зеленоватым. Блеск стеклянный. Nm = 1,681–1,695 и Nр = 1,500–1,513. В катодных лучах светится ярким оранжево-красным цветом.
Твердость 3,5–4. Хрупок. Спайность совершенная по ромбоэдру {1011}. Плоскости спайности большей частью искривлены. Уд. вес 1,8–2,9.
Диагностические признаки. Как и другие карбонаты кальцитового ряда, доломит характеризуется спайностью по ромбоэдру. Кристаллы доломита в большинстве случаев также имеют ромбоэдрический облик. В отдельных зернах без данных химического анализа и измерения оптических констант невозможно отличить от анкерита, иногда сидерита. Весьма характерно, что доломит в отличие от кальцита обнаруживает полисинтетическое двойникование не по (012), а по (02
1). В прозрачных шлифах это направление двойникования устанавливается по короткой диагонали ромбов, образуемых трещинами спайности.
П. п. тр. не плавится, растрескивается. Образующаяся CaO окрашивает пламя в оранжевый цвет. Соляная кислота на холоде разлагает доломит очень медленно, без шипения.
Происхождение и месторождения. Доломит наряду с кальцитом является широко распространенным породообразующим минералом.
В типичных жильных гидротермальных месторождениях он встречается гораздо реже кальцита. При переработке гидротермальными растворами доломитизированных известняков нередко образуются крупнокристаллические массы доломита в ассоциации с магнезитом, кальцитом, сульфидами, кварцем и другими минералами.
Главные же массы доломита связаны с осадочными карбонатными толщами всех геологических периодов, но более всего докембрийского и палеозойского возраста. Доломиты в этих толщах нередко слагают целые массивы или переслаиваются с известняками, иногда наблюдаются в виде не совсем правильных залежей, гнезд и т. д.
Вопрос о деталях их происхождения вызывает большие дискуссии. В настоящее время в обстановках морских бассейнов доломит не отлагается, но в геологическом прошлом в ряде случаев доломиты образовывались как первичные осадки в водных соленосных бассейнах, на что указывает ассоциация их с осадками гипса, ангидрита и более растворимыми солями щелочей. В других случаях, бесспорно, имела место доломитизация ранее отложенных осадков углекислого кальция: наблюдаются факты замещения доломитом раковин, кораллов и других известковистых органических остатков.
В зоне выветривания доломиты, медленно растворяясь, разрушаются и превращаются в рыхлую тонкозернистую массу.
Месторождения доломита широко распространены вдоль западного и восточного склонов Урала, в Донбассе, на берегах Волги и в других местах. Главная масса доломитов приурочена к карбонатным толщам докембрийского и пермского возраста. Большой интерес представляют современные процессы доломитообразования в оз. Балхаш (Казахстан), детально изучавшиеся в последнее время Н. М. Страховым.
Практическое значение. Доломиты широко используются для различных целей: 1) в качестве строительного камня; 2) для изготовления вяжущих веществ, термоизоляционного материала в смеси с асбестом и др.; 3) в качестве огнеупорного материала и флюса в металлургии; 4) в химической и в ряде других отраслей промышленности.
АНКЕРИТ — Ca(Fe,Mg)[CO3]2 — описывается отдельно, как широко распространенный минерал. Соотношение между Fe и Mg колеблется в широких пределах, так что может достигаться практически полное отсутствие магния во второй катионной позиции. Содержит также Mn до нескольких процентов. Бедная железом разность называлась бурым шпатом.
Сингония тригональная; ромбоэдрический в. с. Встречается в виде чечевицеобразных кристаллов ромбоэдрического облика, а также в сплошных зернистых массах, обычно среди кварца в гидротермальных месторождениях сульфидных и сидеритовых руд и в гидротермально измененных магнезиально-железистых горных породах.
Цвет анкерита белый, серый, часто с различными оттенками. Блеск стеклянный. Для разности с соотношением Fe : Mg = 3 : 1 (FeO, включая и MnO — 25 % и MgO — 4,8 %): Nm = 1,741 и Np = 1,536.
Твердость 3,5. Уд. вес 2,9–3,1. Спайность по ромбоэдру.
Диагностические признаки. П. п. тр. растрескивается и буреет вследствие окисления железа. В кислотах ведет себя так же, как и доломит. Смоченный на холоде 1%-ным раствором K3Fe(CN)6, подкисленным несколькими каплями HCl, дает светло-синюю пленку турнбулевой сини (отличие от сидерита).
Месторождения. В больших массах встречается редко. В качестве спутника он наблюдается, например, в сидеритовых рудах Бакальского месторождения, в ряде полиметаллических месторождений Алтая, в свинцово-цинковых месторождениях Нагольного кряжа и др. Выделяется обычно обособленно от сульфидов.
СИДЕРИТ — Fe[СО3]. От греч. сидерос — железо. Синоним: железный шпат.
Химический состав. FeO — 62,1 % (Fe — 48,3 %), СО2 — 37,9 %. Из изоморфных примесей чаще всего присутствуют Mg и Mn.
Сингония тригональная; дитригонально-скаленоэдрический в. с. L36L23PC. Пр. гр. R3–c(D63d). a0 = 4,71; с0 = 15,43. Кристаллическая структура аналогична структуре кальцита. Встречающиеся кристаллы чаще имеют ромбоэдрический облик, причем грани ромбоэдра {1011} нередко искривлены, иногда имеют чешуеобразную поверхность, как у доломита, а также седловидные изгибы. Агрегаты обычно кристаллически-зернистые: наблюдается также в шаровидных конкрециях (сферосидерит) со скрытокристаллическим или радиально-лучистым строением. Описаны находки сидерита в землистых массах, натечных, оолитовых и других формах.
Цвет сидерита в свежем состоянии желтовато-белый, сероватый, иногда с буроватым оттенком. При выветривании интенсивно буреет. Блеск стеклянный сильный, до алмазного на плоскостях спайности. Nm = 1,875 и Np = 1,633. В катодных лучах светится ярким оранжево-красным цветом.
Твердость 3,5–4,5. Хрупок. Спайность по {1011} совершенная. Уд. вес 3,9.
Диагностические признаки. Как и всем карбонатам группы кальцита, кристаллическому сидериту свойственна совершенная спайность по ромбоэдру. Характерен алмазный блеск на гранях, характерный коричневатый или оливковый оттенок и признаки поверхностного ожелезнения на выветрелых образцах. Похож на анкерит, от которого уверенно можно отличить по данным химических анализов и кривым нагревания.
П. п. тр. не плавится, растрескивается, буреет, затем чернеет (вследствие окисления железа) и становится магнитным. С бурой и фосфорной солью реагирует на железо, а с содой — на марганец (если он содержится). Холодная HCl действует слабо, но при нагревании очень энергично. Капля ее на куске сидерита постепенно окрашивается в зеленовато-желтый цвет вследствие образования FeCl3. Смоченный 1%-ным раствором красной кровяной соли — K3Fe(CN)6, подкисленным несколькими каплями HCl, дает на поверхности зерна или куска темно-синюю пленку турнбулевой сини (на анкерите при этой реакции образуется светло-синяя пленка).
Происхождение и месторождения. Сидерит как карбонат закиси железа вообще может образоваться лишь в восстановительных условиях. Встречается он в различных генетических типах месторождений.
1. В гидротермальных месторождениях он образуется при сравнительно невысоких температурах. Как спутник, он наблюдается нередко в жильных месторождениях свинцово-цинковых и медных сульфидных руд в ассоциации с пирротином, халькопиритом, железистыми хлоритами, анкеритом и другими минералами. Встречаются также самостоятельные сидеритовые жилы, а в известняках — метасоматические залежи неправильных форм. Кроме редких сульфидов, в них иногда наблюдаются магнетит и гематит.
Большой известностью пользуется Бакальское месторождение кристаллически-зернистых сидеритов, образовавшихся, по всей вероятности, гидротермальным путем в доломитизированных известняках. Аналогичные месторождения распространены в Штирии (Альпы) и на побережье Бискайского залива (Испания). Жильные сидеритовые месторождения известны близ Зигена (Германия) и в других местах.
2. Известны типичные осадочные месторождения сидерита, возникшие в лагунах или заливах морских бассейнов. Образование их, очевидно, связано с восстановительными условиями, господствующими в более глубоководных участках прибрежных зон морей, в обстановке недостатка кислорода и, вероятно, разложения органических остатков с образованием углекислоты и сероводорода за счет белковых веществ. Осадочные сидеритовые руды иногда обладают типичным оолитовым сложением. Сидерит распространен в корах выветривания Михайловского месторождения железистых кварцитов.
Часть руд крупнейшего Керченского осадочного месторождения сложена сидеритами. Возможно, бурые железняки частично произошли за счет окисления этих руд. Из иностранных месторождений отметим довольно крупные залежи плотного глинистого сферосидерита, окрашенного углистыми веществами в темный цвет, среди обширных каменноугольных отложений в Шотландии и Южном Уэльсе (Англия).
В условиях зоны окисления месторождений сидерит неустойчив. На месте сидеритовых залежей легко образуются «железные шляпы», состоящие из лимонита, гётита, иногда гидрогематита как в виде рыхлых, нередко землистых масс, так и в форме твердых жеодовых, часто пустотелых образований.
Практическое значение. В тех случаях когда скопления сидерита обнаруживаются в крупных массах и содержат мало вредных примесей (фосфора, серы и др.), они представляют собой промышленные месторождения железных руд. Перед плавкой сидеритовые руды подвергаются обжигу.
РОДОХРОЗИТ — Mn[СО3]. От греч. родон — роза, хрос — цвет. Название указывает на цвет минерала. Синоним: марганцевый шпат.
Химический состав. MnO — 61,7 % (Mn — 47,8 %), СО2 — 38,3 %. Из изоморфных примесей чаще всего устанавливаются Fe, Mg, Ca, изредка Zn и СО.
Сингония тригональная: дитригонально-скаленоэдрический в. с. L363L23PC. Пр. гр. R3–c(D63d). a0 = 4,73; с0 = 15,51. Кристаллическая структура аналогична структуре кальцита. В виде хорошо образованных кристаллов наблюдается редко и лишь в пустотах. Обычные формы: {101} и {01
2}, иногда {0001} и {11
0}. Грани часто седлообразно или чечевицеобразно изогнуты. Агрегаты обычно кристаллически-зернистые, почковидные и шарообразные с радиально-лучистым или сферолитовым строением. Встречается в шестоватых агрегатах и в землистых массах.
Цвет кристаллов розовый или малиновый. С увеличением содержания кальция окраска бледнеет. На воздухе с течением времени буреет (окисляется). Тонкозернистые и землистые массы обладают белым цветом с едва заметным розовым оттенком. Черта белая. Блеск стеклянный. Nm = 1,817 и Np = 1,597.
Твердость 3,5–4,5. Хрупок. Спайность по ромбоэдру {1011}. Уд. вес 3,6–3,7.
Диагностические признаки. В кристаллических массах легко узнается по ромбоэдрической спайности, розовому цвету и твердости (царапается острием ножа). Скрытокристаллические и землистые агрегаты белого цвета для уверенного определения требуют данных химического или спектрального анализов.
П. п. тр. не плавится, растрескивается, принимает вначале зеленовато-серый, а затем черный цвет (вследствие окисления). С бурой и фосфорной солью дает реакцию на марганец (в окислительном пламени — фиолетовый, а в восстановительном — бесцветный перл). В HCl на холоде растворяется медленно, но при нагревании весьма энергично, бурно выделяя углекислоту.
Происхождение и месторождения. Судя по составу железомарганцевых карбонатов, Mn[СО3] с Fe[СО3] дают непрерывный ряд изоморфных смесей. Кларк марганца в земной коре примерно в 50 раз меньше, чем кларк железа. Тем не менее родохрозит встречается в природе самостоятельно.
В редко встречающихся гидротермальных жильных или метасоматических месторождениях марганца родохрозит возникает в ассоциации с сульфидами и силикатами закиси марганца, кристаллизуясь после браунита, гаусманита, кварца, барита и др. Родохрозит гидротермального происхождения в ассоциации с пиритом, хлоритами и другими минералами наблюдался в Сапальском месторождении среди мраморизованных известняков у г. Нижнего Тагила. В некоторых вольфрамовых месторождениях родохрозит иногда встречается в виде жил, генетически связанных с кварцевыми жилами, содержащими гюбнерит (MnWO4) и другие минералы (Букука в Забайкалье).
В гораздо более значительных массах родохрозит распространен в морских осадочных месторождениях марганца. Как показывает геологическое изучение, опало-родохрозитовые осадки локализовались на некотором удалении от береговой линии в более глубоких участках бассейнов, где в силу недостатка кислорода при разложении органических остатков, очевидно, создается восстановительная обстановка. Родохрозит в таких месторождениях обычно содержит в виде изоморфных примесей Ca, Fe и Mg и ассоциирует с сульфидами железа, манганокальцитом, опалом и др. Как правило, осадочные карбонатные руды марганца обогащены также фосфором.
Родохрозитсодержащие руды в значительных массах известны в осадочных месторождениях: Чиатурском (Закавказье), Полуночном (Северный Урал) и др.
Великолепные ярко-красные кристаллы крупных размеров поступают из проявления Алма на Колорадском плато (США).
Практическое значение. Бедные фосфором гидротермальные родохрозитовые руды представляют собой ценное сырье для выплавки ферромарганца. Осадочные карбонатные руды могут быть использованы для подшихтовки при выплавке из железных руд чугунов, а также для химических целей.
СМИТСОНИТ — Zn[СО3]. Синоним: цинковый шпат.
Химический состав. ZnO — 64,8 % (Zn — 52 %), СО2 — 35,2 %. Часто присутствуют в виде изоморфной примеси Fe, Mn, Mg, иногда Со, изредка Cd, In и др.
Сингония тригональная; дитригонально-скаленоэдрический в. с. L363L23PC. Пр. гр. R3c (D63d). a0 = 4,65; с0 = 14,95. Кристаллическая структура та же, что у кальцита (см. выше). Редко встречающиеся кристаллы имеют как ромбоэдрический, так и скаленоэдрический облик. Наиболее частые формы ромбоэдров {101} и {40
1}, скаленоэдра {21
1}, реже пинакоида{0001}, ромбоэдров {01
2}, {02
1} и призмы {11
0). Грани часто изогнуты и шероховаты. Агрегаты. Обычно наблюдается в землистых или плотных скрытокристаллических агрегатах, часто в сферолитовых формах (рис. 222) или в виде корок, а также скорлуповатых, ячеистых и пористых масс.
Рис. 222. Сферолитовая корка смитсонита
Цвет смитсонита белый с зеленоватым, буроватым или сероватым оттенком. Интенсивно окрашенные в зеленый цвет разности содержат в виде примеси малахит. Бурые разности окрашены гидроокислами железа. Блеск стеклянный сильный. Nm = 1,849 и Np = 1,621. В катодных лучах светится слабым розоватым цветом.
Твердость 5 (наивысшая для минералов группы кальцита). Хрупок. Спайность по ромбоэдру заметна лишь в явнокристаллических агрегатах. Уд. вес 4,1–4,5.
Диагностические признаки. В корках и скрытокристаллических массах не всегда бывает легко отличить от ряда минералов, встречающихся в парагенезисе с ним: опала, силикатов цинка (гемиморфита, виллемита) и др. Благодаря своей светлой окраске он не сразу бросается в глаза среди известняков. Приходится всегда прибегать к изучению его поведения перед паяльной трубкой и к химическим реакциям. Из второстепенных свойств для смитсонита характерны повышенные удельный вес и твердость (5).
П. п. тр не плавится, как и все карбонаты, растрескивается, на угле дает белый налет ZnO. Железосодержащие разности буреют. В кислотах растворяется сравнительно легко, иногда с шипением (особенно землистые разности). Прокаленный, после смачивания раствором Co[NO3]2 и вторичного прокаливания в окислительном пламени, зеленеет.
Происхождение и месторождения. Смитсонит является типичным минералом нижних горизонтов зоны окисления свинцово-цинковых сульфидных месторождений, залегающих в известняках. Иногда образует значительные залежи, преимущественно в лежачем боку рудных тел (рис. 223). Если в самих первичных рудах содержится много кальцита, то смитсонит встречается и в верхних частях зон окисления в ассоциации с силикатами цинка, галенитом и иногда остатками сфалерита. Образование его происходит метасоматическим путем по реакции обменного разложения легкорастворимого сульфата цинка с кальцитом:
ZnSO4 + CaCO3 + 2H2O = ZnCO3 + CaSO4 . 2H2O.
Эта реакция, по всей вероятности, совершается после того, как избыток свободной серной кислоты в растворах нейтрализуется при реакции с тем же кальцитом. Если при этом в растворах участвует сульфат закиси железа, что возможно лишь в нижних горизонтах зоны окисления, то смитсонит в виде изоморфной примеси содержит Fe[CO3], иногда в значительных количествах (монгеймит). Железистый смитсонит, попадая в окислительную обстановку, разлагается с выделением гидроокислов железа, причем цинк в виде смитсонита, уже не содержащего железа, может переоткладываться в других местах. Смитсонитовые массы, густо пигментированные гидроокислами железа, по внешнему виду мало чем отличаются от обычных лимонитовых пористых или кавернозных масс и потому часто легко пропускаются. Присутствие в них смитсонита можно установить с помощью паяльной трубки или в шлифах под микроскопом.
Из месторождений России, где смитсонит встречался в значительных массах, следует указать свинцово-цинковые месторождения Восточного Забайкалья: Акатуй, Кадаинское (Нерчинский район) и др.
Заслуживает упоминания Турланское (Ачисайское) месторождение в хребте Кара-Тау (Южный Казахстан), довольно долго считавшееся чисто свинцовым месторождением, пока за пределами основного рудного тела не были открыты большие залежи богатых окисленных руд цинка (рис. 223).
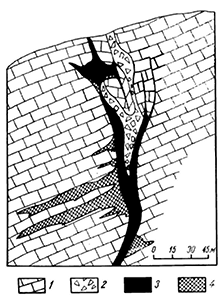
Рис. 223. Окисленные свинцовые и цинковые руды в восточной части
Турланского месторождения (по И. И. Князеву): 1 — известняк;
2 — брекчия оседания; 3 — окисленные свинцовые руды;
4 — вторичные цинковые руды, возник шие путем замещения известняка
Укажем и на крупнейшее месторождение Ледвилл в Колорадо (США), разрабатывавшееся в зоне окисления как чисто свинцовое; только спустя 30 лет здесь же были обнаружены богатые смитсонитовые руды (настолько малоприметны они среди известняков и других пород).
Практическое значение. Смитсонитовые руды, если встречаются в больших массах, могут являться ценным источником цинка. Содержание этого металла в них нередко бывает в 2–3 раза выше, чем в первичных сульфидных рудах. Таким образом, в нижних частях зон окисления месторождений свинцово-цинковых сульфидных руд, залегающих в известняках или доломитах, происходит не только отделение цинка от свинца, но и явное обогащение цинком экзогенных продуктов, отлагающихся метасоматическим путем в боковых породах.
ЦЕРУССИТ — Pb[CO3]. От лат. cerussa — белила. Синоним: белая свинцовая руда.
Химический состав. PbO — 83,5 % (Рb — 77,5 %), СО2 — 16,5 %. Из механических примесей могут присутствовать распыленные остатки PbS и Ag2S, обусловливающие черный цвет церуссита, изредка Zn[CO3].
Сингония ромбическая, ромбо-дипирамидальный в. с. 3L23РС. Пр. гр. Pmcn(D162h). а0 = 5,173; b0 = 8,480, c0 = 6,130.
Кристаллическая структура аналогична структуре арагонита. Облик кристаллов может быть различным: псевдогексагонально-дипирамидальный (рис. 224) с гранями дипирамиды {111} и призмы {021}, пластинчатый или таблитчатый (рис. 225) с преобладающим развитием пинакоида {001} или {010}, иногда {100}, шестоватый и др. Двойники и тройники весьма часты; двойниковой плоскостью служит {110} (рис. 226).
Рис. 224. Псевдогексагонально дипирамидальный кристалл церуссита
Рис. 225. Таблитчатый кристаллцеруссита
Рис. 226. Типичный тройник церуссита по (110)
Агрегаты. Сплошные массы обычно имеют зернистое строение. Реже встречается в натечных, скрытокристаллических и землистых массах. Обнаруживаются и снежно-белые волокнистые разности церуссита.
Цвет церуссита обычно белый с сероватым, желтоватым или буроватым оттенком. Ожелезненные массы имеют бурый цвет и потому нередко пропускаются. Изредка в отдельных зернах наблюдается черный цвет благодаря микроскопическим включениям остаточных сульфидов. Отдельные кристаллы часто бесцветны и прозрачны. Блеск алмазный, иногда стеклянный (в зависимости от ориентировки). Излом часто неровный, раковистый. В катодных лучах светится ярким зеленовато-голубым цветом. Ng = 2,078, Nm = 2,076 и Np = 1,804.
Твердость 3–3,5. Весьма хрупок. Спайность иногда наблюдается по {110} и {021} ясная. Уд. вес 6,4–6,6.
Диагностические признаки. Для церуссита, в отличие от других карбонатов, характерны высокий удельный вес и алмазный блеск. Часто наблюдается в ассоциации с англезитом и галенитом. Очень характерны повторные двойниковые срастания индивидов под 60° и шестилучевые тройники.
П. п. тр. сильно растрескивается, принимает желтый цвет (PbO), на угле легко восстанавливается до металлического свинца. В разбавленной HNO3 растворяется, бурно выделяя углекислоту. Растворим также в КОН.
Интересно, что церусситовые массы, пигментированные гидроокислами железа и потому внешне почти не отличимые от прочего лимонитизированного материала, не содержащего церуссит, обладают свойством при разламывании издавать характерный хрустящий или скрипящий звук. Этим свойством забойщики пользуются при разработке церусситовых участков в зонах окисления рудных месторождений.
Происхождение и месторождения. Распространен почти исключительно в зонах окисления свинцово-цинковых сульфидных месторождений. Обычно образуется за счет англезита Pb[SO4], развивающегося в свою очередь при окислении галенита. Вследствие своей очень низкой растворимости и устойчивости в водно-воздушной обстановке он затрудняет дальнейшее разложение галенита.
Хорошо образованные, нередко крупные кристаллы церуссита встречаются на стенках пустот, возникающих при выщелачивании в зонах окисления. Образование этих друз кристаллов, несомненно, свидетельствует о некотором переносе растворимых соединений свинца. Однако не исключена возможность образования церуссита и гидротермальным путем при низких температурах.
Псевдоморфозы церуссита по другим минералам (галениту, англезиту, кальциту, флюориту и др.) наблюдаются сравнительно редко.
Прекрасно образованными кристаллами церуссита славились месторождения Нерчинского района в Забайкалье (Тайнинское, Кадаинское) и месторождения Алтая (Риддерское, Зыряновское, Николаевское).
В значительных массах добывался в Турланском месторождении в хребте Кара-Тау (Южный Казахстан) и в других месторождениях.
Практическое значение. Представляет собой важную свинцовую руду, особенно в случаях развития мощных зон окисления в месторождениях свинцово-цинковых руд.
СТРОНЦИАНИТ — Sr[CO3]. Впервые был обнаружен близ местечка Строншиан (Западная Шотландия).
Химический состав. SrO — 70,2 %, СО2 — 29,8 %. Почти всегда присутствует CaO. Разновидность, известная под названием кальцио-стронцианита, содержит до 13 % СаО3. Реже устанавливаются BaO, PbO и др.
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Pmcn(D162h). a0 = 1,118; b0 = 8,404; с0 = 6,082. При температуре 700 °С (по другим данным — 929 °С) переходит в гексагональную модификацию, не встречающуюся в природе. Кристаллическая структура аналогична структуре арагонита. Кристаллы встречаются редко, преимущественно в виде тонких игл или бочонковидных призматических форм (рис. 227). Двойники часты по (110). Агрегаты. Обычен в сплошных зернистых, часто тонкошестоватых или волокнистых агрегатах.
Рис. 227. Кристалл стронцианита
Цвет. Бесцветен или окрашен в зеленоватые, желтоватые и сероватые оттенки. Блеск стеклянный, в изломе жирный. В катодных лучах светится очень слабым голубоватым оттенком. Ng = 1,668, Nm = 1,667 и Np = 1,520.
Твердость 3,5–4. Хрупок. Спайность по {110} ясная и по {021} несовершенная. Уд. вес 3,6–3,8.
Диагностические признаки. По внешним признакам трудно отличим от арагонита. Весьма характерно поведение перед паяльной трубкой и в кислотах.
П. п. тр. при сильном накаливании вспучивается и дает формы, подобные цветной капусте. Сильно светится и окрашивает пламя в интенсивный карминно-красный цвет (Sr). В кислотах легко растворяется с шипением. Если солянокислый раствор выпарить и облить спиртом, то вспыхивает ярко-красное пламя (Sr).
Происхождение и месторождения. Чаще встречается в гидротермальных образованиях в ассоциации с целестином, баритом, кальцитом, сульфидами и другими минералами. Обнаруживается также в осадочных породах (известняках, мергелях), правда, часто в виде позднейших прожилков в пустотах и трещинах.
В пределах России отмечался в Нерчинском округе Забайкалья (Кадаинский рудник). На Халютинском месторождении в Бурятии стронцианит является предметом добычи.
В небольших количествах встречался в Крыму — мыс св. Ильи (близ Феодосии), Карадаг, Лысая гора, Батилиман и др.; у села Цнис в Ахалцихском районе (Грузия) и в других местах. В значительных количествах был найден и разрабатывался в месторождении Гамм в Вестфалии (Германия) в виде прожилков и жил в мергелях мелового возраста. Здесь в пустотах встречались также прекрасно образованные кристаллы. В качестве спутника он наблюдался во многих гидротермальных месторождениях, чаще в баритовых жилах в сопровождении сульфидов.
Практическое значение. Является второстепенным источником стронция. О применении см. целестин.
ВИТЕРИТ — Ва[CO3]. Химический состав. BaO — 77,7 %, СО2 — 22,3 %. Иногда содержит стронций.
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Pmcn(D162h). а0 = 5,252; b0 = 8,828; с0 = 6,544. Кристаллическая структура аналогична структуре арагонита. Встречающиеся кристаллы имеют вид псевдогексагональных дипирамид. Часты тройники (рис. 228) по (110). Агрегаты. Наблюдается также в шаровидных и почковидных формах, иногда жилковатых, волокнистых и листоватых агрегатах.
Рис. 228. Витерит. Тройник прорастания
Цвет. Бесцветный или белый, но обычно бывает окрашен в сероватые или желтоватые оттенки. Блеск стеклянный, в изломе жирный. В катодных лучах иногда светится желтым цветом. Ng = 1,677, Nm = 1,676 и Np = 1,529.
Твердость 3–3,5. Хрупок. Спайность по {010} ясная, по {110} несовершенная. Уд. вес 4,2–4,3. Прочие свойства. Витеритовая пыль отравляюще действует на организм человека. Поэтому при бурении шпуров в горных выработках среди пород и руд, содержащих витерит, прибегают к так называемому мокрому бурению.
Диагностические признаки. Характерен высокий удельный вес, отличающий его от сходных с ним арагонита и стронцианита. Отличен и по поведению перед паяльной трубкой и в кислотах.
П. п. тр. легко сплавляется в прозрачное, по охлаждении — в эмалевидное стекло (отличается от всех других карбонатов). Пламя окрашивается в характерный желто-зеленоватый цвет. В разбавленных HNO3 и HCl растворяется с шипением. При прибавлении нескольких капель H2SO4 выпадает обильный осадок BaSO4.
Происхождение и месторождения. Обычно встречается в гидротермальных месторождениях в парагенезисе с кальцитом, доломитом, сульфидами Pb, Zn, Fe и часто баритом, иногда отлагающимся позднее витерита. Известны находки и экзогенного происхождения. Встречаются псевдоморфозы по бариту, образующиеся, очевидно, под влиянием углекислых растворов. Установлены также явления замещения витерита баритом.
В России отмечены находки в Змеиногорском руднике (Алтай). Крупные скопления витерита вообще редки. Сеттлингстонское месторождение в Нортумберленде (Англия) в сущности является единственным специфически витеритовым месторождением. Витерит здесь сопровождается кальцитом, сульфидами и более поздним баритом (в тонких трещинах и промежутках между кристаллами витерита). Барито-витеритовые месторождения в виде серии жил встречены на месторождении Арпаклен в Каракалинском районе (Туркмения), где приурочены к трещинам среди крупной тектонической зоны нарушения в осадочных породах мелового возраста.
Практическое значение. Витерит по сравнению с баритом имеет второстепенное значение в получении бариевых соединений, используемых в различных отраслях химической промышленности, просто потому, что он в природе распространен в гораздо меньших количествах. О применении барийсодержащих минералов см. барит.
ПАРИЗИТ-(Ce) — Ca(Ce,La...)2[CO3]3F2. Содержит (Ce,La)2O3 до 50%, среди лантаноидов может преобладать неодим (паризит-(Nd)), есть указания и на существование иттропаризита. Назван в честь Дж. Париза, владельца рудника в Мусо (Колумбия), где минерал был впервые обнаружен. Минерал редкий. Является одним из промежуточных членов полисоматического ряда бастнезит (Ce,La...)[CO3]F — фатерит Ca[CO3].
Сингония тригональная; ромбоэдрический в. с. L36C. Пр. гр. R3– (С23i). а0 = 7,18; с0 = 84,1. Кристаллическая структура характеризуется чередованием вдоль тройной оси индивидуализированных одиночных слоев состава Са[CO3] со структурой фатерита и сдвоенных слоев со структурой бастнезита (Ce,La...)[CO3]F.
Облик кристаллов. Кристаллы короткостолбчатые, бочонковидные и скипетровидно-пирамидальные, с заметным участием ромбоэдра {111}.
Агрегаты. Характерны плотнозернистые сплошные агрегаты зернистого строения.
Цвет красновато-бурый, буровато-желтый. Блеск сильный стеклянный, жирный до смоляного. Np = 1,640–1,678 и Ng = 1,767–1,800. Твердость 4—4,5. Хрупок. Спайность (или отдельность) ясная по {0001}. Уд. вес 4,35.
П. п. тр. не плавится. В HCl разлагается медленно. При нагревании с H2SO4 выделяется HF.
Встречается в карбонатитах, щелочных пегматитах и в фенитах. Описан в изумрудных копях Музо в Колумбии (Южная Америка), встречается в карбонатитах Белозиминского массива (Восточный Саян), в Карасуге (Тува), в Вишневых горах (Южный Урал), в Петровско-Гнутовском проявлении в Приазовье (Украина) и в других местах.
Обобщение. Таким образом, минералы группы кальцита по физическим свойствам имеют много общего между собой. Как можно видеть из сводной таблицы важнейших свойств главных минералов этой группы (табл. 11), несколько выделяются среди остальных лишь карбонаты тяжелых металлов: Mn, Fe, Pb и Zn и особенно резко карбонат свинца — церуссит. Наибольшие различия устанавливаются в степени растворимости минералов в воде, насыщенной углекислотой. Исключительной растворимостью обладает карбонат Mg, затем следуют карбонаты Ba и Са. Наименьшая растворимость принадлежит карбонату Pb.
Таблица 11. Важнейшие свойства главных
минералов группы кальцита
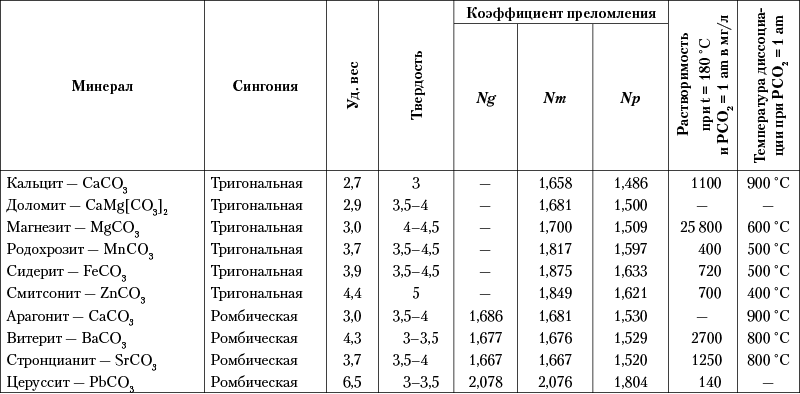
Свойства не приведенных в таблице многочисленных промежуточных по составу минералов, составляющих изоморфные ряды, меняются в прямой зависимости от соотношений составляющих компонентов. То же относится к двойным солям. Термическая диссоциация двойных солей происходит в два приема.
К этой группе относятся основные безводные карбонаты меди — малахит и азурит.
МАЛАХИТ — Cu2[CO]3[OH]2, или Cu[CO3] . . Cu[ОН]2. Малахе по-гречески — мальва (растение). Очевидно, назван по сходству с цветом зелени.
Химический состав. CuO — 71,9 % (Cu — 57,4 %), СО2 — 19,9 %, Н2О — 8,2 %. В очень небольших количествах устанавливаются также CaO, Fe2O3, SiO2 и др. Присутствие их, очевидно, обусловлено адсорбированными или механическими примесями посторонних веществ.
Сингония моноклинная; призматический в. с. L2PC. Пр. гр. P21/a(C 52h). a0 = 9,49; b0 = 12,00; с0 = 3,24, β = 98°42′. Кристаллы крайне редки, имеют призматический облик и практически всегда сдвойникованы (рис. 229).
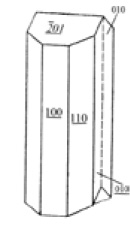
Рис. 229. Двойник призматических кристаллов малахи та по (100)
Агрегаты. Обычно наблюдается в массах почковидной формы с радиально-волокнистым строением. Для крупных почковидных сферолитовых образований весьма характерно концентрически-зональное строение, особенно эффектно проявляющееся на полированных образцах (рис. 230). Встречаются и землистые разности (медная зелень).

Рис. 230. Концентрическизональное строение малахита
(полированная поверхность). Гумешевское месторождение (Урал)
Цвет малахита зеленый. Черта бледно-зеленая. Блеск стеклянный до алмазного, у волокнистых разностей шелковистый. Ng = 1,909, Nm = 1,875 и Np = 1,655.
Твердость 3,5–4. Хрупок. Спайность по {201} совершенная, по {010} средняя. Уд. вес 3,9–4.
Диагностические признаки. Легко узнается по характерному зеленому цвету, часто наблюдаемым натечным формам и радиально-волокнистому строению. От несколько похожих на него хризоколлы (гидросиликата меди), псевдомалахита (фосфата меди) и других медных минералов зеленого цвета отличим по поведению в соляной кислоте (выделяет углекислоту).
П. п. тр. в восстановительном пламени плавится и дает королек меди. Смоченный HCl, окрашивает пламя в голубой цвет. В стеклянной трубке выделяет воду и чернеет. В HCl растворяется с шипением. Раствор от прибавления аммиака в избытке синеет.
Происхождение и месторождения. Малахит образуется исключительно в зонах окисления медных сульфидных месторождений, особенно если они залегают в известняках или первичные руды содержат много карбонатов. Является самым распространенным минералом меди в окисленных медных рудах. Он развивается как путем замещения карбонатов, так и путем выполнения пустот с образованием в них типичных сферолитовых форм. Так как в растворах у поверхности известняков или карбонатов Са и Mg создается явно щелочная среда, то достигающие их растворы сульфатов меди, очевидно, подвергаются гидролизу, реагируя с бикарбонатными растворами. Кроме того, карбонаты меди, вероятно, могут возникать также в результате медленной реакции сульфата или гидрата меди с раствором, насыщенным углекислотой воздуха.
Малахит часто образует псевдоморфозы по азуриту, куприту, самородной меди, а иногда также по таким минералам, как атакамит, кальцит, халькопирит и др. Малахит в виде включений или примазок «медной зелени» весьма часто встречается в зонах окисления медных месторождений. Однако большие скопления, особенно поделочные сорта его, теперь становятся уже редкостью.
На Урале мировой известностью пользовались два крупнейших месторождения: Меднорудянское (у Нижнего Тагила) и Гумешевское (к юго-западу от Екатеринбурга).
Меднорудянское месторождение по своему богатству и красоте узоров малахита в полированном виде являлось единственным в мире. Отсюда получен облицовочный малахит знаменитых колонн Исаакиевского собора (в Санкт-Петербурге), малахитового зала Зимнего дворца, столов Эрмитажа и др. Первая крупная глыба малахита почти 50 т весом вместе с другими кислородными соединениями меди была вскрыта на глубине около 70 м среди глинистых сильно ожелезненных, разрушенных пород у границы скарнов с известняком.
Гумешевское месторождение было известно еще с конца XVIII в. Оно дало огромное количество прекрасного поделочного малахитового материала, заполнившего витрины многих музеев того времени. Крупные куски сферолитового малахита залегли среди красных глин. Отсюда получена замечательная по красоте рисунка большая глыба малахита весом около 1,5 т, хранящаяся в музее Санкт-Петербургского горного института.
Поделочный малахит в настоящее время поступает с месторождения Колвези в провинции Шаба (Демократическая Республика Конго, Центральная Африка)
Практическое значение. Плотные узорчатые разности малахита, встречающиеся иногда большими массами, идут на различные поделки и мозаичные работы: изготовление красивых по оттенкам и рисункам ваз, шкатулок, столов и других предметов. Малахитовая мелочь употребляется на изготовление красок. Вкрапленные землистые разности малахита наряду с другими окисленными медными рудами служат рудой для выплавки меди.
АЗУРИТ — Cu3[СО3]2[ОН]2, или 2Cu[CO3] . Cu[OH]2. Название происходит от франц. azur — лазурный, голубой. Синоним: медная лазурь.
Химический состав. CuO — 69,2 % (Сu — 55,3 %), СО2 — 25,6 %, Н2О — 5,2 %. Кристаллы в химическом отношении довольно чисты. Из механических примесей как редкий случай в образцах из Березовского месторождения на Урале были установлены чешуйки вторичного самородного золота.
Сингония моноклинная; призматический в. с. L2PC. Пр. гр. P21/c(C 52h). а0 = 4,96; b0 = 5,83; с0 = 10,27. Облик кристаллов. Наблюдающиеся кристаллы имеют вид коротких столбиков или призм, а также толстых таблиц (рис. 231). Встречается нередко в друзах мелких кристаллов, сплошных зернистых массах, иногда радиально-лучистых агрегатах и в землистом состоянии («медная синь»).
Рис. 231. Кристалл азурита:
с {001}, b {102}, а {100}, т {110}, x {112} и d {123}
Цвет азурита темно-синий, в землистых массах голубой. Черта голубая. Блеск стеклянный. Ng = 1,838, Nт = 1,758 и Np = 1,730.
Твердость 3,5–4. Хрупок. Спайность по {001} совершенная, по {100} несовершенная. Уд. вес 3,7–3,9.
Диагностические признаки. Легко узнается по характерному синему цвету и ассоциации с малахитом и другими кислородными соединениями меди.
П. п. тр. легко плавится, в восстановительном пламени дает королек меди. В кислотах растворяется с шипением. Растворяется также в аммиаке, окрашивая раствор в голубой цвет.
Происхождение. В небольших количествах почти постоянно встречается в парагенезисе с малахитом, часто отлагаясь после него. Нередко создаются условия, при которых он менее устойчив, чем малахит, и замещается последним. Известны псевдоморфозы малахита по кристалликам азурита. Характерно, что этот позднейший малахит не обладает радиально-волокнистым строением, а представлен сплошной скрытокристаллической массой.
Практическое значение. Вместе с другими кислородными соединениями меди идет в плавку в металлургических печах. Чистый азурит, если встречается в значительных массах, может употребляться для изготовления синей краски.
Среди карбонатов, содержащих в своем составе молекулы Н2О, более распространены водные карбонаты Na, Mg, U и др. Здесь мы рассмотрим лишь десятиводный карбонат натрия.
НАТРОН — Na2[CO3] . 10Н2О. Назван по составу. В русской литературе постоянно фигурирует под названием «сода», которое употреблялось еще в XVII в.; происхождение его неизвестно. Не следует называть его натритом, это наименование относится к безводному минералу Na2[CO3].
Химический состав. Na2O — 21,6 %, CO2 — 15,4 %, Н2О — 63,0 %. Механическими примесями могут быть другие легкорастворимые соли натрия.
Сингония моноклинная; призматический в. с. L2PC. Кристаллическая структура не уточнена. Кристаллы имеют форму ромбоидальных таблиц. Обычно наблюдается в зернистых агрегатах.
Цвет. Бесцветная, белая или серая. Блеск стеклянный. Ng = 1,440, Nm = 1,425 и Np = 1,405.
Твердость 1–1,5. Спайность по {100} совершенная. Уд. вес 1,42–1,47. Из чистых насыщенных растворов Na2CO3 при атмосферном давлении выпадает в интервале температур от –2 до 32 °С.
Диагностические признаки. Легко растворима в воде. При действии HCl бурно выделяет углекислый газ. На воздухе быстро теряет воду и белеет. При слабом нагревании, так же как и многие другие богатые водой кристаллогидраты, плавится, вернее, растворяется в собственной кристаллизационной воде, выделяя термонатрит (Na2CO3 . H2O). При сплавлении остатка в ушке платиновой проволочки пламя окрашивается в интенсивный желтый цвет (реакция на натрий).
Происхождение. В значительных массах образуется в некоторых соляных озерах, богатых натрием, при избытке растворенного СО2. Полагают, что сода может возникать при реакции обменного разложения Na2SO4 с приносимым бикарбонатом кальция — Ca[НСО3]2. Образование ее может протекать и биохимическим путем при восстановлении сульфатов микроорганизмами и последующем воздействии углекислоты с выделением H2S по реакциям:
Na2SO4 → Na2S+O4;
Na2S + Н2О + СО2 → Na2CO3 + H2S.
В виде снежно-белых выцветов и налетов она возникает на поверхности рыхлых горных пород и почв в странах с сухим жарким климатом.
Все известные крупные содовые озера у нас распространены в азиатской части России. В Доронинском содовом озере (Восточная Сибирь) она добывалась в зимнее время. С этой целью на поверхность льда выкачивался рассол слоем до 6 см. В процессе замерзания рассола сода осаждалась на поверхности нижнего ледяного покрова. После улетучивания поверхностного льда (при сильных ветрах) она собиралась в кучи и отправлялась на завод для переработки. В подземных горных выработках горы Карнасурт в Ловозерском массиве нефелиновых сиенитов (Кольский полуостров) образующаяся в настоящее время сода совместно с опалом образует сталактиты.
Соду выделяют озера Кулундинской степи к югу от ст. Кулунда (Северный Казахстан): Петуховские и Михайловские озера. Садка соды в них начинается осенью, при понижении температуры (зимой она добывается со дна озер).
Крупные содовые озера распространены в Триполи, Египте, Иране, Тибете, Юго-Восточной Калифорнии (оз. Серлз) и др.
Практическое значение. Сода употребляется в самых различных отраслях промышленности: мыловаренной, стекольной, красильной, а также химической и металлургической. В странах, бедных содовыми озерами, сода получается искусственно, главным образом из мирабилита и галита.

