Хлориды в противоположность фторидам пользуются гораздо более широким распространением в природе. Соединения с хлором известны для следующих 16 элементов: Н (в виде HCl в газообразных продуктах вулканических извержений), N (в HN4), Na, Mg, Al, К, Са (Rb), (Cs), Fe, (Ni), Cu, Ag, Hg, Pb и Bi.
Из них наиболее важными являются хлориды Na и Mg, образующие в экзогенных условиях вместе с другими растворимыми солями нередко мощные толщи соляных залежей осадочного происхождения. Соединения с тяжелыми металлами (Сu, Ag и Рb) имеют второстепенное значение. Остальные элементы образуют минералы, редко встречающиеся в природе.
Важно отметить, что в экзогенных условиях калий и натрий играют различную геохимическую роль. Хотя их кларки (т. е. средние содержания) в литосфере примерно одинаковы (см. табл. 3) и примерно в одинаковых количествах эти элементы освобождаются и переходят в растворы при выветривании горных пород, однако в морских бассейнах, где происходит концентрация хлористых солей, содержание NaCl составляет 3,5 %, тогда как содержание КСl едва достигает 0,6–0,7 %. Химические анализы почв и континентальных отложений показывают, что в то время как натрий в основной своей массе с поверхностными и речными водами достигает озерных и морских бассейнов, калий по пути миграции растворов в значительной мере адсорбируется в верхних частях коры выветривания (почвах, глинистых породах) и усваивается растениями. Как известно, зола растений всегда обогащена этим элементом. Отсюда становится понятным, почему в продуктах кристаллизации, происходящей при усыханий соляных бассейнов, соединения натрия по сравнению с соединениями калия имеют резко преобладающее значение.
Бромиды известны лишь для Ag и устанавливаются крайне редко в зонах окисления серебросодержащих сульфидных месторождений в условиях сухого жаркого климата. В главной своей массе бром находится в рассеянном состоянии в виде изоморфной примеси к широко распространенным хлоридам легких металлов, особенно в бишофите (МgСl2 . 6Н2О), накапливаясь вместе с ними в замкнутых озерных и морских бассейнах, главным образом в остаточных рассолах.
В морской воде бром содержится в количестве 0,008 %. Иногда в существенных количествах он устанавливается в соляных источниках.
Иодиды также редки, но для них мы наблюдаем большее число минеральных видов. Они установлены для Ag, Сu и Hg, т. е. для металлов, ионы которых обладают сильно выраженной поляризацией. Они встречаются в тех же условиях, что и бромиды.
Содержание йода в хлоридах Na, К и Mg хотя и колеблется в сравнительно широких пределах, но в общем выражается все же ничтожной величиной. В более значительных количествах содержание его устанавливается в продуктах жизнедеятельности морских водорослей, из золы которых он и добывается, затем в нефтяных водах и выбросах грязевых вулканов. Очень высокая растворимость солей йода приводит к тому, что они могут накапливаться лишь в районах с сухим пустынным климатом. Не случайно поэтому в таких районах иногда устанавливаются большие запасы йода. Таково, например, крупнейшее месторождение чилийской селитры (NaNO3) в пустыне Атакама, где йод присутствует, правда, в виде иодатов и содержание его достигает 0,05 %.
Таким образом, наибольшее количественное значение среди рассматриваемых здесь галогенидов принадлежит хлоридам.
Среди минералов данного класса рассмотрим две группы — галита и кераргирита.
Сюда относятся хлориды одновалентных металлов Na и К. Здесь же опишем водный двойной хлорид К и Mg.
ГАЛИТ — NaCl. От греч. галос — море, соль. Синонимы: каменная соль (в плотных крупнокристаллических массах, залегающих среди горных пород) и самосадочная соль (в рыхлых кристаллических агрегатах на дне соленосных бассейнов).
Химический состав. Na — 39,4 %, Cl — 60,6 %. Примеси большей частью механические: капельки рассола, пузырьки газов, включения глинистого или органического вещества, гипса, KCI, MgCl2 и др.
Сингония кубическая; гексаоктаэдрический в. с. 3L44L366L29PC. Пр. гр. Fm3–m(О5h). a0 = 5,6287. Кристаллическая структура характеризуется плотнейшей кубической упаковкой анионов Cl1– с заполнением всех октаэдрических пустот между ними катионами Na1+. Она изображена на рис. 138. Ионы Na1+ и Cl1– располагаются поочередно в углах малых кубов. Координационные числа для обоих ионов равны 6, т. е. каждый отрицательный ион хлора окружен шестью положительно заряженными ионами натрия, и наоборот. Облик кристаллов, как правило, кубический. Грани {111} и {110} встречаются очень редко (при кристаллизации из сложных по составу растворов). Двойники редки по (111). Для кристаллов самосадочной соли бывают характерны воронкообразные ступенчатые углубления на гранях (100) (см. рис. 20).
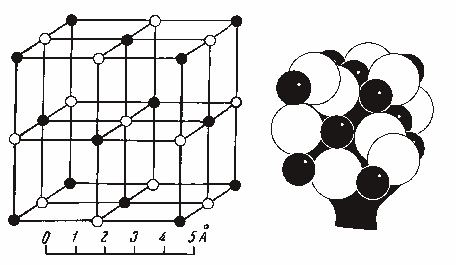
Рис. 138. Кристаллическая структура NaCl. Справа — модель структуры.
Черные кружки — ионы натрия, белые кружки — ионы хлора (или наоборот)
Агрегаты. Самосадочная соль наблюдается в виде рыхлых или плотных кристаллически-зернистых корок или «пластин» на дне бассейнов, а также друз кристаллов, нередко очень крупных.
Интересно отметить, что при быстром испарении растворителя — Н2О — на самой поверхности рассолов в тихую погоду возникают многочисленные плавающие кристаллические «лодочки» (рис. 139), разрастающиеся в основании, обращенном кверху. Они имеют белый цвет, очевидно, вследствие захвата микроскопических пузырьков воздуха. При волнении они заполняются водой, оседают на дно и продолжают свой рост, образуя уже нормальные прозрачные кристаллы. Однако нередко и в них сохраняются внутренние елочковидные или конвертовидные участки молочно-белого цвета.
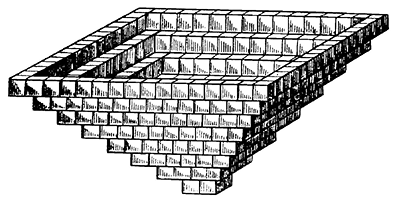
Рис. 139. Кристаллическая «лодочка» NaCl
Каменная соль, возникающая в результате собирательной перекристаллизации в процессе метаморфизма, образует необычайно крупнокристаллические массы, о чем можно судить по размерам спайных плоскостей. Характерно, что при перекристаллизации образуются часто совершенно прозрачные массы галита (очевидно, включения жидкостей и газов при этом «отгоняются» к периферии кристаллических зерен).
Цвет. Чистые массы галита прозрачны и бесцветны или имеют белый цвет. Но часто те или иные красящие пигменты обусловливают окраску в различные цвета: серый (обычно глинистые частицы), желтый (гидроокислы железа), красный (безводная или маловодная окись железа), бурый и черный (органические вещества, исчезающие при нагревании) и др. Для каменной соли иногда наблюдается очень характерная интенсивная синяя окраска в виде пятен или полос, особенно на участках, подвергшихся сильной деформации. Искусственно такая окраска получается при облучении каменной соли рентгеновскими лучами или при пропитывании ее парами металлического натрия, особенно если образец предварительно подвергнуть одностороннему сжатию. При нагревании до 200 °С окраска исчезает и соль становится бесцветной. Предполагают, что окраска возникает вследствие того, что ионы Na1+ приобретают свободные электроны (β-частицы радиоактивных лучей) и потому становятся электрически нейтральными атомами. Тот факт, что синяя соль встречается на тех участках, где присутствуют калийсодержащие хлориды, позволяет считать вероятным, что K и обычно связанный с ним Rb, способные в какой-то степень излучать β-частицы (электроны), действительно могли обусловить эту синюю окраску.
Блеск галита стеклянный, на поверхностях слегка выветрелых разностей жирный. N = 1,544 (существенно выше, чем у сильвина).
Твердость 2,5. Хрупок. При продолжительном одностороннем давлении обнаруживает способность к пластической деформации. Спайность совершенная по кубу (см. рис. 29), что вполне согласуется с особенностями кристаллической структуры минерала. Уд. вес 2,1–2,2. Прочие свойства. Обладает слабой электропроводностью, исключительно высокой теплопроводностью. Легко растворим в воде: до 35 % при комнатной температуре (при повышении температуры на несколько десятков градусов растворимость мало меняется). Вкус соленый. Гигроскопичен, но в значительно меньшей степени, чем хлориды калия и магния.
Диагностические признаки. Легко узнается по низкой твердости, весьма совершенной спайности, растворимости в воде и соленому вкусу раствора.
П. п. тр. на угле легко плавится (800 °С), обычно растрескиваясь и окрашивая пламя в желтоватый цвет. Из раствора, подкисленного азотной кислотой AgNO3, выделяет белый творожистый осадок AgCl.
Происхождение и месторождения. Главные массы галита, как и других растворимых в воде солей, образуются при экзогенных процессах в усыхающих замкнутых соленых озерах или мелководных лагунах и заливах, отделенных от морского бассейна песчаными барьерами (барами), в условиях жаркого сухого климата. В летнее время в таких мелководных заливах при прогреве воды и большой поверхности испарения концентрация растворенных солей все время увеличивается по сравнению с морским бассейном. Происходящее при этом понижение уровня обусловливает беспрерывный приток свежей морской воды, а следовательно, и добавочного количества растворенных солей. С наступлением осеннего похолодания из насыщенных растворов выпадают те или иные соли в зависимости от концентрации компонентов. Если данный бассейн не сообщается с морем и не вбирает в себя пресные текучие воды, то в момент наступления пересыщения при испарении происходит садка соли и в летнее время.
Состав воды в различных материковых соляных озерах весьма разнообразен. Он зависит, с одной стороны, от состава питающих озеро вод, т. е. от состава окружающих горных пород, а с другой — от стадии усыхания озера и связанной с ней относительной концентрацией остающихся в рассоле компонентов. Во многих таких озерах наряду с другими солями осаждается также NaCl.
В ископаемых соленосных осадках, образовавшихся в прошлые геологические эпохи, галит встречается в виде сплошных масс каменной соли. Соляные залежи, располагаясь среди осадочных пород, во время горообразовательных движений в силу большой способности к пластическим деформациям легко меняют свою форму, образуя часто мощные сложные по форме и строению купола, иногда прорывающие вышележащие осадочные породы. При этом тонкослоистые отложения солей претерпевают нередко очень сложные микроскладчатые деформации.
В пустынях, как известно, широко развиты так называемые солончаки, представляющие собой выцветы солей, в составе которых почти постоянно принимает участие NaCl. Они после дождей исчезают и вновь появляются в сухую погоду.
Наконец, в виде продуктов возгона галит вместе с другими хлоридами отлагается на стенках кратеров вулканов и в трещинах лавовых потоков. Размеры подобных скоплений, за крайне редкими исключениями, обычно бывают невелики. Характерно, что галит в этих случаях почти всегда содержит в себе довольно много KCl, который при высоких температурах, как установлено экспериментом, входит в него в виде твердого раствора.
Наиболее крупные запасы галита сосредоточены в месторождениях каменной соли. Они образовались в различные геологические эпохи, но наиболее значительные месторождения приурочены к осадкам пермского периода, характеризовавшегося продолжительным континентальным жарким климатом (на территории Европы, Южной Азии, Америки и др.).
Из месторождений в России отметим наиболее важные: Илецкая Защита (к югу от Оренбурга), где мощный шток каменной соли был прикрыт лишь небольшими наносами, а пласты каменной соли вместе с ангидритами сильно перемяты; Соликамское (Верхнекамское) — крупнейшее в мире месторождение калийных и магниевых солей, в котором залегают также мощные толщи каменной соли, гипса и др.
Из современных месторождений самосадочной соли заслуживает внимания известное оз. Баскунчак (к востоку от пристани Владимирской в низовьях р. Волги). Впадина озера располагается у северного склона погребенного под толщей гипсов соляного купола. Отложения кристаллической соли сверху покрыты рапой (рассолом).
Из иностранных месторождений упомянем лишь некоторые. К числу давно известных месторождений каменной соли принадлежит месторождение Величка к юго-востоку от г. Кракова (Польша), разрабатывающееся еще с XI в.; огромный шток каменной соли расположен у г. Суэца (Египет); очень крупные залежи каменной соли известны в Северной Индии, вдоль Гималайских гор в Пенджабе и др.
Практическое значение. Применение галита весьма разнообразно. Помимо того что он является важнейшим пищевым продуктом и консервирующим средством, он широко используется в химической промышленности для получения соляной кислоты, хлора, соды, едкого натра и ряда солей. Кроме того, галит является исходным сырьем для получения металлического натрия, который применяется: для изготовления антифрикционных сплавов (натриево-кальциевых баббитов); для получения перекиси натрия, используемой в текстильной промышленности при отбеливании тканей; в качестве каталитического агента при производстве сложных органических соединений; в черной и цветной металлургии как восстановитель и для удаления серы; как поглотитель влаги и кислорода при очистке благородных газов (гелия, неона, аргона и др.); в электротехнике при изготовлении разрядных ламп с парами натрия, имеющих большую силу света, а также при изготовлении электропроводов, состоящих из натриевых «жил», покрытых оболочкой меди, и др.
СИЛЬВИН — KCl. Химический состав. К — 52,5 %, Сl — 47,5 %. Часто содержит включения жидкостей и газов, главным образом азота, в меньшей степени углекислоты, водорода, метана и, что особенно интересно, гелия. Из механических примесей часто устанавливаются NaCl и Fe2O3. В виде изоморфной примеси почти постоянно присутствуют КВr (до 0,1 %) и в ничтожных количествах RbCl и CsCl.
Сингония кубическая; гексаоктаэдрический в. с. 3L44L366L29PC. Пр. гр. Fm3–m(О5h). а0 = 6,278. Кристаллическая структура такая же, как у галита: гранецентрированный куб (см. рис. 138). Величина элементарной ячейки существенно больше, чем у галита. Облик кристаллов кубический. Нередко наблюдаются кубы, притупленные по углам гранями октаэдра. Двойники часты по (111). Агрегаты. Обычно встречается в виде сплошных зернистых масс, иногда слоистой текстуры.
Цвет. Чистые разности водяно-прозрачны и бесцветны. Весьма обычен молочно-белый цвет, обусловленный включениями мельчайших пузырьков газов. Ярко-красные и розовые сильвины также являются кристаллозолями; в виде грубой дисперсной фазы в них заключены мельчайшие чешуйки гематита (Fe2O3), остающиеся в осадке при растворении. Блеск стеклянный. N = 1,490 (меньше, чем у галита).
Твердость 1,5–2. При царапании обнаруживает некоторую степень пластичности, как и при продолжительном одностороннем давлении. Спайность совершенная по {100}. Уд. вес 1,97–1,99 (меньше, чем у галита). Прочие свойства. Вкус горьковато-соленый, жгучий. Теплопроводность высокая. Легко растворяется в воде. Гигроскопичен. Прозрачные разности хорошо пропускают коротковолновые лучи, на чем основано применение его для призм спектроскопа.
Диагностические признаки. Похож на галит, с которым часто образует зернистые срастания. Отличается от него по вкусу и окрашиванию пламени в фиолетовый цвет, видимый через синее стекло. Пластичность проявляется в том, что при царапании остается блестящий след. Под микроскопом определяется по показателю преломления.
П. п. тр. легко плавится (800 °С). Раствор, подкисленный азотной кислотой, с AgNO3 дает творожистый белый осадок AgCl.
Происхождение и месторождения. Сильвин, так же как и галит, образуется в усыхающих соляных озерах, но встречается по сравнению с ним гораздо реже — далеко не во всех месторождениях каменной соли. По пути миграции поверхностных растворов в значительной части адсорбируется почвами. Из рассолов он выпадает одним из последних и потому обычно встречается в верхах соленосных скоплений. Иногда он является продуктом разложения карналлита, образующегося в тех же условиях.
Как продукт сублимации, он встречается на стенках кратеров вулканов и в трещинах застывших лав.
Величайшее в мире Соликамское месторождение сильвина находится в 35 км к северу от г. Перми. Оно открыто в 1925 г. Мощный нижний горизонт сильвинита (галит-сильвиновой породы) залегает на глубине 150–300 м на толще каменной соли и покрывается зоной карналлита в смеси с галитом. Содержание КСl в сильвините колеблется от 10 до 35 %. Верхний сильвинитовый горизонт является продуктом разложения карналлитовой зоны (с выносом MgCl2) и представлен грубозернистой пестроцветной массой, в которой сильвин молочно-белого цвета ассоциирует с бесцветной, голубой, синей и сероватой каменной солью.
До открытия Соликамского большой известностью пользовались Штассфуртские и другие месторождения Западной и Северной Германии. Соляные залежи здесь того же пермского возраста и имеют довольно сложный состав галоидных, сернокислых и борных соединений. Сравнительно молодого — неогенового — возраста сильвиниты разрабатываются в Эльзасе (Франция).
Практическое значение. В подавляющей своей массе калийные соли идут на удобрение полей. Лишь очень незначительная часть их (около 5 %) используется в химической промышленности для приготовления КОН, К2СО3, KNO3, КСlO3, КМnО4, KCN, KBr, KJ и других соединений. Эти соединения имеют различное применение: в медицине, парфюмерии, пиротехнике, фотографии, для очистки шерсти, в бумажном, стекольном (при изготовлении хрустального и богемского стекла), лакокрасочном и других производствах.
КАРНАЛЛИТ — MgKCl3 . 6H2O. Химический состав. Mg — 8,7 %, К — 14,1 %, Сl — 38,3 %, Н2О — 38,9 %. В очень небольших количествах устанавливаются изоморфные примеси Вr (до 0,2 %), а также Rb и Cs (в сотых долях процента), изредка Li и Тl. Из механических примесей обычно присутствуют NaCl, KCl, CaSO4, Fe2O3, глинистое вещество, капельки рассолов, часто обильные включения газов (смесь азота с водородом и метаном).
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Рban (D42h). a0 = 9,54; b0 = 16,02; с0 = 22,52. Кристаллы крайне редки; имеют псевдогексагональный облик (рис. 140). Обычно встречается в сплошных зернистых массах.
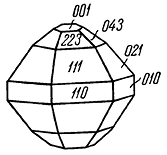
Рис. 140. Кристалл карналлита
Цвет. Чистые разности бесцветны. Обычно окрашен в розовый или красный цвет включениями тонко распыленной окиси железа. Бурый или желтый цвет обусловлен примесью гидроокислов железа. Блеск в свежем изломе стеклянный, на воздухе быстро тускнеет и становится жирным. Ng = 1,494, Nm = 1,475 и Nр = 1,466.
Твердость 2–3. Хрупок. Спайность отсутствует. Уд. вес 1,6. Прочие свойства. Необычайно гигроскопичен. Легко расплывается на воздухе, причем разлагается на КСl и MgCl2 . 6H2O, образуя густой рассол. Вкус жгучий, горько-соленый. Сильно флюоресцирует. При растворении в воде издает особый треск, похожий на хруст снега под ногами в сильный мороз. Это явление обусловлено тем, что в нем чаще, чем в других солях, присутствуют включения пузырьков газа, находящихся под большим давлением.
Диагностические признаки. Встречается в парагенезисе с каменной солью и сильвином. На воздухе быстро сыреет. От бишофита (MgCl2 . 6H2O) и тахгидрита (2MgCl2 . CaCl2 . 12Н2О), также расплывающихся на воздухе, отличим лишь по микрохимическим реакциям (содержит К) и по окрашиванию пламени в фиолетовый цвет, лучше заметный через синее стекло. При сверлении острием ножа в свежем изломе издает характерный треск, обусловленный внезапным расширением включенных пузырьков газа.
П. п. тр. легко плавится. При нагревании на стекле зерна карналлита, как и многие другие богатые водой кристаллогидраты, растворяются в собственной кристаллизационной воде и разлагаются. При постепенном высушивании образуются мелкие кубики KCl.
Происхождение и месторождения. Образуется одним из последних из рапы соляных озер, обогащенной магнием и калием. Поэтому встречается в верхних горизонтах погребенных соляных залежей осадочного происхождения, образуя горизонты выше отложений сильвинита. Иногда выделяется на стенках сухих выработок из стекающих по поверхности полости рассолов.
В России в громадных количествах присутствует в Соликамском месторождении, описанном выше (см. сильвин). В больших массах известен также в Штассфуртском месторождении (Германия), в Калуше (Западная Украина) и других пунктах.
Практическое значение. Так же как сильвин и другие соли калия, служит сырьем для удобрений почв.
При электролизе обезвоженного карналлита в закрытых ваннах получается всплывающий металлический магний; обогащенные калием остатки перерабатываются на удобрения.
Металлический магний после рафинирования идет на изготовление легких прочных сплавов с алюминием (дюралюминий, магналий и др.), употребляемых в авиационной промышленности, а также в качестве восстановителя при получении металлического титана. Кроме того, он применяется для сигнальных огней, получения вспышек сильного света (в фотографии) и для других целей.
Бром, получаемый из рассолов карналлита химическим путем, имеет применение в медицине (бромистый калий), фотографии и пр.
К этой группе относятся нормальные хлориды, бромиды и иодиды Ag, Cu, Hg и Pb, встречающиеся в зонах окисления рудных месторождений в условиях жаркого сухого климата. Мы рассмотрим лишь хлораргирит.
ХЛОРАРГИРИТ — AgCl. От названия хлора и греч. аргирос — серебро. Синонимы: кераргирит (от греч. кepac — рог), роговая серебряная обманка (в изломе по внешнему виду минерал часто напоминает роговое вещество).
Химический состав. Ag — 75,3 %, Сl — 24,7 %. В виде примесей иногда присутствуют Hg и Br (бромистая разновидность называется эмболитом).
Сингония кубическая; гексаоктаэдрический в. с. Пр. гр. Fm3m(О5h). а0 = 5,547. Кристаллическая структура относится к типу NaCl. В виде кристаллов встречается редко. Они имеют кубический облик. Двойники по (111). Обычно наблюдается в виде корочек, кристаллических налетов, натечных роговидных или восковидных масс.
Цвет. В свежих образцах бесцветный или слабо окрашен в желтоватые, синевато-зеленоватые или буроватые оттенки. На свету темнеет, приобретая вначале фиолетово-серый, а с течением времени даже черный цвет (очевидно, вследствие выделения тонкодисперсного Ag). Блеск алмазный для кристаллов и восковой для скрытокристаллических плотных масс. N = 2,07.
Твердость 1,5–2. Режется ножом. Ковкий. Спайность отсутствует. Уд. вес 5,55. Прочие свойства. Нерастворим в воде.
Диагностические признаки. Характерны низкая твердость, высокая плотность, высокий показатель преломления, нерастворимость в воде и химические реакции.
П. п. тр. на угле легко плавится (при 450–500 °С) и вскипает. При присадке соды в восстановительном пламени легко дает металлическое серебро. В кислотах почти не растворяется (лишь отчасти в HCl). Образует раствор лишь с аммиаком, что весьма характерно.
Происхождение и месторождения. Встречается в зонах окисления месторождений серебросвинцовых руд, образуясь при реакции окисления серебряных минералов с хлорсодержащими просачивающимися поверхностными водами. В более значительных массах наблюдается в местностях с сухим жарким климатом. Известны псевдоморфозы по самородному серебру.
В России очень небольшие количества кераргирита встречаются в зонах окисления ряда месторождений Южного Урала (Михайловский прииск в Баймакском районе) и Алтая (Змеиногорский рудник). В Нагольном кряже (Украина) в начале XX в. отмечались залежи эмболита в приповерхностной части серебросодержащей кварц-сульфидной жилы. Наибольшие скопления кераргирита и других галоидных соединений серебра наблюдались в месторождениях пустыни Атакама (Чили), в Боливии, Мексике и Австралии.

