Наибольшее значение среди относящихся сюда минералов имеют так называемые гидраты, или гидроокислы, т. е. соединения металлов с гидроксильной группой ОН, полностью или частично заменяющей ионы кислорода в окислах. Например, окислу магния (MgO) отвечает Mg(OH)2, окислу алюминия (Аl2О3) соответствует 2АlO(ОН) или 2Аl(ОН)3 и т. д.
Большинство подобных соединений кристаллизуются в слоистых структурах, характеризующихся гексагональной или близкой к ней плотнейшей упаковкой ионов (ОН)1–. Этим объясняются многие общие физические свойства этих минералов. Оптимальными катионами для соединений со слоистой структурой являются Mg2+, Fe2+, Mn2+, Al3+, Fe3+ и Сr3+.
Данная группа представлена гидратами двухвалентных металлов Mg, Fe, Mn, кристаллизующихся в тригональной или гексагональной сингонии. Здесь мы рассмотрим лишь один брусит.
БРУСИТ — Mg[OH2]. Химический состав. MgO — 69 %, Н2О — 31 %. В виде изоморфных примесей иногда присутствуют Fe (железный брусит) и Mn (марганцовистый брусит).
Сингония тригональная; дитригонально-скаленоэдрический в. с. L363L23PC. Пр. гр. P3_m(D53d). a0 = 3,125; с0 = 4,72. Кристаллическая структура типичная слоистая. В ней в качестве аниона участвует дипольная гидроксильная группа [ОН]1–. В кристаллической структуре эти группы уложены по принципу плотнейшей гексагональной упаковки (рис. 196) и образуют пачки. Каждая пачка состоит из двух плоских слоев, сложенных ионами гидроксила параллельно плоскости (0001). Между этими слоями лежит лист из катионов Mg2+. Последние занимают все октаэдрические пустоты между двумя слоями ОН, т. е. каждый ион Mg располагается между шестью гидроксильными анионами, будучи связан с тремя ионами [ОН]1– одного слоя и тремя ионами [ОН]–1 другого слоя. Октаэдры, центрированные магнием, связываются через общие боковые (наклонные) ребра с тремя соседями каждый, образуя катионный слой. Октаэдрические слои с Mg2+ следуют через один, чередуясь со слоями незанятых октаэдров; совершенная спайность проходит между заполненными октаэдрами слоями, сцепленными друг с другом слабыми остаточными силами связи. Облик кристаллов. Наблюдающиеся кристаллы обладают толстотаблитчатым обликом. Обычны листоватые талькоподобные агрегаты. Встречаются также образования почковидной и гроздевидной формы.
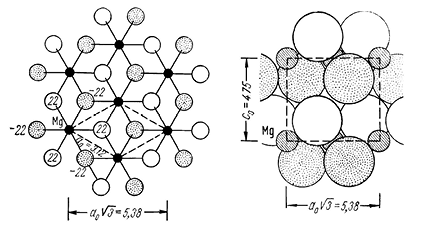
Рис. 196. Кристаллическая структура брусита:
а — проекция структуры на плоскости (0001).
Полые кружки (ОН) располагаются выше, а покрытые точками —
ниже слоя катионов Mg2+; б — вид двух насыщенных валентностями
пачек, каждая из которых состоит из двух слоев гидроксильных ионов
и заключенного между ними слоя ионов магния
Цвет брусита белый, изредка зеленоватый, голубой или бесцветный. Блеск его в изломе стеклянный, на плоскостях спайности перламутровый. Ng = 1,580 и Nт = 1,559.
Твердость 2,5. Спайность весьма совершенная по {0001}. Тонкие отщепляемые листочки гибки. Уд. вес 2,3–2,4.
Диагностические признаки. Похож на тальк — Mg3[Si4O10][OH]2, пирофиллит — Al2[Si4O10][OH]2 и гиббсит — Аl[ОН]3. Легче всего отличается от них легкой растворимостью в HCl.
П. п. тр. не плавится. Накаленный, светится ярким светом. В кислотах легко растворяется без вскипания. В запаянной трубке выделяет воду.
Происхождение. Образуется при гидролизе растворенных соединений магния в резкощелочной среде. Часто встречается в виде тонких жилок и примазок по трещинам в серпентинитах — продуктах гидротермального изменения богатых магнезией ультраосновных изверженных пород (дунитов, перидотитов). Ассоциирует с серпентином, гидрокарбонатами магния, арагонитом и др. Наблюдается иногда в доломитизированных известняках с кальцитом, гидромагнезитом и периклазом, нередко в псевдоморфозах по нему, имеющих, вероятно, гидротермальное происхождение. Имеются указания также на находки его в сильнощелочных почвах.
В поверхностных условиях в более кислых средах брусит легко карбонатизируется.
Практическое значение. В случае наличия больших масс может представлять интерес как сырье для получения магния.
Встречается во всех массивах невыветрелых серпентинитов Урала, Кавказа и Сибири. Волокнистая асбестовидная разность — немалит — известна в Баженовском (г. Асбест, к востоку от Екатеринбурга) и Ак-Довурак (Тува) месторождениях хризотил-асбеста, в Белом Осыпище в долине р. Лаба в Краснодарском крае среди гидротермально измененных дунитов.
Сюда относятся так называемые тригидраты некоторых трехвалентных металлов. Наиболее распространен в природе Аl[ОН]3. Гидрат окисного железа Fe[OH]3, образующийся в первые моменты при гидролизе солей этого металла, неустойчив и быстро подвергается обезвоживанию. Ион Fe3+ в небольших количествах иногда входит лишь изоморфно в состав Al[ОН]3. В гидратах алюминия также в виде изоморфной примеси присутствует Ga3+ в значительно повышенных против кларка количествах.
ГИББСИТ — Аl[ОН]3. Назван в честь минералога из США Д. Гиббса (1776–1833). Впервые был установлен в XIX столетии на Урале. Синоним: гидраргиллит, от греч. гидор — вода и аргиллос — белая глина.
Химический состав. Аl2О3 — 65,4 %, Н2О — 34,6 %. В виде изоморфной примеси устанавливаются Fe2O3 (до 2 %), а также Ga2O3 (до 0,006 %). Химические анализы часто обнаруживают почти полное совпадение состава с теоретической формулой.
Сингония моноклинная; призматический в. с. L2PC. Пр. гр. Р21/п(С22h). a0 = 8,624; b0 = 5,060; с0 = 9,700, β = 94°34′. Кристаллическая структура слоистая, близкая к искаженной структуре брусита. Некоторые особенности ее обусловлены тем, что ион алюминия по сравнению с ионом магния обладает большим зарядом и меньшей величиной ионного радиуса. В гиббсите, так же как и в брусите, каждая пачка состоит из двух слоев плотно упакованных гидроксильных ионов, между которыми располагается слой катионов Аl3+ (рис. 197). Так как заряд иона алюминия больше, чем заряд иона магния, то для нейтрализации отрицательного заряда гидроксильных ионов требуется меньшее число катионов Al3+. Поэтому катионы Аl3+ занимают не все октаэдрические пустоты между слоями ОН, как это имеет место в брусите, а только две трети их.
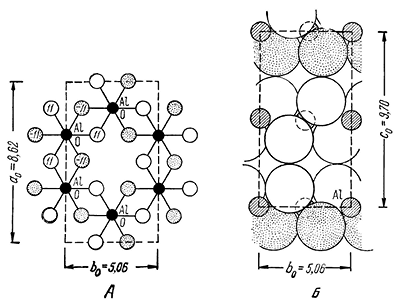
Рис. 197. Кристаллическая структура гиббсита
В связи с этим ионы Аl3+ располагаются не в виде центрированных гексагонов, как в структуре брусита, а по корундовому мотиву в виде простых шестиугольников (ср. расположение черных точек на рис. 196 и 197). Если оконтурить такой шестиугольник, то легко видеть, что на него в пачке структуры брусита приходится шесть гидроксильных ионов и три полных иона Mg2+ (один центральный ион плюс шесть периферических, каждый по 2/6 валентности), т. е. формула гексагона будет Mg3[OH]6. Для структуры же гиббсита, при том же числе гидроксильных ионов, в формуле гексагона будет только два иона Аl3+, т. е. она будет иметь вид Аl2[ОН]6. Различие заключается также в способе сочленения пачек друг с другом: в то время как в структуре брусита каждый ион [ОН]1– приурочивается к центру между тремя ионами [ОН]1– следующего слоя, в структуре гиббсита каждый ион [ОН]1– одного слоя противостоит каждому иону [ОН]1– следующего слоя (см. правые части рис. 196 и 197).
Облик кристаллов шестиугольно-таблитчатый (рис. 198). Распространены сложные двойниковые сростки по нескольким законам, обычно по (100) и (110). Чаще наблюдается в лучисто-листовых агрегатах, иногда в виде сферолитовых корок или бобовидных или шаровидных конкреций. В главной же своей массе на земной поверхности распространен в тонкочешуйчатых или скрытокристаллических массах.
Рис. 198. Кристалл гиббсита
Цвет гиббсита белый, или он слабо окрашен в сероватый, зеленоватый и красноватый оттенки. Блеск стеклянный, на плоскостях спайности перламутровый. Ng = 1,587, Nm = 1,566 и Np = 1,566.
Твердость 2,5–3,5. Спайность весьма совершенная по базопинакоиду {001}. Уд. вес 2,43. Прочие свойства. При нагревании сначала превращается в бёмит — AlOOH, затем, при прокаливании до 950 °С, в γ-Аl2О3 (кубической структуры типа шпинели).
Диагностические признаки. Для гиббсита характерными признаками являются следующие: весьма совершенная спайность, стеклянный блеск и малый удельный вес. От похожего на него диаспора отличается твердостью (у диаспора 6–7). От слюды отличается по удельному весу и оптическим свойствам (слюды оптически отрицательны).
П. п. тр. не плавится; выделяя ОН, белеет и становится непрозрачным. Гидроксил при этом теряется в два этапа: 1) при температуре 196–202 °С (превращение в бёмит); 2) при температуре 510 °С (дальнейшая дегидратация). Прокаленный, будучи смочен раствором Co, окрашивается в ярко-синий цвет. Как и гидраты других металлов, переходит в раствор в солянокислой вытяжке.
Происхождение и месторождения. Образуется при разложении и гидролизе алюминийсодержащих силикатов отчасти при гидротермальных процессах (при сравнительно низких температурах), но главным образом при экзогенных процессах выветривания, и притом преимущественно в условиях жаркого климата в тропических и субтропических странах.
Гиббсит гидротермального происхождения встречается сравнительно редко и в очень небольших количествах. Он наблюдается в некоторых эндогенных месторождениях как один из последних минералов, образовавшихся из низкотемпературных гидротермальных растворов.
При процессах выветривания в жарких странах гидраты глинозема, в том числе гиббсит, образуются обычно совместно с гидратами железа. Гиббсит в значительно больших количествах присутствует в так называемых латеритах1, т. е. продуктах выветривания, широко распространенных в пределах современных тропических стран в виде покрова на коренных горных породах и состоящих в основном из гидроокислов, содержащих Fe2O3 и в меньшей степени Аl2О3 и SiO2. Он наблюдается и в бокситах, состоящих преимущественно из гидратов Al и образующихся также осадочным путем в водных бассейнах, очевидно, при размыве коры выветривания горных пород.
Образование бокситов для ряда месторождений приписывают также процессам разложения известняков и доломитов в экзогенных условиях, допуская, что глинистые остатки от выщелачивания могли в щелочной среде подвергаться дальнейшему разложению с выносом освободившегося кремнезема.
При процессах регионального метаморфизма гиббсит, обезвоживаясь, переходит в диаспор, а в более глубинных условиях — в корунд (наждак) или, в присутствии SiO2, — в силикаты алюминия, или алюмосиликаты.
Как спутник диаспора гиббсит установлен в месторождениях боксита в Тихвинском районе Ленинградской области и в других местах. Кристаллы гиббсита до 5 см в поперечнике, имеющие минералогическое значение, были встречены среди гидротермальных образований в Шишимских и Назямских горах в Златоустовском районе (Южный Урал) среди метаморфических сланцев, а также в виде продуктов изменения нефелина в пегматитах Вишневых гор (Средний Урал).
Практическое значение. Гиббсит, так же как и диаспор и бёмит, входящие в состав бокситов, является источником глинозема, из которого, как известно, выплавляется один из наиболее легких металлов — алюминий. Для этих целей используются бокситы с содержанием кремнезема не выше 10–15 %.
В химической промышленности применяются маложелезистые (светлой окраски) бокситы с целью получения солей алюминия, главным образом сульфатов. Более низкие сорта бокситов используются для производства абразивов (алунда и алоксита). Из них изготовляются также огнеупоры для высокотемпературных печей (температура плавления выше 2000 °С). Возрастает применение специальных сортов бокситов в качестве адсорбента при очистке нефтяных и растительных масел, для изготовления красок, в качестве катализаторов и пр.
САССОЛИН — B[ОН]3. Сингония триклинная; пинакоидальный в. с. С. Наблюдается в тонкочешуйчатых, шестигранно-таблитчатых бесцветных или слабоокрашенных кристалликах. Блеск стеклянный, на плоскостях спайности перламутровый. Оптически отрицательный. Ng = 1,459, Nm = 1,456 и Np = 1,340.
Твердость 1. Спайность весьма совершенная по {001}. Уд. вес 1,48. Легко плавится. Пламя окрашивает в зеленый цвет. В холодной воде растворяется плохо, обладает слабосолоноватым холодящим вкусом.
Выделяется в виде белых выцветов как продукт деятельности фумарол в вулканических районах: в больших количествах на о. Вулкано (Липарские острова, у северо-восточного конца о. Сицилия), в трещинах вулкана Авача на Камчатке и других местах. Впервые был найден в Сассо в Тоскане (Италия). В растворенном состоянии гидрат бора часто устанавливается в нефтяных водах и выбросах грязевых вулканов (на Керченском полуострове и на Кавказском побережье Каспийского моря).
3. Группа лепидокрокита — гётита
Сюда относятся так называемые моногидраты трехвалентных металлов Al, Fe, Mn и Со. Эти соединения диморфны; кристаллизуются оба полиморфа в ромбической сингонии.
К подгруппе лепидокрокита (FeOOH) относится его алюминиевый аналог— бёмит (AlOOH), а к подгруппе гётита (HFeO2) — диаспор (HAlO2). Здесь же опишем манганит, эмпирическая формула которого аналогична указанным соединениям, хотя по остальным признакам он имеет мало общего с ними.
БЁМИТ — γ-АlООН. Назван по фамилии немецкого минералога И. Бёма (1857—1938), установившего путем рентгенометрических исследований присутствие этого минерала в боксите, сходного по кристаллической структуре с лепидокрокитом (FeOOH).
Химический состав такой же, как диаспора. Аl2О3 — 84,97 % (по формуле). Содержит также SiO2, Fe2O3 (по-видимому, в виде механической примеси опала и гидроокислов железа), а также Ga2O3.
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Amam(D182h). a0 = 3,78; b0 = 11,8; с0 = 2,85. Кристаллическая структура аналогична структуре лепидокрокита и описана ниже. Облик кристаллов. В трещинах и порах среди боксита, а также продуктов разложения нефелина устанавливается в виде очень мелких пластинчатых или чечевицеобразных кристалликов (рис. 199), представленных обычно комбинациями (010), (111), (113), {110} и др. Характерно, что грани {010} являются блестящими, а грани остальных форм матовыми. Обычно же распространен в виде скрытокристаллической массы или в колломорфных образованиях (в бокситах).
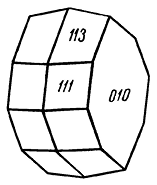
Рис. 199. Кристалл бёмита из Вишневых гор
(по Э. М. Бондштедт-Куплетской)
Цвет. Бесцветный или белый с желтоватым оттенком. Средний показатель преломления для скрытокристаллических разностей равен 1,640–1,645.
Твердость 3,5. Спайность совершенная по {010}. Уд. вес 3,01–3,06. При прокаливании превращается в γ-Аl2О3 (кубическую модификацию, кристаллизующуюся в структуре шпинели).
Диагностические признаки. Ввиду ничтожности размеров кристалликов наиболее надежно устанавливается рентгеновским методом. От диаспора отличается меньшим показателем преломления и более низкой твердостью.
П. п. тр. не плавится, белеет и расщепляется по спайности. В стеклянной трубке выделяет воду. В кислотах нерастворим.
Происхождение и месторождения. Некоторое время бёмит был известен лишь в экзогенных месторождениях боксита (см. гиббсит). Он встречен в древней коре выветривания в Яковлевском месторождении (КМА) в ассоциации с каолинитом на метаморфических сланцах железо-магнезиально-глиноземистого состава. Позже он был установлен как низкотемпературный гидротермальный минерал в виде мелких кристалликов (см. рис. 199) в пустотах среди пегматитов щелочных пород в Вишневых горах (Средний Урал) в ассоциации с водяно-прозрачным гиббситом на игольчатых кристаллах цеолита (натролита). Он образовался, по-видимому, в результате гидротермального изменения нефелина.
ЛЕПИДОКРОКИТ — γ-FeOOH. От греч. лепидос — пластинка, крокос — шафран. Синоним: рубиновая слюдка.
Химический состав тождествен составу гётита. Согласно имеющимся анализам, примесей гораздо меньше, чем в гётите. Так же как и для гётита, существуют разности, содержащие адсорбированную воду (в тонкокристаллических колломорфных массах), носящие название гидролепидокрокита — FeOOH . aq.
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр. Атат(D172h). а0 = 3,87; b0 = 12,51; с0 = 3,06. Кристаллическая структура. Как можно видеть на рис. 200, катионы Fe3+ находятся в шестерном окружении ионов кислорода (не показаны лишь передний и задний анионы). Последние располагаются по вершинам искаженных октаэдров, связанных между собой в цепи, вытянутые параллельно оси а. Эти цепи боковыми связями (через ребра октаэдров) соединены друг с другом в непрерывные двойные слои параллельно (010), т. е. перпендикулярно плоскости чертежа (в вертикальном направлении). Как изображено на рис. 200, такие двойные слои соединены друг с другом слабыми водородными связями в виде непрерывных зигзагообразных шнурков: —О—Н—О—Н—О—. Каждый примыкающий к Н-ионам анион О2–, с одной стороны, связан с двумя катионами Fe3+, получая от них по 1/2 валентности, с другой — с двумя Н-катионами, в результате чего имеет место полное насыщение его валентности.
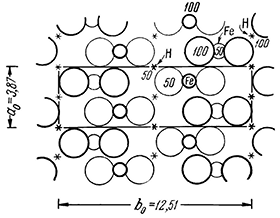
Рис. 200. Кристаллическая структура лепидокрокита — FeOOH.
Крупные кружки — ионы кислорода, малые кружки — ионы Fe3+.
Звездочками показаны вероятные положения иона Н1+
Что касается анионов О2–, расположенных внутри двойных слоев (рис. 200), то их валентность также полностью удовлетворяется долями валентностей, отдаваемых катионами Fe3+ (каждый анион O окружен четырьмя катионами Fe). Таким образом, в строении структуры лепидокрокита принимают участие два типа ионов кислорода, и формулу этого минерала поэтому приходится писать в виде FeOOH. Гидроксильные ионы как таковые отсутствуют в структуре. В структуре же гётита (HFeO2) все кислородные ионы химически эквивалентны. Упаковка ионов в структуре лепидокрокита менее плотная, что сказывается в меньшем его удельном весе. Облик кристаллов. Лепидокрокит встречается в виде пластинчатых по (010) кристалликов в пустотах (рис. 201), но чаще в виде тонкочешуйчатых или волокнистых агрегатов. Наблюдались и почковидные агрегаты на стенках жеод.
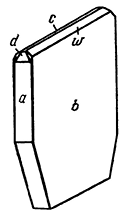
Рис. 201. Кристалл лепидокрокита:
а {100}, b {010}, с {001}, d {201}, w {031}
Цвет лепидокрокита темно-красный до красновато-черного; иногда с золотистым оттенком (в чешуйчатых массах). Черта оранжевая или кирпично-красная. Блеск алмазный. В тонких шлифах прозрачен. Ng = 2,51, Nm = 2,20 и Np = 1,94.
Твердость 4. Спайность весьма совершенная по {010} и совершенная по {001}. Уд. вес 4,09–4,1.
Диагностические признаки. Часто ошибочно принимают за гематит, особенно в плотных агрегатах. Отдельные пластинки лепидокрокита легко узнаются по форме кристалликов, просвечиваемости их красным цветом, оранжево-красной или красной черте и малому удельному весу (отличие от гематита).
П. п. тр. не плавится; при высоких температурах становится черным, магнитным. В стеклянной трубке выделяет воду. В HCl растворяется.
Происхождение и месторождения. Лепидокрокит в виде пластинчатых кристалликов (рубиновой слюдки) иногда наблюдается как один из наиболее поздних минералов гидротермальных месторождений, например в Зигене в Вестфалии (Германия), в жильных железорудных месторождениях Ангаро-Илимского района (в пустотах тонких кварцевых прожилков) и в других случаях. Гораздо чаще он наблюдается в виде концентрических слоев чешуйчатых агрегатов в экзогенных бурых железняках или на стенках жеод поверхностного происхождения: в Полетаевских месторождениях (к юго-западу от Челябинска), в окрестностях Липецка и в других местах.
Как по данным микроскопических исследований, так и по данным рентгенометрического изучения продуктов, образующихся при систематическом нагревании, оказывается, что лепидокрокит способен переходить в гётит. Условия, при которых происходят эти превращения, а также условия образования в природе различных модификаций моногидрата окиси железа еще не изучены. Вероятно, здесь играет роль степень кислотности среды (pH), при которой происходит образование гидратов окиси железа.
ДИАСПОР — HAlO2. От греч. диаспор — рассеяние (некоторые образцы при нагревании, растрескиваясь, распадаются на мелкие частички). Впервые установлен еще в позапрошлом столетии на Урале.
Химический состав. Аl2О3 — 85 %, Н2О — 15 %. Известны разности, содержащие в виде изоморфной примеси Fe2O3 (до 7 %), Мn2О3 (Mn-диаспор), Cr2O3 (до 5 %) и SiO2 (до 4 %). Устанавливается также повышенное содержание Ga2O3 (до нескольких сотых процента).
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23РС. Пр. гр. Pbnm(D162h). a0 = 4,40; b0 = 9,36; с0 = 2,84. Кристаллическая структура изображена на рисунке 202. Она характеризуется плотной гексагональной упаковкой ионов О2–, причем ионы Al3+ размещаются в октаэдрических пустотах, т. е. между шестью ионами О. Каждый ион кислорода связан с тремя ионами Аl, т. е. координационные числа для Аl и О те же, что и в кристаллической структуре рутила (6 и 3). Протоны Н1+ располагаются, вероятно, между парами ионов кислорода (рис. 202) и в силу совершенной ничтожности своих размеров не требуют какого-либо особого пространства в кристаллической структуре. Таким образом, практически структура диаспора сложена ионами Аl и О в отношении 1 : 2 (как в рутиле). Сходство с рутилом, как показал Н. В. Белов, заключается и в самих структурах этих минералов, с той разницей, что в диаспоре (гётите) вместо одинарных колонок из структуры рутила вдоль оси с тянутся сдвоенные колонки — фрагменты плотнейшей упаковки. Этим объясняются досковидный облик кристаллов, спайность и коленчатые двойники с углом около 122°.
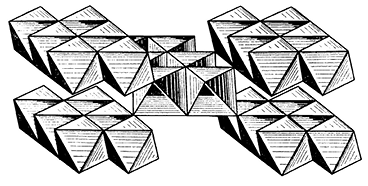
Рис. 202. Кристаллическая структура диаспора в полинговских полиэдрах
Облик кристаллов. Встречающиеся кристаллы имеют тонкопластинчатые, иногда таблитчатые по (010) формы (рис. 203), нередко столбчатые по оси с. Наблюдается вертикальная штриховатость граней. Обычно распространен в листоватых или тонкочешуйчатых агрегатах.
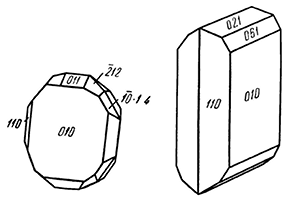
Рис. 203. Кристаллы диаспора
В левой фигуре вторая ось направлена к наблюдателю
Цвет диаспора бесцветный, белый, желтовато-бурый, светло-фиолетовый, зеленый, зеленовато-серый. Блеск стеклянный, на плоскостях спайности перламутровый. Черта белая. Ng = 1,750, Nm = 1,722 и Np = l,702.
Твердость 6–7. Очень хрупкий. Спайность по {010} ясная. Уд. вес 3,3–3,5. При прокаливании переходит в α-Аl2О3 (корунд).
Диагностические признаки. Для диаспора характерны листоватые агрегаты, высокая твердость (отличие от гиббсита, слюд и др.). Смешать можно только с некоторыми почти не различимыми по внешним признакам разностями хлоритоида (ортосиликата Fe, Mg и Аl), встречающегося иногда совместно с ним и корундом в метаморфических породах. В отличие от него диаспор не разлагается в H2SO4 и, кроме того, отличается по некоторым оптическим свойствам.
П. п. тр. не плавится. В кислотах и КОН не растворяется. В H2SO4 разлагается лишь после сильного прокаливания. В пробирке при накаливании распадается на мелкие белые чешуйки.
Происхождение и месторождения. Изредка встречается в некоторых контактово-метасоматических и гидротермальных месторождениях среди мраморизованных известняков в ассоциации с корундом, мусковитом, гематитом, рутилом и др.
В больших массах в виде тонкочешуйчатых агрегатов распространен в экзогенных месторождениях бокситов в парагенезисе с гиббситом, бёмитом и др.
Часто встречается в метаморфических породах совместно с корундом, хлоритоидом и другими минералами (в месторождениях наждака, вероятно, как продукт метаморфизма бокситов), иногда в кристаллических сланцах как породообразующий минерал в сопровождении кианита и других минералов.
В ассоциации с корундом и алюмосиликатами встречается в месторождениях наждака на Урале: Косой Брод (около Екатеринбурга) в мраморизованных известняках, по р. Борзовке (Кыштымский район).
Наблюдается также в месторождении Акташ (Узбекистан) в ассоциации с дюмортьеритом, пирофиллитом, алунитом и корундом, а также в других местах.
В крупных пластинках и кристаллах распространен в наждачных копях Честер в Массачусетсе (США), на о. Наксос (Греция) и в месторождениях Милас и Селкук (Турция).
О практическом значении бокситов см. выше (гиббсит).
ГЁТИТ — HFeO2. Гётит назван в честь поэта Гёте (1749–1832). Первоначально этот минерал был назван онегитом (по месту нахождения на Волк-острове в Онежском озере), но, так как его свойства не были описаны, это название не привилось в минералогической литературе. Синоним: «игольчатая железная руда» (в немецкой литературе). Является главной составной частью такого неоднородного, но широко распространенного и общеизвестного минерального образования, каким является лимонит (гидрогётит) — HFeO2 . aq.
Название лимонит происходит от греческого слова лемон — луг (имелись в виду луговые и болотные руды гидроокислов железа).
Химический состав. Fe2O3 — 89,9 %, Н2О — 10,1 %. Содержание воды часто бывает выше, чем полагается по формуле: до 12–14 % (лимонит). В связи с этим раньше выделяли несколько минеральных видов, отличающихся друг от друга по содержанию воды и некоторым физическим свойствам. Рентгенометрически установлено, что в действительности существует одно соединение с отношением Fe2O3 : Н2О = 1 : 1, обладающее определенной кристаллической структурой. Все более богатые водой разности гидроокислов железа по существу являются гидрогелями и содержат адсорбированную воду в разных количествах (в зависимости от степени дегидратации). Поэтому лимонит не является отдельным минеральным видом, представляя собой гидратированную разновидность гётита.
Так называемый турьит по рентгенометрическим и термическим исследованиям оказался смесью гётита с гидрогематитом и не принадлежит к числу самостоятельных минералов.
Скопления природных гидроокислов железа в своей массе, как правило, представляют собой гидратированные смеси гётита с лепидокрокитом, а также гидроокислами кремнезема, глинистым веществом и др. Такие смеси обычно называются бурыми железняками.
Сингония ромбическая; ромбо-дипирамидальный в. с. 3L23PC. Пр. гр Pbпт. а0 = 4,64; b0 = 10,0; с0 = 3,03. Кристаллическая структура аналогична структуре диаспора. Облик кристаллов и агрегаты. Редко встречающиеся кристаллы имеют игольчатый или столбчатый облик (рис. 204). Может давать двойники, аналогичные коленчатым двойникам рутила по (011). Обычно наблюдается в скорлуповатых, почковидных или сталактитовых формах (см. рис. 45) с тонким радиально- или параллельно-волокнистым строением в изломе («игольчатая железная руда») или в сплошных плотных, пористых ноздреватых, шлаковидных, порошковатых массах. Распространены псевдоморфозы по кристаллам пирита и другим сульфидам железа. Встречается также в виде оолитов, бобовин, конкреций и жеод.
Рис. 204. Кристалл гётита
Цвет лимонита и гётита темно-бурый до черного. Порошковатый или охристый лимонит, нередко образующийся при физическом выветривании за счет плотного черного лимонита и силикатов железа, обладает довольно светлым желто-бурым цветом. Как показали сравнительные химические и рентгенометрические исследования, эта охристая разность ничем особенным не отличается от плотного лимонита. Черта гётита бурая с красноватым оттенком. Лимонит большей частью имеет светло-бурую или желто-бурую окраску. Блеск гётита алмазный до полуметаллического. На поверхности почковидных или сталактитовых масс лимонита часто обнаруживается гётит в виде блестящих смоляно-черных тонких корочек. Nm = 2,35–2,39.
Твердость гётита 4,5–5,5, лимонита — 4–1 (в зависимости от физического состояния). Спайность гётита по {010} совершенная. Уд. вес гётита 4–4,4, у лимонита колеблется от 3,3 до 4.
Диагностические признаки. Гётит и лимонит сравнительно легко узнаются по неяснокристаллическим формам выделения, бурой черте и желто-бурым охристым примазкам.
П. п. тр. плавятся; при продолжительном нагревании становятся сильно магнитными. В стеклянной трубке выделяют воду, краснеют, превращаясь в безводную Fe2O3. В HCl медленно растворяются.
Происхождение и месторождения. Гётит в виде игольчатых или столбчатых кристалликов крайне редко наблюдается как эндогенный минерал: в пустотах мелафиров, в аметистовых жеодах на Волк-острове (Онежское озеро, Карелия); в пустотах пегматитовых жил Волыни (Украина), иногда в гидротермальных месторождениях как один из наиболее низкотемпературных минералов в пустотах, например в Пршибраме (Чехия), в ассоциации с более ранними, не затронутыми выветриванием сфалеритом и пиритом.
В главной же массе гётит и лимонит распространены как экзогенные минералы и притом почти исключительно в виде колломорфных или землистых масс. Они образуются преимущественно в результате гидролиза солей возникающих при окислении и разложении железосодержащих минералов: сульфидов, карбонатов, силикатов и др., в которых железо присутствует в двухвалентной форме. Образование гидроокислов железа на поверхности мы наблюдаем буквально всюду и притом в самых различных видах. В значительных массах бурые железняки образуются в зонах окисления сульфидных месторождений. Это так называемые железные шляпы, представленные рыхлыми, комковатыми и плотными массами, состоящими главным образом из лимонита, гётита, иногда лепидокрокита и др.
Большие массы гидроокислов железа заключены в осадочных месторождениях бурых железняков молодого (неогенового) возраста, образовавшихся в морских и озерных бассейнах. Накопление осадков гидроокислов железа, так же как и других гидроокислов, в прибрежных зонах этих бассейнов, очевидно, происходит путем коагуляции приносимых поверхностными водами коллоидных растворов в морских водах под действием электролитов, а в пресных озерах — в результате, вероятно, жизнедеятельности ферробактерий. Правда, в ряде осадочных месторождений гидроокислы железа, кроме того, дополнительно образуются в результате современного окисления попавших в зону окисления фаций карбонатных и силикатных руд железа.
Таким образом, лимонит и гётит почти исключительно образуются на самой поверхности в условиях полного доступа кислорода и влаги.
При региональном метаморфизме гидраты железа обезвоживаются и превращаются в безводные окислы (гематит и магнетит).
Из весьма многочисленных и разнообразных в генетическом отношении месторождений бурых железняков мы укажем лишь некоторые наиболее главные.
В пределах России известное Бакальское месторождение бурых железняков (Южный Урал, к юго-западу от Златоуста) образовалось в виде крупных железных шляп в результате окисления кристаллических сидеритовых руд, по-видимому, гидротермального происхождения. Наряду с мягкими рыхлыми рудами широко распространены жеоды бурых железняков, часто очень крупные. Стенки полостей покрыты почками лимонита и гётита. Эти руды малофосфористые, высокого качества. Халиловское месторождение бурых железняков (у ж.-д. ст. Халилово Оренбургской области, Южный Урал) образовалось в юрском периоде за счет выветривания и размыва массивов ультраосновных (серпентинитовых) пород. Поэтому бурые железняки несколько обогащены такими элементами, как никель и хром, являющимися ценными легирующими компонентами сталей. Никеленосные бурые железняки как остаточные продукты выветривания серпентинитов широко распространены на Урале; назовем Елизаветинское месторождение около Екатеринбурга.
Крупное месторождение преимущественно крупноолитовых бурых железняков находится на Керченском полуострове (Украина). Мощный рудный пласт залегает в мульдах среди осадков третичного возраста. Эти руды содержат 34–42 % Fe и обогащены фосфором. Аналогичные по составу руд, но заметно меньшего масштаба залежи имеются по соседству в России, на Таманском полуострове. Бурыми железняками представлены руды Эльзаса (Франция).
Практическое значение. Бурые железняки, так же как и гематитовые и магнетитовые руды, являются важнейшим сырьем для выплавки чугунов и сталей в доменных печах. В процессе нагревания этих руд в печах происходят полное их обезвоживание и образование чрезвычайно тонкопористых масс. Так как скорость восстановления руд сильно зависит от удельной поверхности массы, то эти руды являются более экономичными по сравнению с магнетитовыми и гематитовыми рудами. Поэтому требования к минимальному содержанию железа в них снижаются до 35–40 % (вместо 50–60 % для плотных магнетитовых и гематитовых руд).
МАНГАНИТ —Mn2+Mn4+O2[OH]2, или MnO2 . Mn[ОН]2. Наличие двух- и четырехвалентного (а не трехвалентного) марганца установлено путем изучения магнитной анизотропии ионов.
Химический состав. MnO — 40,4 %, MnO2 — 49,4 %, Н2О — 10,2 %. Примеси: SiO2 (до нескольких процентов), Fe2O3 (до 1 %), в незначительных количествах Аl2О3, CaO и др. Содержание Н2О в скрытокристаллических и оолитовых манганитовых массах, так же как и в гётите, бывает больше, чем это полагается по формуле (гидроманганит). Избыточная часть воды является адсорбированной, как это устанавливается по кривым обезвоживания.
Сингония моноклинная; призматический в. с. L2PC. Пр. гр. B21/d (C52h). a0 = 8,86; b0 = 5,24; с0 = 5,70, β = 90°. Кристаллическая структура существенно отличается от структуры гётита и пока еще не расшифрована. Облик кристаллов призматический (рис. 205), столбчатый по оси с. Грани {110} сильно исштрихованы в вертикальном направлении. Агрегаты. В пустотах гидротермальных месторождений нередко встречается в виде друз столбчатых кристаллов. В осадочных месторождениях широко распространены тонкокристаллические агрегаты. Наблюдается также в виде оолитов, изредка в натечных формах.
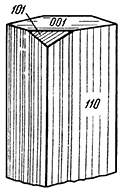
Рис. 205. Кристалл манганита
Цвет манганита черный. Черта бурая. Блеск полуметаллический. Ng = 2,53, Nm = 2,24 и Np = 2,24.
Твердость 3–4. Хрупок. Спайность по {010} совершенная. Уд. вес 4,2–4,33.
Диагностические признаки. Кристаллы легко узнаются по столбчатому облику, характерной штриховке граней призмы и по бурой черте. Для колломорфных богатых водой разностей характерен бурый цвет самого минерала и черты. Для точной диагностики необходимы рентгенограммы.
П. п. тр. не плавится. В закрытой стеклянной трубке обильно выделяет воду. Перл буры и фосфорной соли в окислительном пламени фиолетовый (присутствие марганца). В концентрированной HCl растворяется с выделением хлора.
Происхождение и месторождения. Вообще образуется при недостатке кислорода. Встречается в виде друз кристаллов в некоторых гидротермальных месторождениях марганца как один из последних по времени выделения минералов в парагенезисе с баритом и кальцитом.
В больших массах встречается в осадочных месторождениях в виде оолитов и сплошных масс, занимая промежуточное положение между фациями псиломелано-пиролюзитовых руд (соединений четырехвалентного марганца) и более удаленных от береговой линии карбонатных руд, содержащих двухвалентный марганец.
В глинах обнаруживается иногда в виде желваков с радиально-лучистым строением.
В зоне окисления неустойчив. Легко превращается в скрытокристаллический, почти безводный MnO2, т. е. весь марганец окисляется до четырехвалентного состояния. Поэтому в марганцевых шляпах манганит встречается сравнительно редко.
В значительных массах манганит известен в Чиатурском месторождении (Грузия) в виде оолитовых руд бурого цвета. В шарообразных конкрециях черного цвета широко распространен также в Никопольском месторождении (Украина).
В виде кристаллов, нередко крупных, он известен в гидротермальном месторождении Ильфельд в Гарце, Ильменау в Тюрингии (Германия) и в других местах.
Практическое значение. Наряду с пиролюзито-псиломелановыми рудами представляет собой важное сырье для получения ферромарганца и других сплавов с железом (шпигеля, силикошпигеля), употребляемых при выплавке сталей.
В эту группу входят разнообразные гидроокислы марганца сложного и непостоянного состава, наблюдавшиеся в виде скрытокристаллических и колломорфных образований. Раньше их относили целиком к аморфным веществам. Однако рентгенометрическими исследованиями устанавливается, что многие из них кристалличны и по структуре не только не походят ни на один из ранее рассмотренных окислов и гидроокислов марганца, но, согласно незаконченным рентгенометрическим исследованиям В. И. Михеева, сами отличаются друг от друга по кристаллической структуре в зависимости от тех катионов, которые входят в их состав.
Химическая конституция для многих из этих гидроокислов уточненена. Они представляют собой сложные гидраты. Наиболее простым по составу является «моногидрат» двуокиси марганца — MnO2 . Н2О, который, по мнению В. И. Вернадского, относится к природной метамарганцовистой кислоте H2MnO3, легко получаемой в лабораторных условиях в виде шоколадно-бурого геля. В состав более сложных соединений, кроме окислов марганца — MnO2 и MnO, входят следующие окислы: К2О, BaO, CaO, иногда PbO, ZnO, CoO, NiO, CuO, изредка Li2O, WO3, P2O5, As2O5 и др. Устанавливаются также коллоидальные смеси гидроокислов марганца с гидроокислами SiO2, Fe2O3, Al2O3 и органическими веществами. Этим соединениям, в зависимости от того, какие из окислов металлов входят в их состав, дано много различных названий.
Все эти минеральные виды в полевых условиях называются просто собирательным названием «псиломелан». Точное установление минерального вида может быть сделано на основании рентгенограмм и данных химических анализов. Термограммы, к сожалению, почти ничего не дают для диагностики этих минералов.
Мягкие порошковатые разности псиломеланов бурой или черной окраски раньше называли вадом. В настоящее время этот термин утратил свое значение, так как детальное изучение этих разностей с помощью химических анализов и рентгенографии показало, что в этом виде могут существовать самые различные по составу минералы: минеральные виды группы псиломелана, а также манганит, рамсделлит и др.
ПСИЛОМЕЛАН — mMnO . nМnО2 . lН2О. Не может быть охарактеризован определенной формулой. Псилос по-гречески — лысый, мелас — черный («черная стеклянная голова»). В американской литературе под этим термином предлагается подразумевать существенно бариевую разность, другими авторами называемую романешитом (в настоящее время — минеральный вид с формулой (Ba, H2O)(Mn4+, Mn3+)5O10). Основанием этому послужило то, что первые образцы, названные псиломеланом, как было установлено впоследствии, оказались богатыми барием. Однако наиболее широко распространенной из всех разностей группы псиломелана является бедная барием. В настоящее время термин «псиломелан» не имеет статуса видового названия, так как является собирательным названием и охватывает широкий круг минералов марганца и их смесей, обладающих высокой плотностью в отличие от рыхлого и мягкого вада.
Химический состав непостоянен. Соотношение MnO и MnO2 колеблется в относительно широких пределах в зависимости от степени окисления низшего окисла марганца. Содержание MnO2 обычно составляет 60–80 %, MnO сравнительно невелико 8–25 %, Н2О 4–6 % (большая ее часть удаляется при температуре свыше 110 °С). В небольших количествах часто присутствуют BaO (до нескольких процентов), иногда щелочи, CaO, CoO, MgO, ZnO, а также SiO2, Fe2O3, Al2O3 в виде посторонних примесей. Изредка устанавливается WO3 (до 1, а иногда до 5–8 %) — тунгомелан.
Сингония не устанавливается однозначно, в большинстве псиломеланов велика доля ромбической составляющей. Обычно наблюдается в почковидных формах с концентрически-зональным строением или в тонкокристаллических агрегатах. Нередки дендритовидные налеты (см. рис. 51).
Цвет псиломелана черный, иногда буровато-черный. Черта обычно черная. Блеск полуметаллический до алмазного, у рыхлых разностей матовый.
Твердость 4–6 (для плотных разностей), колеблется в зависимости от содержания воды и физического состояния. Хрупок. Уд. вес 4,4–4,7.
Диагностические признаки. Принадлежность к группе псиломелана устанавливается по формам агрегатов, черной черте и реакции на марганец. Точная диагностика пока возможна лишь с помощью химического анализа.
П. п. тр. не плавится. При растворении в соляной кислоте выделяется хлор. В закрытой трубке выделяет воду и кислород. С бурой и фосфорной солью в окислительном пламени дает фиолетовый перл.
Происхождение и месторождения. Подобно всем образованиям, объединяемым под названием псиломелана, образуется главным образом в экзогенных условиях: в зонах окисления месторождений марганцевых руд и в месторождениях осадочного происхождения. Как второстепенный минерал встречается также в рудах марганца гидротермального генезиса.
В зонах окисления он образуется в основном за счет таких минералов, как браунит, гаусманит, иногда силикатов и карбонатов марганца (совместно с вернадитом), а также самостоятельным путем при коагуляции гидроокислов марганца в виде натечных форм в пустотах и в виде плотных масс.
В осадочных месторождениях марганца псиломелан встречается в виде прослоев плотных руд или оолитов и шарообразных конкреций с концентрически-скорлуповатым строением.
При выветривании псиломелан подвергается окислению и дегидратации. При этом за счет его образуется пиролюзит, главным образом на поверхности пустот и пор, часто в виде черной сажистой массы. К крупнейшим осадочным месторождениям марганца, в которых встречается псиломелан, принадлежат Чиатурское (Грузия) и Никопольское (Украина).
Практическое значение. Вместе с пиролюзитом и другими окисными минералами марганца является главной рудой, используемой в черной металлургии для выплавки ферромарганца. Более бедные марганцем руды используются для подшихтовки при выплавке из железных руд обыкновенных чугунов.
В заключение надо отметить, что диагностика полиминеральных смесей, да и более или менее чистых оксидных марганцевых минералов, требует применения сложных методик, таких как электронная микроскопия и ИК-спектроскопия. В то же время при визуальной диагностике подобные образования заслуживают хоть какого-то предварительного заключения с учетом легкоопределяемых свойств и характерной морфологии; именно в таких случаях может быть употреблено название «псиломелан».
1 Латер (лат.) — кирпич (продукты выветривания по цвету напоминают хорошо обожженный кирпич).

