Фториды как минералы имеют довольно ограниченное распространение в природе, хотя общее число элементов, участвующих в соединениях с фтором, достигает 15, и это не учитывая тех минералов, в которых фтор наряду с гидроксилом выполняет роль дополнительного аниона. Главное значение из них имеет фторид Са в виде самостоятельного соединения CaF2. Гораздо меньшая роль принадлежит Be, Аl и Si. Другие элементы входят в состав крайне редких фторидов.
Установленные до сих пор более широко распространенные фториды встречаются преимущественно в гидротермальных образованиях, а редкие — в продуктах возгона при вулканических извержениях. Судя по парагенезису минералов, они образуются при относительно повышенных температурах. Лишь CaF2 в виде новообразований рассеянных мельчайших кристалликов нередко встречается также в зонах окисления рудных месторождений и в некоторых осадочных породах.
Среди относящихся сюда природных соединений рассмотрим следующие минералы: флюорит и криолит.
ФЛЮОРИТ — CaF2. Название произошло от fluorum — латинского названия элемента F. Синоним: плавиковый шпат1. Этот минерал, как и другие богатые фтором минералы, является хорошим флюсом для руд, ускоряя их плавление.
Химический состав. Са — 51,2 %, F — 48,8 %. Иногда содержит в виде изоморфной примеси Сl (главным образом желтые разности). В некоторых случаях обнаруживаются битуминозные вещества, издающие запах. Из других примесей укажем Fe2O3, редкие земли, изредка уран (до нескольких процентов), фтор и гелий.
Сингония кубическая; гексаоктаэдрический в. с. 3L44L366L29PC. Пр. гр. Fm3m(О5h). a0 = 5,450. Кристаллическая структура является типической для многих соединений типа АХ2 (рис. 134).
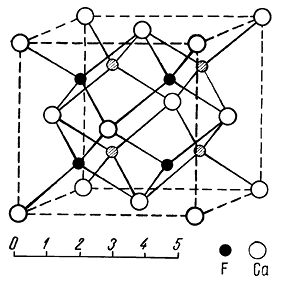
Рис. 134. Кристаллическая структура флюорита
Она характеризуется двумя координационными числами: для Са — 8 и для F — 4. Ионы F1– расположены по углам, а ионы Са2+ занимают центры малых кубов через один (рис. 135).
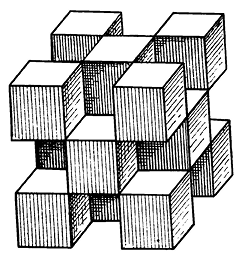
Рис. 135. Кристаллическая структура флюорита (по Н. В. Белову).
Вершины каждого кубика заняты F, а центры — Ca
Можно считать катионы Са2+ формально находящимися в позициях плотнейшей кубической упаковки, тогда как анионы F1– занимают все тетраэдрические пустоты; реально структура флюорита, конечно, не является плотноупакованной. Облик кристаллов. В пустотах встречается в виде хорошо образованных кубических, реже октаэдрических и додекаэдрических кристаллов. Кроме форм {100}, {111} и {110} иногда присутствуют {210}, {421} и др. Грани куба обычно гладкие, а октаэдрические грани матовые. Иногда грани куба имеют мозаичное строение и паркетообразный рисунок; антискелетное развитие таких кристаллов может привести к возникновению гранных форм {100} с октаэдрическим обликом (рис. 136). Двойники часты по (111). Агрегаты. Чаще наблюдается в виде вкраплений и сплошных зернистых, реже землистых масс (ратовкит).
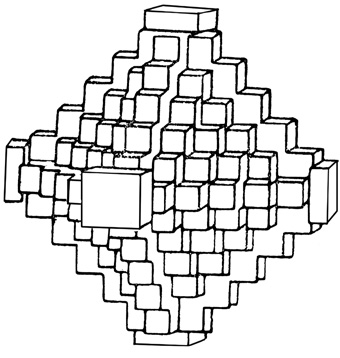
Рис. 136. Автоэпитаксическое обрастание октаэдра флюорита кубическими
субиндивидами привело к образованию вершиннореберного
скелетного кристалла октаэдрического облика
Цвет. Флюорит редко бывает бесцветным и водяно-прозрачным. Большей частью окрашен в различные цвета: желтый, зеленый, голубой, фиолетовый, иногда фиолетово-черный. Любопытно, что окраска исчезает при нагревании и вновь возвращается при облучении рентгеновскими лучами. В бесцветных кристаллах можно вызвать фиолетовую окраску также действием паров металлического кальция и электрическими разрядами. Это наводит на мысль, что в ряде случаев цвет обусловлен появлением в кристаллической структуре дефектных центров окраски, каждый из которых представляет собой вакансию на месте аниона F1–, замещенного свободным электроном. Блеск стеклянный. N = 1,434.
Твердость 4. Хрупок. При продолжительном одностороннем давлении обнаруживает пластическую деформацию. Спайность совершенная по октаэдру, а не по ромбическому додекаэдру, как это можно было бы ожидать исходя из представлений о том, что наименьшее сцепление должно иметь место для плоских сеток с наибольшими расстояниями друг от друга. Объясняется это тем, что среди плоских сеток (111) каждая сетка ионов кальция переслоена двумя параллельными сетками одинаково заряженных ионов фтора, чем и обусловливается наименьшее сцепление именно между ними. Уд. вес 3,18 (у нечистых разностей колеблется в пределах 3–3,2). Прочие свойства. Часто проявляется флюоресценция (термин произошел именно от названия этого минерала). В катодных лучах флюорит светится обычно фиолетовым цветом со своеобразным синевато-зеленым оттенком. Свечение появляется также при нагревании (термолюминесценция).
Диагностические признаки. После некоторого навыка узнается довольно легко по формам кристаллов, октаэдрической спайности, слабому слегка тусклому стеклянному блеску и твердости.
П. п. тр. растрескивается, светится и с трудом оплавляется по краям (1270 °С). По выделении всего фтора образуется неплавкая известь CaO. Весьма слабо растворим в воде. Вполне разлагается лишь в крепкой H2SO4 с выделением HF. HNO3 и НСl действуют гораздо слабее.
Происхождение и месторождения. В главной своей массе образуется при гидротермальных процессах, часто являясь спутником рудных металлических минералов в жилах. Может встречаться в ассоциации с самыми разнообразными минералами гидротермального происхождения.
Он наблюдается также в некоторых породах осадочного происхождения, но не образует значительных скоплений с высоким содержанием F. Как трудно растворимое в воде соединение, CaF2 из соленосных растворов выпадает одним из первых, иногда в аморфном виде. Поэтому неудивительно, что редко встречающиеся скопления флюорита приурочены к ранним химическим осадкам, т. е. к отложениям гипса, ангидрита, кальцита, доломита. Изредка в виде новообразований он наблюдается в зоне окисления рудных месторождений, например в виде кристалликов на почковидном гётите.
Как спутник флюорит встречается в многочисленных месторождениях цветных и редких металлов. Из месторождений России, в которых флюорит играет главную роль, отметим Калангуй (Забайкалье) в виде мощной брекчиевой жилы в песчаниках и сланцах, сложенной концентрически-зональными и шестоватыми агрегатами флюорита разных оттенков (белого, желтого и красновато-желтого). Землистый флюорит осадочного происхождения (ратовкит) встречен в доломитизированных известняках по берегам речки Ратовки у г. Вереи (Московская область), на правом берегу р. Осуги (Тверская область) и в других местах. Оптический флюорит обнаружен в районе Амдермы (Ямало-Ненецкий округ).
В ближнем зарубежье отметим месторождение Керемет-Тас в Казахстане и месторождения оптического флюорита Куликолон и Могов в Таджикистане.
Практическое значение. В значительной своей части (около 70 %) флюорит используется в металлургии с целью получения более легкоплавких шлаков. В химической промышленности из флюорита получают ряд фтористых соединений, из которых плавиковая кислота (раствор HP в воде) употребляется для гравирования на стекле, получения перекиси водорода из перекиси натрия и т. п., а искусственно получаемый криолит (Na3[AlF6]) — для получения электролизом металлического алюминия из глинозема и для других целей. Применяется также в керамике для получения эмалей и глазури. Прозрачные бесцветные разности кристаллов используются в оптике для изготовления линз, устраняющих сферическую и хроматическую аберрации в объективах микроскопов.
КРИОЛИТ — Na3[AlF6]. От греч. криос — лед, литос — камень. Очевидно, назван по сходству со льдом, к которому по блеску и показателю преломления действительно очень близок.
Химический состав. Аl — 12,8 %, Na — 32,8 %, F — 54,4 %. Иногда в качестве примеси присутствует Fe.
Сингония моноклинная; призматический в. с. L2PC. Пр. гр. P2/m (C 22h). а0 = 5,39; b0 = 5,59; с0 = 7,76; β = 90°11′. Псевдокубический; при температуре около 500 °С становится кубическим. В структуре криолита октаэдрические группировки [AlF6]3+ расположены в вершинах и в центре элементарного параллелепипеда, тогда как катионы Na+, имеющие по F также координационное число 6, расположены в серединах вертикальных ребер и приблизительно вдоль средних линий вертикальных граней на высотах в одну и в три четверти периода повторяемости вдоль оси с. Структура близка к координационной. Облик кристаллов кубовидный (рис. 137) при развитии граней {001} и {010}. Двойники наиболее часты по (110). Обычно встречается в сплошных массах, состоящих из крупных неделимых.
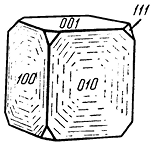
Рис. 137. Кристалл криолита
Цвет. Бесцветен, но чаще бывает окрашен в серовато-белый, желтоватый или красноватый, изредка черный цвет. Блеск стеклянный. Ng = 1,34.
Твердость 2–3. Хрупок. Спайность отсутствует, но нередко проявляется отдельность вдоль плоскостей срастания. Уд. вес 2,95–3,01. Прочие свойства. При умеренном нагревании наблюдается свечение желтым светом.
Диагностические признаки. Характерны формы кристаллов и слабый стеклянный блеск. Точное установление этого минерала возможно лишь с помощью паяльной трубки и путем измерения оптических констант.
П. п. тр. очень легко плавится, даже в пламени свечи, окрашивая его в красновато-желтый цвет и давая прозрачный королек, превращающийся при остывании в белую эмаль. В стеклянной трубке дает реакцию на фтор. После продолжительного прокаливания на угле остается корка глинозема, которая от раствора азотнокислого кобальта окрашивается в синий цвет. В крепкой H2SO4 растворяется совершенно.
Происхождение. Встречается в пегматитах, образуясь из остаточных растворов, обогащенных фтором. Крупное промышленное месторождение известно в Западной Гренландии — Ивигтут, среди гранита, превращенного в грейзен в виде большого штока, вертикально уходящего на глубину. Криолит здесь образует сплошные крупнокристаллические массы вместе с другими фторалюминатами, доломитом, редкими сульфидами, касситеритом и др. В Ильменских горах (Южный Урал) встречался в одной из топазовых копей в сопровождении хиолита (Na5[Al3F14]), амазонита и других минералов. В Забайкалье, среди других фторалюминатов, встречен в редкометалльных жилах месторождения Катугин. С кварцем, топазом, фенакитом и кварцем отмечен в грейзенах Вознесенского месторождения (Приморье).
Практическое значение. Криолит получается обычно искусственно и используется в металлургии алюминия для изготовления молочно-белого стекла, эмали для железных сосудов и других целей.
1 Шпатами в минералогии называют кристаллические вещества, не имеющие металлического блеска, но обладающие совершенной спайностью по двум или более направлениям.

