Основными эффекторными регуляторами водно-солевого обмена являются альдостерон, натрийуретические пептиды и вазопрессин. Ангиотензин II участвует в этом процессе как стимулятор продукции альдостерона.
Альдостерон
Стероидный гормон альдостерон, самый активный минералокортикоид, секретируемый клубочковой зоной коры надпочечников.
Регуляция продукции
Продукция альдостерона регулируется ангиотензином II в процессе работы ренин-ангиотензин-альдостероновой системы (РААС). Прямые и обратные связи, регулирующие продукцию альдостерона, сложнее, чем в других гормональных осях, т.к. реализуются через объем крови и концентрации Na+ и К+ (Рис. 66).
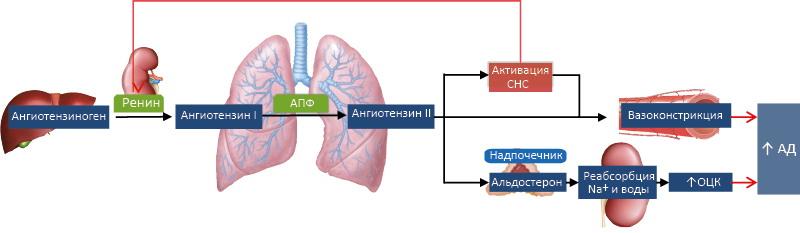
Рис. 66. Ренин-Ангиотензин-Альдостероновая система (упрощённо).
АПФ – ангиотензинпревращающий фермент, ОЦК – объем циркулирующей крови
РААС – физиологическая система, призванная поддерживать в организме оптимальное АД в покое и при кровопотере. Ключевой регулятор РААС – объём циркулирующей крови (ОЦК). Снижение ОЦК провоцирует увеличение секреции юкстагломерулярным аппаратом почки фермента ренина105. Попадая в кровь, ренин отщепляет от ангиотензиногена, секретируемого печенью, декапептид ангиотензин I. Под действием тканевого106 ангиотензинпревращающего фермента (АПФ) ангиотензин I превращается в октапептид ангиотензин II (ATII). ATII– физиологическое гипертензивное соединение, эффективно поднимающее АД благодаря вазоконстрикции и стимуляции синтеза альдостерона. Другой стимулятор секреции альдостерона – концентрация К+ в крови. Альдостерон регулирует свою продукцию по механизму отрицательной обратной связи, угнетая активность верхних звеньев РААС и снижая плазменную концентрацию К+. Он увеличивает задержку Na+, восстанавливая ОЦК, что, в свою очередь, угнетает продукцию ренина. Возросшая при гиперкалиемии продукция альдостерона ускоряет экскрецию К+. Затем, вслед за снижением концентрации К+ в плазме, падает и продукция альдостерона (Рис. 67). Секреция альдостерона также снижается под действием натрийуретических пептидов и дофамина.
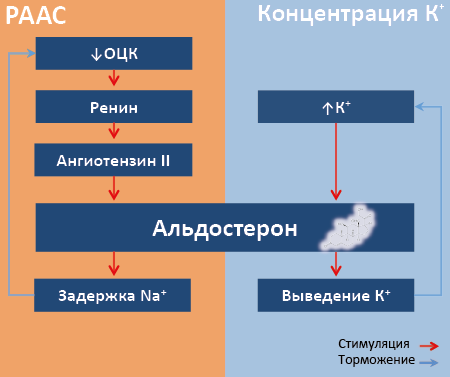
Рис. 67. Взаимосвязь активности РААС и концентраций ионов
Структура и механизм действия
Альдостерон – С21 стероид, относится к кортикостероидам, подгруппе минералокортикоидов.
Рецепторы
Рецепторы минералкортикоидов относятся к семейству ядерных рецепторов и имеют практически одинаковое сродство к альдостерону и кортизолу. Клетки, несущие эти рецепторы, расположены в собирательных трубочках107 коркового вещества почек, мозге и некоторых других орагнах. Избирательное действие альдостерона на почки достигается в результате инактивации кортизола под действием 11-бета-гидроксистероиддегидрогеназы 2 типа.
Антагонисты альдостерона – К+- сберегающие диуретики. Помимо антагонистов альдостерона (Спиронолактон, Эплеренон) к этому класcу относится диуретик Индапамид, блокирующий Na+-каналы и нарушающий реабсорбцию этого иона.
В настоящее время антагонисты РААС – наиболее применяемый класс антигипертензивных средств. Наиболее эффективны препараты, ослабляющие действие ангиотензина II, так как они не только снижают АД, но и предотвращают патологическую перестройку миокарда. Эффект антагонистов альдостерона не так выражен.
В клинической практике применяют:
• Ингибиторы ренина – Алискирен;
• Ингибиторы АПФ – напр. Эналаприл;
• Ингибиторы рецепторов AT1 – Валсартан;
• Антагонисты альдостерона – Эплеренон
Теоретически, наименьшим числом побочных эффектов должны были обладать ингибиторы ренина, благодаря полному отключению РААС (β1-адреноблокаторы также снижают выделение ренина). Однако на практике они уступали по эффективности ингибиторам АПФ, поэтому сейчас применяются только в комбинациях с другими антигипертензивными средствами.
Так как АПФ также инактивирует медиатор воспаления и вазодилататор брадикинин, на фоне применения ингибиторов АПФ может возникать сухой кашель. При появлении кашля вместо них назначают блокаторы рецепторов AT1, не обладающие таким побочным действием. Антагонисты альдостерона могут быть назначены при незначительном увеличении АД, или при снижении эффективности указанных выше средств (из-за «ускальзания альдостерона» – его синтеза альтернативными путями).
Функции
В почках альдостерон усиливает реабсорбцию Na+ в собирательных трубочках и в дистальных извитых канальцах (частично), усиливает выведение H+ и К+.
На системном уровне альдостерон вызывает:
- Задержку Na+ и Cl-.
- Задержку воды.
- Выведение H+ и К+ почками.
- Увеличение ОЦК и АД.
- Поддержание водно-электролитного баланса.
Альдостерон влияет на ОЦК и АД через реабсорбцию Na+ и Cl-. Чем она больше – тем меньше жидкости выделяется с мочой, и тем больше объём циркулирующей крови и артериальное давление. Клеточный механизм задержки Na+ и выведения К+ под действием альдостерона заключается в стимуляции экспрессии:
- Na+/K+-АТФазы.
- Эпителиальных натриевых каналов (ЕNaC108).
- Калиевых каналов наружного медуллярного слоя (ROMK).
Благодаря этому происходят экскреция К+ и реабсорбция Na+, поддерживается водно-электролитный баланс. Альдостерон действует на транспорт К+ ещё и опосредованно, влияя на встраивание калиевых каналов в апикальную109 мембрану клеток.
Ангиотензин II
Ангиотензин II – октапетид, связывается со специфическими рецепторами, сопряженными с Gq-белками. Передача сигнала осуществляется через IP3-путь и последующее увеличение внутриклеточной концентрации Ca2+. Существует два типа рецепторов ангиотензина II:
- АТ1– рецепторы вызывают:
– Вазоконстрикцию.
– Синтез альдостерона.
– Синтез АДГ.
– Ремоделирование миокарда.
- АТ2 – рецепторы вызывают:
– Вазодилатацию.
– Угнетение пролиферации.
– Синтез вазодилататоров эндотелием (NO и PGI2).
Основная точка воздействия ангиотензина II на продукцию альдостерона – начальный этап его биосинтеза, превращение холестерина в прегненолон. В коре надпочечников ангиотензин II стимулирует пролиферацию клубочковой зоны и ее васкуляризацию.Помимо этого, ангиотензин II – вазоконстриктор и стимулятор секреции вазопрессина (видимо, за счет этого усиливает потребление воды). Продукция ангиотензина II снижается под действием вазопрессина и натрийуретических пептидов.
Натрийуретические пептиды применяются при диагностике сердечной недостаточности. С этой целью измеряют концентрацию BNP в крови, так как его секреция желудочками прямо пропорциональна степени дисфункции сердца. Обычно измеряют концентрацию N-терминального фрагмента про-BNP (NTproBNP) т.к. он дольше живет в кровотоке. С диагностическими целями не используют ANP, так как его секреция увеличивается только на ранних этапах недостаточности, затем нормализуясь из-за истощения синтетической способности предсердий и их дилатации.
Натрийуретические пептиды обладают гипотензивным эффектом, однако при гипертонической болезни их секреция может снижаться. Для увеличения активности эндогенных пептидов используют блокатор разрушающего их фермента – Омапатрилат.
Натрийуретические пептиды
В семейство натрийуретических пептидов входят предсердный натрийуретический пептид (ANP110), мозговой натрийуретический пептид (BNP111) и натрийуретический пептид типа C (CNP). ANP продуцируется преимущественно кардиомиоцитами предсердий в ответ на растяжение правого предсердия. Высвобождение BNP кардиомиоцитами происходит в ответ на постнагрузку (степень напряжения миокарда в систолу). CNP продуцируется эндотелиальными клетками и мозгом. Основной натрийуретический пептид в системном кровотоке – ANP.
Регуляция продукции
Продукция ANP и BNP кардиомиоцитами усиливается не только в результате растяжения предсердия, но и под действием простагландинов, глюкокортикоидов, тиреоидных гормонов. Ангиотензин II и вазопрессин также увеличивают продукцию натрийуретических пептидов, уменьшая реабсорбцию воды и Na+ в противовес действию альдостерона.
Структура и механизм действия
Все натрийуретические пептиды – небольшие пептиды, содержащие N-концевой и C-концевой фрагменты, соединённые внутренней аминокислотной петлёй. Петля образована дисульфидной связью и необходима для проявления биологической активности.
Рецепторы
Натрийуретические пептиды передают сигнал через рецепторные гуанилатциклазы, преимущественно экпрессируемые почками и кровеносными сосудами. При связывании гормона с рецептором меняется конформация последнего. Это активирует гуанилатциклазную активность внутриклеточного домена рецептора, увеличивая продукцию цГМФ, который активирует цГМФ-зависимые протеинкиназы, фосфодиэстеразы и ионные каналы. Известно три типа рецепторов натрийуретических пептидов:
- NPR-A и NPR-B, обладают гуанилатциклазной активностью.
- NPR-C (клиренс-рецептор) без гуанилатциклазной активност.и
Основная функция клиренс-рецептора – связывание гормона и его удаление из кровотока.
Функции
Натрийуретические пептиды в почках:
- Подавляют продукцию ренина (следовательно, активность РААС).
- Уменьшают реабсорбцию Na+ в дистальных канальцах.
- Увеличивают выведение воды.
- Увеличивают скорость клубочковой фильтрации (СКФ).
- Системно:
– Снижают АД (вазодилятация + уменьшение ОЦК).
– Снижают активность симпатической НС.
- Замедляют почечный кровоток.
- Снижают продукцию вазопрессина.
Увеличение СКФ под действием натрийуретических пептидов обусловлено расширением приносящих и сужением выносящих артериол, что повышает фильтрационное давление в клубочке. Рост СКФ, в свою очередь, принимает участие в снижении ОЦК и АД (увеличенная экскреция Na+ и воды) и замедлении почечного кровотока (спазм выносящей артериолы). Уменьшение АД под действием натрийуретических пептидов происходит также за счет системной вазодилятации112 и торможению пролиферации гладкомышечных и эндотелиальных клеток сосудов.
Натрийуретические пептиды ускоряют выведение Na+ и воды почками не только за счет снижения активности Na+/K+-АТФазы и других транспортеров Na+, но и благодаря подавлению работы РААС в результате торможения образования ренина, ангиотензина II и альдостерона. Помимо этого, натрийуретические пептиды снижают чувствительность клубочковой зоны коры надпочечников к ангиотензину II, дополнительно ослабляя его влияние на синтез альдостерона. ANP и BNP также действуют паракринно, предотвращая гипертрофию и фиброз сердца. Снижение продукции вазопрессина и, следственно, потребление воды, определяется преимущественно CNP.
Вазопрессин (антидиуретический гормон/АДГ)
Вазопрессин продуцируется крупноклеточными нейронами супраоптического и паравентрикулярного ядер гипоталамуса, транспортируется с помощью нейрофизина-2 вдоль аксонов в нейрогипофиз. В нейрогипофизе он накапливается и оттуда поступает в системный кровоток.
Регуляция продукции
Секреция вазопрессина регулируется осмо- и барорецепторами, реагирующими на изменение ОЦК. Они стимулируют его секрецию при гиповолемии и гипотонии, а в противоположных ситуациях – снижают.Концентрация АДГ в крови повышается в экстремальных состояниях (кровопотеря, шок, стресс, травма и др.). Основные гормональные стимуляторы продукции вазопрессина – ангиотензин II и половые стероиды, а ингибиторы – натрийуретические пептиды и кортизол.
Структура и механизм действия
Вазопрессин представляет собой пептид из 9 аминокислот, структурно схожий с окситоцином, но отличающийся аминокислотами в 3 и 8 положениях.
Рецепторы вазопрессина – мембранные рецепторы, сопряжённые с G-белками. Разнообразные биологические эффекты вазопрессина опосредованы различными типами рецепторов: V1 (вазоконстрикция), V2 (антидиуретическое действие), V3 (секреция АКТГ гипофизом).
Функции
- Стимуляция реабсорбции воды:
– Активация синтезированных аквапоринов.
– Повышение экспрессии гена AQP2.
- Увеличение АД (вазоконстрикция + реабсорбция воды).
- Стимуляция секреции АКТГ аденогипофизом.
- Социальное поведение (слабее, чем окситоцин).
Вазопрессин благодаря своему антидиуретическому действию поддерживает гомеостаз воды в организме, стимулируя её реабсорбцию в собирательных трубочках почек. Это вызывает увеличение ОЦК, разведение плазмы крови (приводящее к гипонатриемии и снижению осмолярности), концентрирование мочи и уменьшение ее объема. Стимуляция реабсорбции воды в собирательных трубках возникает в результате действия АДГ через V2-рецептор на фосфорилирование аквапорина 2 (AQP2). Это служит сигналом для перемещения везикул с AQP2 к апикальной мембране клеток, где они формируют поры, проницаемые для воды.По мере восстановления изотоничности крови концентрация АДГ снижается, что служит сигналом к эндоцитозу AQP2. Однако в собирательных трубочках вазопрессин не только активирует уже действующие аквапорины, но и стимулирует синтез новых. Это происходит за счет АДГ-зависимого фосфорилирования транскрипционного фактора CREB, имеющего представительство в промоторе AQP2.
Помимо этого, вазопрессин способен: увеличивать АД, являясь мощным вазоконстриктором (через V1-рецептор) большинства регионарных артерий, артериол и микроциркуляторного русла; в аденогипофизе (через V3-рецепторы) – стимулировать секрецию АКТГ; регулировать некоторые формы социального поведения, связанные с выхаживанием потомства (хотя и слабее окситоцина).
Дисфункция системы АДГ вызывает развитие несахарного диабета. Выделяют два типа несахарного диабета:
• Нейрогенный — нарушение секреции АДГ нейрогипофизом
• Нефрогенный — дисфункция V2-рецепторов.
Нейрогенный тип хорошо поддаётся заместительной терапии препаратами вазопрессина. Для уменьшения диуреза у пациентов с нефрогенным типом диабета используют тиазидные диуретики (ЛС Гидрохлортиазид и Хлорталидон), изменяющие ионный состав первичной мочи и, таким оразом, увеличивающие реабсорбцию жидкости.
Рекомендуемая литература
1. Ball S.G. // Vasopressin and disorders of water balance: the physiology and pathophysiology of vasopressin.– Ann Clin Biochem.– 2007.– 44 (Pt 5):417-31.
2. Clerico A., Emdin M. (auth.), Clerico A., Michele Emdin M. (eds.) // Natriuretic Peptides: The Hormones of the Heart / -2006.– Springer-Verlag Mailand.– P. 184.– ISBN: 978-88-470-0497-9, 978-88-470-0498-6
3. Frohlich E.D. (auth.), Frohlich E.D., Re R.N. (eds.) // The Local Cardiac Renin-Angiotensin Aldosterone System. – 2009. – Springer US. – P. 184. – ISBN: 978-1-4419-0527-7, 978-1-4419-0528-4
4. Inga D. Neumann I.D., and Landgraf R. (Eds.) // Advances in Vasopressin and Oxytocin — From Genes to Behaviour to Disease. – 2008 Elsevier Science. – P. 608. – ISBN: 9780080932477, 9780444532015, 0444532013
5. Kalra A., Maharaj V., Goldsmith S.R.//Vasopressin receptor antagonists: from pivotal trials to current practice. – Curr Heart Fail Rep. – 2014. – 11 (1):10-8.
6. Kortenoeven M.L., Pedersen N.B., Rosenbaek L.L., Fenton R.A.//Vasopressin regulation of sodium transport in the distal nephron and collecting duct. – Am J Physiol Renal Physiol. – 2015. – 309 (4):F280-99.
7. Luther J.M. // Aldosterone in vascular and metabolic dysfunction. – Curr Opin Nephrol Hypertens. – 2016. – 25 (1):16-21.
8. Manea M.M., Comsa M., Minca A., Dragos D., Popa C. // Brain-heart axis. – J Med Life. – 2015. – 8 (3):266-71.
9. Mulatero P., Williams T.A., Monticone S., Viola A., Tizzani D. (auth.), Koch C.A., Chrousos G.P. (eds.) // Endocrine Hypertension: Underlying Mechanisms and Therapy / 2013.– Humana Press.– P. 318. – ISBN: 978-1-60761-547-7, 978-1-60761-548-4
10. Pandey K.N. // Endocytosis and Trafficking of Natriuretic Peptide Receptor-A: Potential Role of Short Sequence Motifs.– Membranes (Basel).– 2015.– 5 (3):253-87.
11. Theilig F., Wu Q. // ANP-induced signaling cascade and its implications in renal pathophysiology.– Am J Physiol Renal Physiol. – 2015. – 308 (10):F1047-55.
12. Volpe M., Carnovali M., Mastromarino V. // The natriuretic peptides system in the pathophysiology of heart failure: from molecular basis to treatment. – Clin Sci (Lond). – 2016.– 130 (2):57-77.
13. Whaley-Connell A., Johnson M.S., Sowers J.R. // Aldosterone: role in the cardiometabolic syndrome and resistant hypertension. – Prog Cardiovasc Dis. – 2010. – 52 (5):401-9.
105 Секреция ренина также стимулируется адреналином через β1-адренорецепторы.
106 Преимущественно в лёгких.
107 Место реабсорбции Na+ и воды.
108 Эпителиальные Na+-каналы.
109 Обращённая в сторону просвета собирательной трубочки.
110 Atrial Na-uretic Peptide.
111 Brain Na-uretic Peptide.
112 ANP способен сужать сосуды (напр., выносящие артериолы почечных клубочков).

