Регуляция секреции гормонов гонадотропной оси
Гормоны гонадотропной оси включают гонадолиберин (Гн-РГ) гипоталамуса, усиливающий продукцию гонадотропинов гипофиза. Гонадотропины включают лютеинизирующий гормон (ЛГ) гипофиза, стимулирующий продукцию андрогенов клетками теки фолликулов яичника и клетками Лейдига66 семенников, а также продукцию прогестерона желтым телом яичника; фолликулостимулирующий гормон (ФСГ) гипофиза, стимулирующий продукцию эстрогенов клетками гранулезы фолликулов яичника и клетками Сертоли67 семенников. Андрогены, эстрогены и прогестины гонад действуют на гипоталамо-гипофизарное представительство своей оси по механизму отрицательной обратной связи, тормозя продукцию гонадолиберина и гонадотропинов (рис.38). Исключением является период овуляции, когда между эстрогенами яичника и ЛГ гипофиза временно возникает положительная обратная связь. К гормонам репродуктивной оси относят также активин и ингибин, продуцируемые клетками гранулезы, желтого тела яичника и клетками Сертоли семенников. Ингибин тормозит, а активин стимулирует продукцию ФСГ гипофизом. Особое положение занимает пролактин аденогипофиза, снижающий продукцию эстрогенов и андрогенов гонадами и стимулирующий продукцию прогестерона желтым телом. Эстрогены и андрогены (возможно, после превращения в эстрогены) по механизму обратной связи являются стимуляторами продукции пролактина.
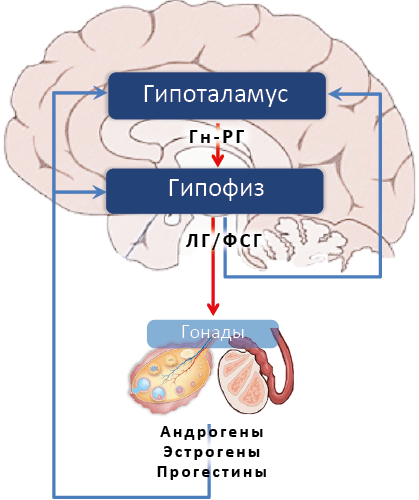
Рис. 38. Гипоталамо-гипофизарно-гонадная ось (упрощённо)
Структура гормонов гонадотропной оси
Эффекторные гормоны гонадотропной оси – половые стероиды гонад, производные холестерина. Последовательные стадии их биосинтеза включают:
- первоначальное образование прогестерона (21 С68);
- синтез андрогенов из прогестерона (19 С);
- синтез эстрогенов из андрогенов под действием фермента ароматазы (18 С, ароматическое кольцо А).
Наиболее активный гестаген (прогестин) – прогестерон. Активные андрогены – тестостерон и его тканевой метаболит69 5-α-дигидротестостерон (5α-DHT). Самый активный эстроген – эстрадиол, эстрон и эстриол менее активны.
ЛГ и ФСГ относятся к гликопротеидным гормонам семейства ФСГ. В состав семейства входят ЛГ, ФСГ, ХГч70 и ТТГ. Гормоны этой группы состоят из двух цепей:
- α-цепи, общей для всех представителей семейства
- β-цепи, специфичной для ЛГ, ФСГ и др. представителей семейства
Механизм действия
Пептидные гормоны оси действуют через рецепторы, сопряженные с G-белками.
Лютеинизирующий гормон
- Стимулирует стероидогенез в:
– клетках фолликулов;
– желтом теле;
– клетках Лейдига.
- Стимулирует овуляцию и образование желтого тела.
Фолликулостимулирующий гормон
- Стимулирует рост фолликулов яичника.
- Сенсибилизирует клетки фолликулов к действию ЛГ.
- Стимулирует синтез эстрогенов
– гранулезой71.
– клетками Сертоли.
- Усиливает секреторную активность клеток Сертоли:
– способствует повышению жизнеспособности сперматозоидов;
– поддерживается гемато-тестикулярный барьер (влияя на образование плотных контактов между клетками Сертоли).
Гонадолиберин – пептидный рилизинг-гормон гипоталамуса:
- стимулирует продукцию ЛГ и ФСГ;
- регулирует половое поведение (как нейропептид).
Ингибин – двухцепочечный гормон, построенный из одной α-цепи и одной β-цепи различных типов (βА для ингибина А, βВ для ингибина В). Активин состоит из двух β-цепей ингибина. В зависимости от типа β-цепи различают активин А, В или АВ. Ингибин и активин обладают противоположными функциями в регуляции секреции ФСГ, чувствительности клеток к ЛГ, активности ароматазы и, следовательно, биосинтеза эстрогенов (рис. 39).
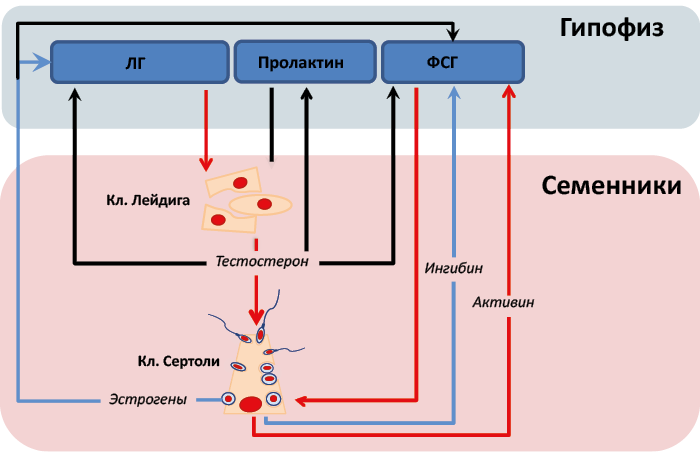
Рис. 39. Эффекты активина и ингибина на семенники, опосредованные гонадотропинами гипофиза
Активин – снижает андрогенную функцию:
- Увеличение секреции ФСГ.
- Увеличение ароматизации андрогенов в клетках гранулезы и Сертоли.
- Снижение проведения сигнала ЛГ.
- Ингибин – усиливает андрогенную функцию:
- Снижение секреции ФСГ.
- Снижение ароматизации андрогенов в клетках гранулезы и Сертоли.
- Усиление проведения сигнала ЛГ.
Пролактин представляет собой белковый гормон, относящийся к гормонам семейства СТГ.
Транспортные белки
Андрогены и эстрогены в кровотоке связываются с продуцируемым печенью сексстероидсвязывающим глобулином. В семенниках андрогены связываются андрогенсвязывающим белком (АСБ) – местно продуцируемым гомологом сексстероидсвязывающего глобулина в этих железах. Транскортин крови примерно с равным сродством связывает глюкокортикоиды и прогестерон. В тканях, секретирующих активин, присутствует белок фоллистатин, связывающий данный гормон. В крови связывающим белком для пролактина является внеклеточный домен его рецептора.
Рецепция
Все половые стероиды действуют через ядерные рецепторы,работающие как транскрипционные факторы, изменяя скорость транскрипции генов-мишеней.
ЛГ, ФСГ и гонадотропин-рилизинг гормон передают сигналы через соответствующие рецепторы, сопряженные с G-белками.
Активин и ингибин действуют через рецепторные серинтреонинкиназы, фосфорилирующие транскрипционные факторы группы Smad.
Пролактин взаимодействует со своим рецептором, относящимся к надсемейству рецепторов, сопряженных с тирозинкиназами класса Янус, иногда называемых рецепторами цитокинов.
Метаболизм
Для тестостерона характерен активирующий метаболизм в тканях-мишенях, приводящий к образованию 5-α-дигидротестостерона (5αDHT). У этого метаболита преобладают андрогенные и ослаблены анаболические свойства72. Кроме того, в ряде тканей, обладающих ароматазной активностью (мозге, жировой ткани и некоторых других), для тестостерона характерен метаболизм с превращением в эстрадиол и изменением типа биологической активности. Метаболизм эстрогенов и прогестерона ведет к снижению их биологической активности и полной инактивации. Белково-пептидные гормоны гонадотропной оси разрушаются протеазами.
Функции половых стероидов
Половая дифференцировка
В становлении пола млекопитающих можно выделить четыре этапа:
- хромосомный пол (XX – женский / XY – мужской);
- гонадный пол (формирование яичников или семенников);
- соматический пол (формирование вторичных73 половых признаков);
- социальный пол (формирование полового поведения).
Первые два этапа являются гормоннезависимыми, последующие зависят от половых гормонов только у мужских особей, а у женских формируются без участия гормонов (по умолчанию) (рис. 40 и 41). Присутствие Y-хромосомы определяет дифференцировку эмбриональных бипотенциальных прегонад в семенники, в отсутствие Y-хромосомы прегонады развиваются в яичники.
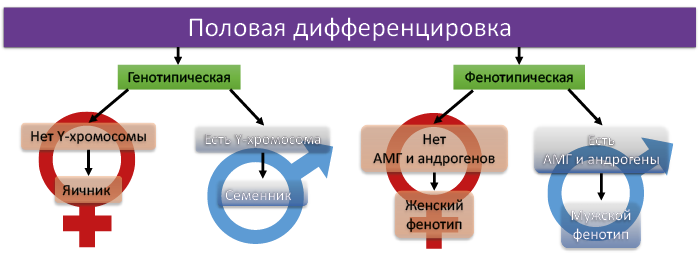
Рис. 40. Основы образования пола гонад (первичного пола) и соматического пола
(вторичного пола) млекопитающих. (АМГ- антимюллеров гормон)
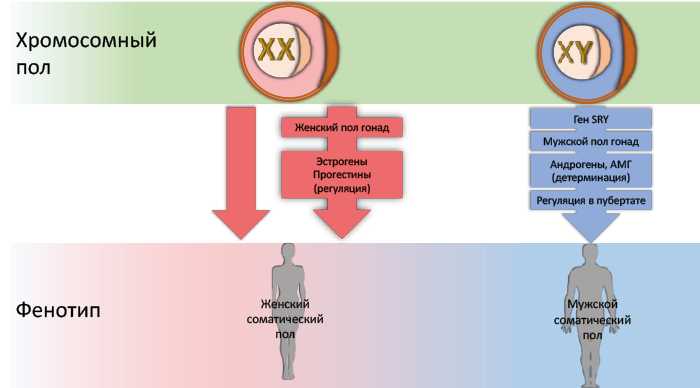
Рис. 41. Влияние хромосомного пола на фенотип
Гормоны семенников определяют мужской фенотипический пол организма, включающий дифференцировку по мужскому типу производных вольфовых каналов (придатков семенников, семенных пузырьков, семявыносящих протоков), внешних половых органов, мозга и социального пола. Женский фенотипический пол развивается независимо от половых гормонов и впоследствии женские репродуктивные органы находятся только под влиянием регуляторного действия половых гормонов (рис. 41).
Продукция тестостерона у плодов мужского пола в эмбриогенезе достигает уровня, характерного для взрослой мужской особи, у плодов женского пола продукция половых гормонов в эмбриогенезе низка (рис. 42). В организме млекопитающих существует базисная (нейтральная) программа половой дифференцировки. В отсутствие половых гормонов гонад (по умолчанию) эмбрион с любым набором половых хромосом (и XX, и XY) развивается в фенотипически женский организм, т.е. в отсутствие антимюллерова гормона (АМГ) и тестостерона:
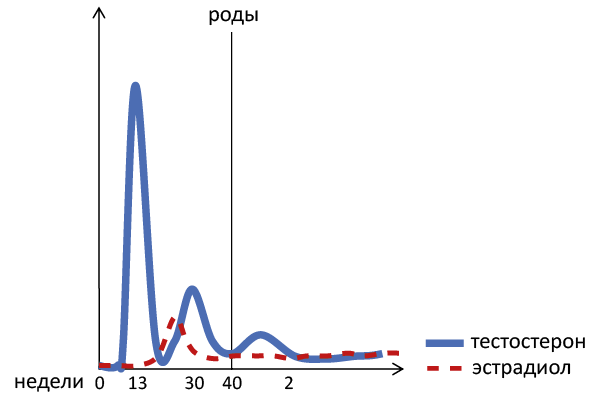
Рис. 42. Продукция тестостерона плодом мужского пола ипродукция эстрадиола плодом женского пола
- мюллеровы протоки развиваются и дают начало:
– матке;
– маточным трубам;
– верхней части влагалища;
- вольфовы протоки подвергаются дегенерации.
При развитии семенников под влиянием гена SRY Y-хромосомы клетки прегонад дифференцируются в клетки Сертоли. Клетки Сертоли начинают секретировать АМГ, который способствует дегенерации мюллеровых протоков, направляет дифференцировку половых клеток в сторону сперматогониев, а также стимулирует дифференцировку клеток Лейдига и окончательное фомирование семенников (рис. 43).
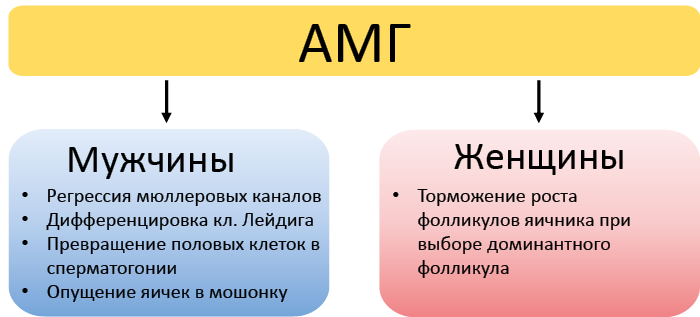
Рис. 43. Эффекты АМГ
Дифференцировке клеток Лейдига способствует также хорионический гонадотропин. Клетки Лейдига семенников начинают продуцировать тестостерон. Тестостерон и его метаболиты определяют дальнейшую дифференцировку по мужскому типу внешних и внутренних репродуктивных органов, а также других тканей организма.
В зачатках наружных половых органов под действием 5α-редуктазы тестостерон превращается в 5α-DHT, индуцирующий дифференцировку наружных половых органов по мужскому типу. Программирование функционирования структур мозга по мужскому типу (центров, регулирующих половое поведение, агрессивное поведение, центров, регулирующих секрецию гонадотропинов), происходит после превращения тестостерона в структурах мозга в эстрадиол (рис. 44).
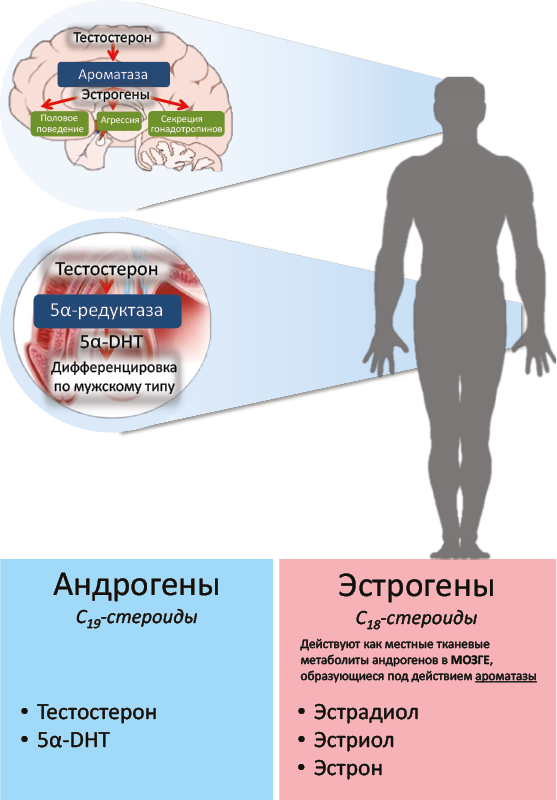
Рис. 44. Роль андрогенов и эстрогенов в мужской дифференцировке
Функции андрогенов
- Программирование дифференцировки тканей по мужскому типу:
– Тестостерон и 5αDHT – дифференцировка по мужскому типу внутренних половых органов (простата, семенные пузырьки и др.).
– 5αDHT – дифференцировка по мужскому типу внешних половых органов (мошонка, пенис).
– Тестостерон и его метаболит эстрадиол – дифференцировка структур мозга по мужскому типу.
- Стимуляция и поддержание активности мужского полового аппарата.
- Анаболизм в мышцах и других тканях. (кроме тимуса).
- Катаболизм в тимусе.
- Стимуляция акселерации и терминации роста.
- Усиление агрессии и мужского типа полового поведения.
- Подавление секреции ЛГ, ФСГ, Гн-РГ (отрицательная обратная связь).
Половое развитие
У человека и высших приматов выделяют две фазы полового созревания: адренархе и гонадархе (рис. 45).
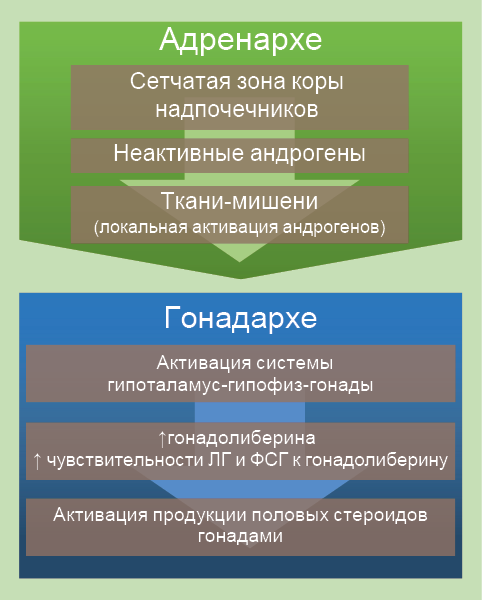
Рис. 45. Фазы полового созревания
Адренархе – это период онтогенеза, связанный с препубертатным ростом секреции андрогенов (дегидроэпиандростендиона74 и его сульфата75, андростендиона) сетчатой зоной коры надпочечников (рис. 46).
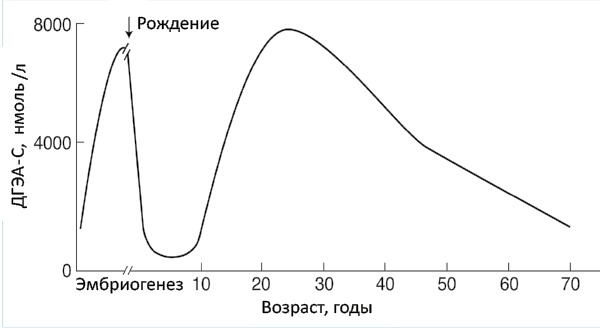
Рис. 46. Динамика продукции дегидроэпиандростерона-сульфата корой надпочечников в развитии человека
У человека рост продукции надпочечниковых андрогенов начинается в 7–8 лет и предшествует началу повышения гормонпродуцирующей активности гонад. Гонадархе возникает в результате активации системы гипоталамус-гипофиз-гонады и характеризуется ростом секреции гипоталамического гонадолиберина и чувствительности к нему гонадотропинов (ЛГ и ФСГ) с последующей активацией продукции половых стероидов гонадами. Первые фенотипические признаки полового созревания возникают в результате действия надпочечниковых андрогенов, последующие – в результате действия половых гормонов гонад. В частности, это касается развития андрогензависимых зон оволосения тела (рис. 47).
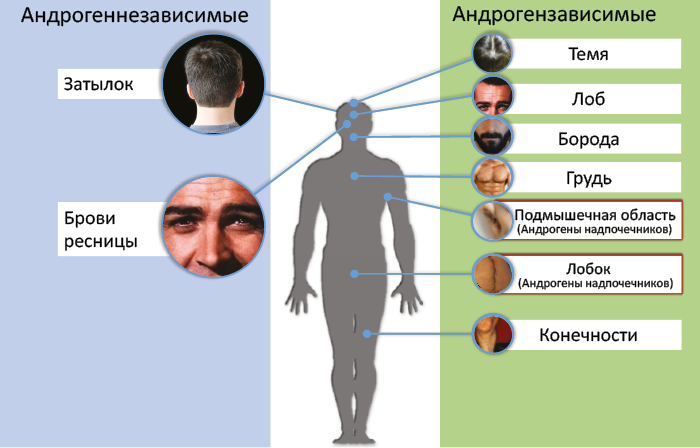
Рис. 47. Зоны оволосения
Начало полового созревания зависит еще от двух гормонов. Продуцируемый эпифизом мелатонин препятствует началу полового созревания в результате своего антигонадотропного действия. К началу полового созревания происходит дегенерация эпифиза, снижение продукции мелатонина и ослабление его антигонадотропных эффектов. К функциям мелатонина относят:
- Антигонадотропное действие.
– Регуляция циркадных ритмов.
– Регуляция диурнальной76 и сезонной активности репродуктивной системы.
- Торможение начала полового созревания.
- Антипролиферативное действие.
- Иммуномодуляторное действие.
- Седативное действие.
- Антиоксидантное действие (в больших концентрациях.)
- Регуляция окраски покровов в соответствии с освещенностью77.
Гормон жировой ткани лептин участвует в инициации полового созревания. Считается, что лептин, действуя на уровне ЦНС, стимулирует секрецию гонадолиберина и таким образом активирует работу гонадотропной оси. Недостаточное развитие жировой ткани в препубертатный период ведет к недостаточности секреции лептина и к задержке начала полового созревания.
Гормональная регуляция размножения
У человека репродуктивный период и его гормональная регуляция отличаются от других млекопитающих рядом важных характеристик.
- Низкая плодовитость из-за длительной жизни особей.
- Моноовуляторный цикл.
- Отсутствие сезонности78.
- Редукция природных противозачаточных средств:
– Сезонности.
– Регулярной беременности.
– Лактации.
- Отсутствие изменений фенотипа и полового поведения в момент овуляции79
- Возможность дополнительного спаривания после овуляции80.
Гормональная регуляция размножения у мужских особей
У мужских особей млекопитающих скорость сперматогенеза детерминирована генетически и не подвержена существенным колебаниям. Гормональная регуляция сперматогенеза призвана поддерживать количественный и качественный состав сперматозоидов и семенной жидкости (рис. 48).

Рис. 48. Объекты гормональной регуляции репродуктивной функции у мужчин
Кроме того, под контролем половых гормонов находится функционирование других тканей, включая отделы мозга, регулирующие половое поведение и агрессивность. Гормональная регуляция размножения у мужских особей осуществляется тонически: гонадолиберин, секретируемый тоническим центром регуляции секреции гонадотопинов гипоталамуса, стимулирует секрецию ЛГ и ФСГ гипофизом, которые стимулируют продукцию половых стероидов в семенниках. Циклический центр гипоталамуса у мужских особей не работает за счет негативного программирующего действия андрогенов в эмбриогенезе.
В регуляции этих процессов участвуют два типа клеток семенников – клетки Лейдига и клетки Сертоли. Клетки Лейдига продуцируют тестостерон и их стероидогенная активность находится под стимулирующим контролем ЛГ. Тестостерон через системный кровоток поддерживает активность мужского репродуктивного аппарата и участвует в механизмах отрицательной обратной связи гонадотропной оси, а действуя местно, поддерживает активность клеток Сертоли и является субстратом для продукции эстрогенов в данных клетках (рис. 49). Кроме того, в органах-мишенях тестостерон может превращаться в 5α-DHT, обладающий более выраженными андрогенными свойствами. В регуляции продукции андрогенов клетками Лейдига участвует еще ряд гормонов: пролактин и активин ее снижают, а ингибин повышает.
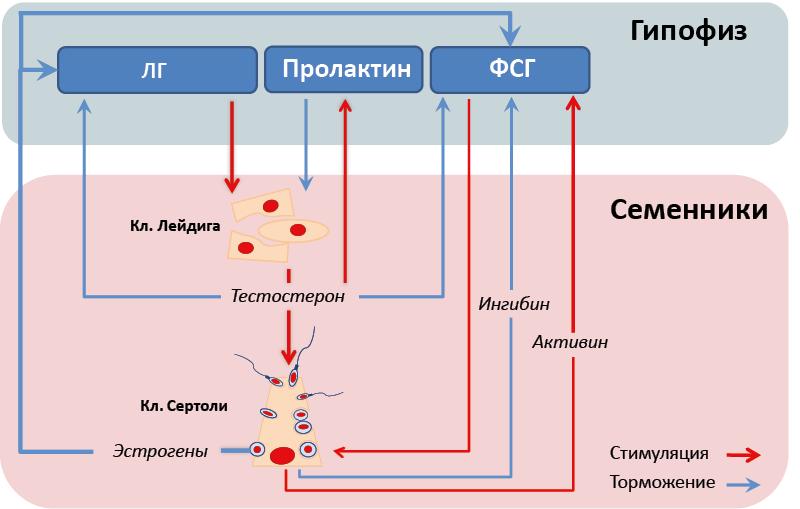
Рис. 49. Мужская гипофизарно-гонадная ось
В клетках Сертоли продуцируются эстрогены (из андрогенов, продуцируемых клетками Лейдига) (рис. 49). Клетки Сертоли продуцируют также ингибин, активин, ИФР-1 и АМГ (продукция которого особенно высока в эмбриогенезе). В клетках Сертоли ФСГ не только стимулирует продукцию эстрогенов и ингибина, но также отвечает за формирование и поддержание гемато-тестикулярного барьера, контролирует состав среды, поддерживающей дифференцировку сперматозоидов, и способствует прохождению стадий их дифференцировки, а также снижает количество резидуальных телец и способствует их фагоцитозу (рис. 50).
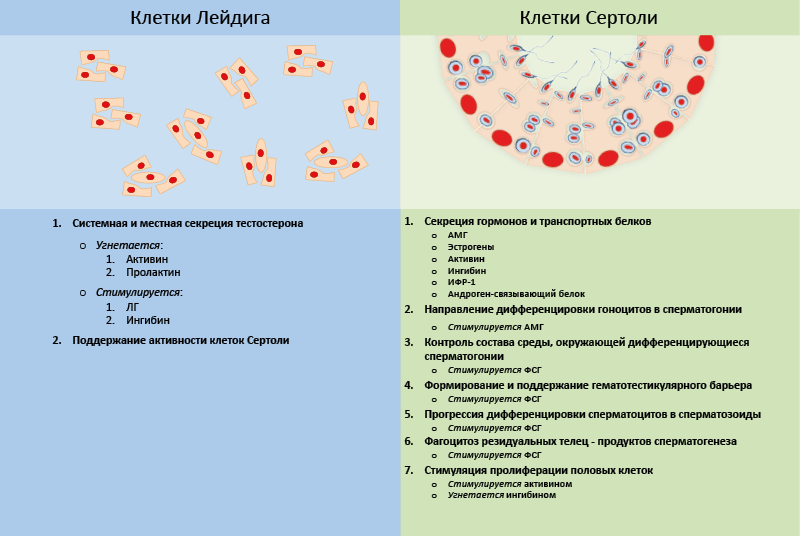
Рис. 50. Функции гормонпродуцирующих клеток семенников, гормональная регуляция активности мужских половых клеток
Гормональная регуляция размножения у женских особей
В отличие от мужских особей млекопитающих у женских особей деятельность репродуктивных органов изменяется циклически. Биологическое предназначение первой фазы цикла связано с подготовкой женского организма к спариванию и оплодотворению, во второй фазе каждого репродуктивного цикла происходит подготовка органов и тканей к беременности. Возможность такой циклической работы обусловлена гормонпродуцирующими тканями – регуляторами циклов. С одной стороны, это согласованная работа циклического и тонического центров гипоталамуса самок, приводящая к предовуляторному выбросу гонадолиберина, который в свою очередь вызывает предовуляторный пик секреции ЛГ аденогипофизом. С другой стороны, цикличность поддерживается наличием и согласованной работой двух гормонпродуцирующих структур яичников – фолликулов (в первую, фолликулярную фазу цикла) и желтого тела (во вторую, лютеиновую фазу цикла), продуцирующих эстрогены и прогестины, соответственно. Все ткани женских особей чувствительны к циклическим изменениям секреции половых гормонов, но наиболее сильно на половые гормоны реагируют женские репродуктивные органы (матка, яйцеводы, влагалище, молочные железы (рис. 51).

Рис. 51. Объекты циклической регуляции в женском организме
В фолликулярную фазу цикла несколько фолликулов входят в гормонзависимую стадию развития, превращаясь в антральные (полостные). Клетки гранулезы этих фолликулов прогрессивно увеличивают продукцию эстрогенов из андрогенов клеток теки (в начале фолликулярной фазы под действием ФСГ, а в конце под действием и ФСГ, и ЛГ). Из этих фолликулов у человека выбирается один доминатный фолликул (рис. 52). Отбор осуществляется по способности продуцировать максимальное количество ИФР-1 и минимальное – антимюллерова гормона.
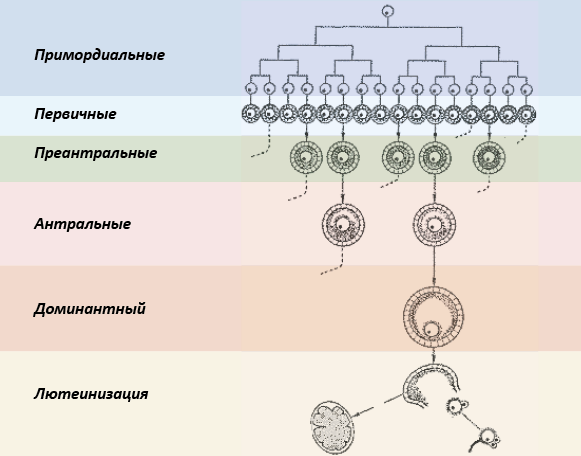
Рис. 52. Отбор доминантного фолликула
Эстрогены, продукция которых растет в фолликулярную фазу цикла, действуя местно, стимулируют рост фолликулов яичника, повышают уровень рецепторов ЛГ в клетках гранулезы. При системном действии эстрогены в начальный период фолликулярной фазы действуют на гипоталамо-гипофизарную систему по механизму отрицательной обратной связи через тонический центр гипоталамуса. Перед овуляцией эстрогены подключают к работе циклический центр гипоталамуса, что ведет к росту секреции гонадолиберина и индукции предовуляторного выброса ЛГ, т.е. временно замыкается положительная обратная связь между эстрогенами и ЛГ (рис. 53). ЛГ стимулирует процесс овуляции (разрыв фолликула и выход яйцеклетки в полость тела).

Рис. 53. Механизм возникновения предовуляторного пика ЛГ. ER – рецептор эстрогенов
Высокий уровень эстрогенов в крови в фолликулярную фазу цикла стимулирует пролиферацию эндометрия матки81 (пролиферативная фаза маточного цикла) и повышает ее чувствительность к прогестерону, усиливает развитие и ветвление протоков молочной железы, стимулирует активность яйцеводов, вызывает пролиферацию и ороговение клеток влагалища (рис. 54).
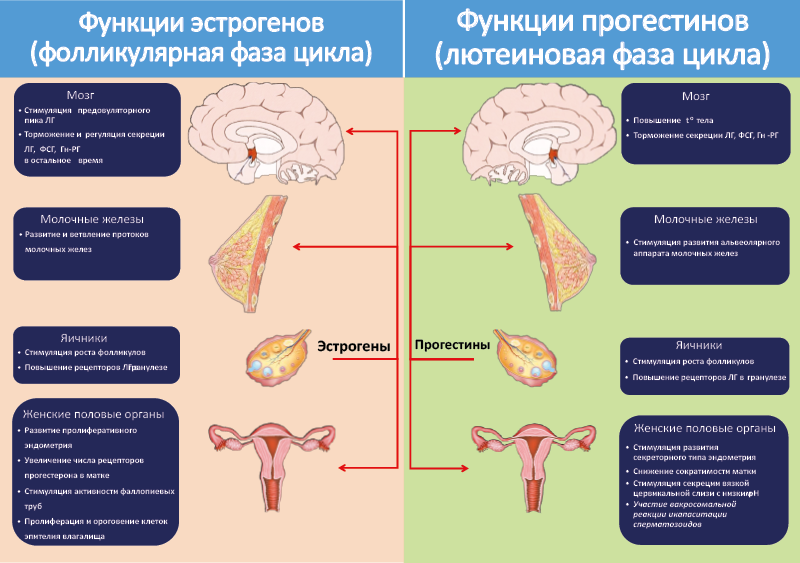
Рис. 54. Функции женских половых гормонов в различные фазы цикла
После овуляции клетки теки и гранулезы разорвавшегося фолликула под действием ЛГ превращаются в лютеоциты и развивается желтое тело, секретирующее главным образом прогестерон. Прогестерон готовит организм женской особи к беременности: действуя на матку, стимулирует развитие желез эндометрия, выделяющих важный для имплантации зародыша секрет (секреторная фаза маточного цикла), вызывает появление складок на поверхности эндометрия, снижает сократимость миометрия, во влагалище стимулирует секрецию вязкой слизи с низким рН. Все это способствует имплантации зародыша в матку, если произошло оплодотворение. Прогестерон готовит также молочные железы к беременности, усиливая развитие их альвеолярного аппарата. Кроме того, прогестерон облегчает оплодотворение яйцеклетки, участвуя в акросомальной реакции и капаситации сперматозоидов (рис. 54). Если оплодотворения не происходит, под действием сигнальных соединений, продуцируемых маткой, желтое тело инволюирует, секреция прогестерона снижается и половой цикл заканчивается. У человека этот процесс сопровождается отторжением эндометрия и кровотечением (менструацией).
Гормональная регуляция беременности
После выхода в полость тела яйцеклетка захватывается яйцеводом. Окситоцин влияет на сократимость яйцеводов и продвижение яйцеклетки и сперматозоидов навстречу друг другу. Оплодотворение происходит в верхней трети яйцевода. При дальнейшем продвижении в матку зародыш достигает стадии бластоцисты, секретирующей хорионический гонадотропин (ХГч82). ХГч поддерживает функции желтого тела, которое в таком случае не инволюирует, а становится желтым телом беременности (ЖТ) и функционирует у человека первые 8–12 недель. Кроме того, этот гормон способствует образованию децидуомы матки (материнской части плаценты). На стадии бластоцисты зародыш внедряется в матку.
Желтое тело во время беременности осуществляет следующие функции:
- секреция прогестерона и эстрогенов;
- прогестерон +ХГч-опосредованные функции:
– имплантация бластоцисты;
– развитие материнской части плаценты;
- прогестерон-опосредованные функции:
– подавление овуляции;
– снижение сократимости миометрия.
После развития плаценты желтое тело прекращает функционировать. Соотношение длительности жизни желтого тела и плаценты при беременности у разных видов млекопитающих варьируется: от преобладания работы желтого тела83 до преобладания работы плаценты84 (человек).
Плацента продуцирует разнообразные гормоны. ХГч и плацентарный лактоген, являются специфичными для этой ткани85. Остальные (эстрогены, прогестерон, СТГ, пролактин, кортиколиберин, АКТГ и др. (см. Приложение 1) синтезируются также в эндокринных железах и клетках. Продукция гормонов плацентой обычно увеличивается прямо пропорционально ее массе. При беременности особенно возрастет продукция эстриола.
Поскольку ХГч начинает продуцироваться еще бластоцистой, его определение используют для диагностики начала беременности. Он поддерживает работу желтого тела (в т. ч. биосинтез в нем прогестерона), стимулирует биосинтез неактивных андрогенов надпочечниками плода, необходимых для образования эстрогенов при беременности (см. ниже). Плацентарный лактоген участвует в регуляции роста плода и его метаболического обеспечения. Основные функции этих и других белково-пептидных гормонов плаценты представлены на вставке в конце раздела.
Во время беременности прогестерон сначала вырабатывается желтым телом, затем плацентой. Прогестерон является основным гормоном, поддерживающим беременность за счет участия в развитии плаценты, в подготовке к лактации молочных желез, за счет подавления продукции сигнальных соединений, вызывающих сокращение матки (в частности простагландинов), снижения чувствительности матки к окситоцину и других функций.
Биосинтез эстрогенов при беременности осуществляется фето-плацентарной системой, т.е. в биосинтезе участвует с одной стороны кора надпочечников и печень плода, а с другой – плацента. У плода сильно развита эмбриональная сетчатая зона коры надпочечников, в большом количестве продуцирующая неактивные андрогены, в частности дегидроэпиандростерон (ДГЭА) и его сульфат (ДГЭА-С) (рис. 55).
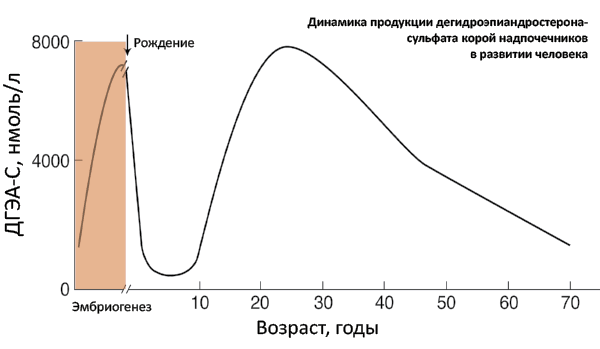
Рис. 55. Динамика продукции ДГЭА-Скорой надпочечников в развитии человека. Выделен период до родов
В плаценте отсутствуют ферменты, необходимые для биосинтеза андрогенов, поэтому для синтеза эстрогенов она использует андрогены, вырабатываемые надпочечниками плода и поступающими от него в плаценту. В биосинтезе эстриола участвуют не только надпочечники, но и печень плода, где происходит гидроксилирование андрогенов, необходимое для образования эстриола в плаценте (рис. 56).
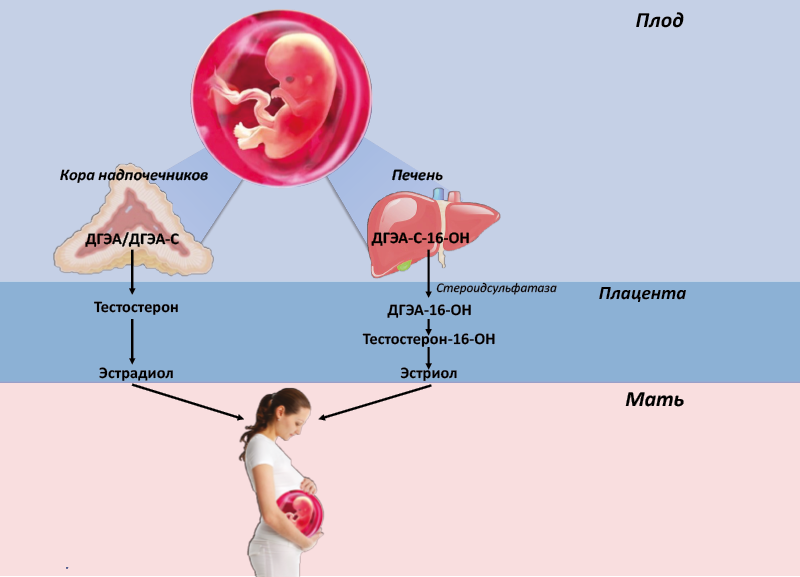
Рис. 56. Фето-плацентарная система биосинтеза эстрогенов
Рост продукции эстрогенов важен для поддержания беременности, причем особенно важно поддержание соотношения растущих прогестинов и эстрогенов. Роль эстрогенов при беременности заключается в:
- повышении чувствительности матки к действию прогестерона;
- стимуляции пролиферации миометрия
- подготовке матки к родам (антагонисты прогестерона);
- препятствии началу лактации (антагонисты пролактина);
- стимуляции развития протокового аппарата молочных желез.
Регуляция родовой деятельности
Сигнал к началу родовой деятельности поступает от плода и связан с активацией его кортикотопной оси (рис. 57). Повышение в крови уровня кортиколиберина и кортизола прекращает инактивацию биосинтеза простагландинов в плаценте, приводя к повышению их концентрации.
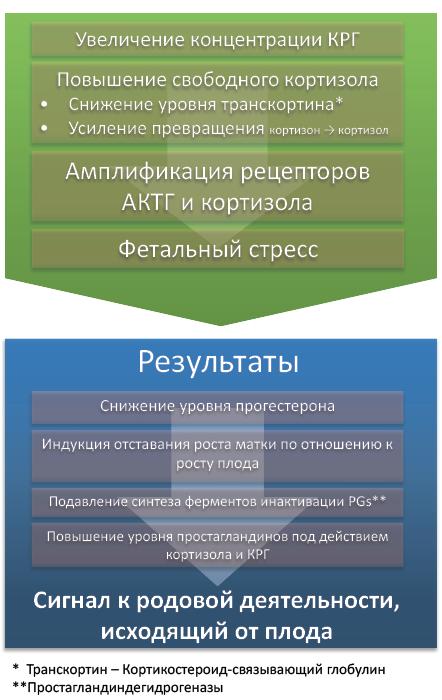
* Транскортин – кортикостероидсвязывающий глобулин.
** Простагландиндегидрогеназ Pgs(простагландинов)
Рис. 57. Предродовая активация кортикотропной оси плода
Простагландин F2α стимулирует сокращения матки и повышает в ней уровень рецепторов к окситоцину. Данные процессы сопровождаются ростом продукции окситоцина и его рецепторов в матке, что наряду с простагландинами стимулирует сокращения матки. Рост продукции релаксина вызывает лизис лонного сочленения и расслабление связок малого таза. Перечисленные выше изменения и фетальный стресс, возникающий из-за отставания роста матки от роста плода, способствует выходу плода из родовых путей (рис. 58).
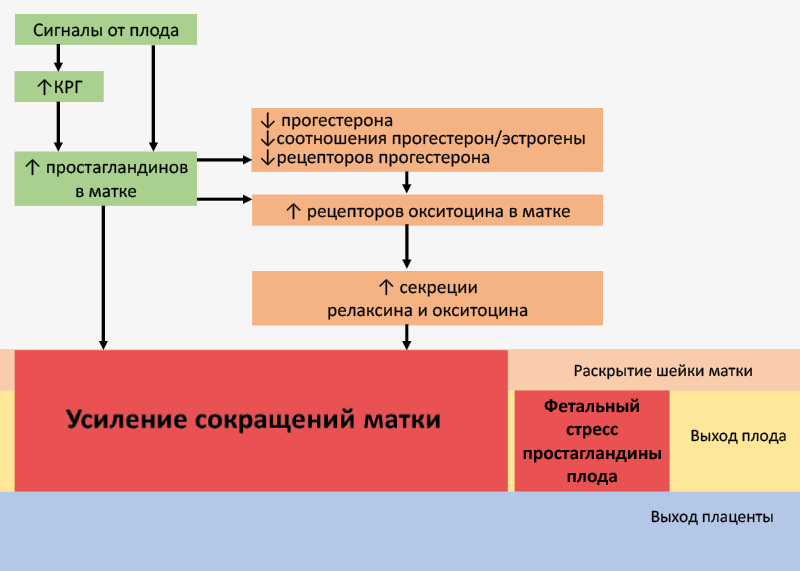
Рис. 58. Гормональная регуляция родового акта
Регуляция лактации
Процессы продукции и эвакуации молока молочными железами после родов регулируются разными группами гормонов. Главным регулятором продукции компонентов молока является пролактин, его действие усиливается глюкокортикоидами, СТГ и инсулином. Регулятором выделения молока из железы является окситоцин. У кормящих матерей окситоцин секретируется рефлекторно в ответ на акт сосания, стимулирует сокращение протоков молочной железы, вызывая эвакуацию молока.
Препараты гонадолиберинов (напр. ЛС Госерелин) используются при лечении гормонально-зависимых опухолей. В норме секреция гонадолиберинов носит пульсирующий характер. Это позволяет добиться оптимальной секреции гонадотропинов и сохранить чувствительность гонадотрофов гипофиза к Гн-РГ.
Введение препарата гонадолиберина создаёт стабильно высокую концентрацию гонадолиберина в крови. Из-за этого сразу после введения ЛС происходит активация гонадотропной оси и увеличение синтеза половых гормонов, затем сменяющееся десенсетизацией гонадотрофов гипофиза и угнетением оси. Для лечения гормонально-зависимых опухолей также используются препараты, нарушающие превращение андрогенов в эстрогены (ЛС Анастрозол, Летрозол) или блокаторы рецепторов соответствующих гормонов:
• Рецепторы андрогенов – Флутамид
• Рецепторы эстрогенов – Тамоксифен
Блокатор рецепторов прогестерона Мефипрестон используется для прерывания беременности в первом триместре.
Хотя и тестостерон, и 5αDHT действуют через андрогенные рецепторы, их эффекты принципиально отличаются (анаболические у тестостерона и андрогенные у 5αDHT). Это объясняется различием кофакторов, связывающихся с комплексом рецептор-лиганд, и, следовательно, различием активируемых генов. Именно благодаря тропности кофакторов к определенным химическим структурам, модификация молекулы тестостерона позволила синтезировать препараты, обладающие либо андрогенными (дростанолон, местеролон), либо анаболическими свойствами (нандралон, оксандралон).
Для лечения андрогензависимых заболеваний (напр. гиперплазии предстательной железы или алопеции (облысения)) используются препараты, нарушающие образование из тестостерона высокоандрогенного 5αDHT – напр. Финастерид. Также используются препараты прогестинов, угнетающих секрецию эндогенного тестостерона за счёт стимуляции выделения пролактина (подавляет серкрецию гонадотропинов, в т.ч. ЛГ).
С дефицитом жировой ткани (и, следовательно, лептина) связывают позднее начало менструаций у девушек при анорексии.
Гипрепролактинемия может приводить к мужскому и женскому бесплодию, угнетая функцию гонад. Так как секреция пролактина контролируется тормозным действием дофамина через D2- рецепторы (сопряжены с Gi-белками), для лечения таких форм бесплодия применяют D2-агонисты – Бромокриптин, Каберголин
и Хинаголид (в порядке увеличения селективности подавления пролактина). Бромокриптин также способен угнетать секрецию СТГ.
Основная функция бластоцисты – выделение хорионического гонадотропина, который предотвращает инволюцию жёлтого тела и индуциует образование децидуомы. Однако ХГч и плацентарный лактоген также являются маркерами опухолевых образований плаценты— хориокарцином. Эти опухоли могут обнаруживаться не только у матери, но и у плода (причем даже во взрослом возрасте), из-за способности опухолевых клеток проникать в зародыш. Важная особенность хориокарцином — хороший ответ на химиотерапию даже на поздних стадиях.
Функции белково-пептидных гормонов плаценты
ХГч
• Стимуляция стероидогенеза в ЖТ, затем в плаценте
• Стимуляция синтеза ДГЭА в надпочечниках плода ХСМ* и СТГ
• Плод (рост и созревание)
• Секреция инсулина и ИФР-2
• Мать
• Мобилизация аминокислот
• Гипергликемия
• Подготовка к лактации
Пролактин
• Регуляция объема и ионного состава амниотической жидкости
• Поддержание иммунотолерантности матери к плоду
• Регуляция перехода на легочное дыхание
• Синтез сурфактанта (совм. с глюкокортикоидами)
• Снижение сократимости миометрия
КРГ
• Повышение синтеза простагландинов
• Стимуляция родовой деятельности
АКТГ
• Независимое усиление синтеза и секреции кортизола
ТТГ
• Независимое усиление синтеза и секреции Т3 и Т4
Ингибин
• Подавление секреции ФСГ *ХСМ – лактосоматотропин, сочетает функции пролактина и СТГ
ХГч применяют для заместительной терапии при гипогонадотропном гипогонадизме (возникает при дефиците гипофизарных гонадотропных гормонов), так как он сочетает в себе функции ЛГ и ФСГ. Также ХГч используется для поддержания активности гонадотропной оси при длительном лечении угнетающими её препаратами – глюкокортикоидами, половыми или андрогенно-анаболическими стероидами.
Функции прогестинов при беременности
• Облегчение имплантации (совм. с эстрогенами и ХГч)
• Подавление овуляции
• Влияние на матку
• Развитие плаценты
• Снижение сократимости миометрия
• Снижение чувствительности к окситоцину
• Снижение концентрации PG
Рекомендуемая литература
1. Briffa J.F., McAinch A.J., Romano T., Wlodek M.E., Hryciw D.H. // Leptin in pregnancy and development: a contributor to adulthood disease? // Am J Physiol Endocrinol Metab. – 2015. – 308 (5): E335-50.
2. Carrie B., Bremner W.J. // Androgens in Health and Disease Humana Press2003. – P. 460. ISBN: 9781588290298, 1588290298
3. Cole L.A. // Biological functions of hCG and hCG-related molecules. – Reprod Biol Endocrinol. – 2010. – 8:102.
4. Costa M.A. // The endocrine function of human placenta: an overview. – Reprod Biomed Online. – 2016-32 (1):14–43.
5. Crowley WR1. Neuroendocrine regulation of lactation and milk production. – Compr Physiol. 2015 5 (1):255-91.
6. Escott G.M., da Rosa L.A., Loss Eda S. // Mechanisms of hormonal regulation of sertoli cell development and proliferation: a key process for spermatogenesis. Curr Mol Pharmacol. 2014. – 7 (2): 96–108.
7. Filicori M. // Clinical roles and applications of progesterone in reproductive medicine: an overview. – Acta Obstet Gynecol Scand. 2015 Nov;94 Suppl 161:3-7.
8. Fournier T., Guibourdenche J, Evain-Brion D.//hCGs: different sources of production, different glycoforms and functions. – Placenta. – 2015. – Suppl. – 1:S60-5.
9. Fowden A.L., Forhead AJ, Sferruzzi-Perri AN, Burton GJ, Vaughan OR.//Endocrine regulation of placental phenotype. – Placenta. – 2015-36. – Suppl/-1:S50-9.
10. Fowden A.L., Forhead AJ. // Endocrine regulation of feto-placental growth.– Horm Res. 2009.– 72 (5): 257-65.
11. Genazzani A.R., Tarlatzis B.C. // Frontiers in Gynecological Endocrinology: Volume 3: Ovarian Function and Reproduction – From Needs to Possibilities. – 2015. – Springer. – P.207. – ISBN: 3319238647, 9783319238647
12. Geraghty A.C., Kaufer D. // Glucocorticoid Regulation of Reproduction.– Adv Exp Med Biol. 2015/-872:253-78.
13. Kumar S.S. // Mammalian endocrinology and male reproductive biology. – 2016 CRC Press. – P.331. – ISBN: 978-1-4987-2736-5, 1498727360
14. O’Shaughnessy P.J. // Hormonal control of germ cell development and spermatogenesis. – Semin Cell Dev Biol. 2014-29:55-65.
15. Palmeri R., Grimaudo S.//Estradiol: Synthesis, Health Effects and Drug Interactions.– 2013.– Nova Science Pub Inc.– P. 304.– ISBN: 1628089628, 9781628089622.
66 Клетки семенников, участвуют в синтезе андрогенов.
67 Клетки семенников, участвуют в ароматизации эстрогенов.
68 Атом углерода.
69 В некоторых органах-мишенях.
70 Хорионический Гонадотропин человека.
71 Составной компонент фолликула яичника.
72 В сравнении с тестостероном.
73 Внешних и внутренних половых органов.
74 ДГЭА.
75 ДГЭА-С.
76 В течение светового дня.
77 У низших позвоночных.
78 Продолжительность светового дня не используется для подавления размножения.
79 У животных наблюдаются: поиски самца, реакция на феромоны, лордозная поза, изменение окраски кожных покровов, фенотипа внешних половых органов, полового поведения и т.д.
80 У животных наблюдаются закрытие или заращение влагалища и т.д.
81 Эпителиальная выстилка полости матки.
82 Хорионический Гонадотропин человека.
83 Коза, кролик.
84 А также овца.
85 Во время беременности.

