14.1. Формальные кинетические уравнения
Получим кинетические уравнения, описывающие реакции разного порядка. В реакциях нулевого порядка скорость реакции не зависит от концентрации: u = –dCi/dt = kCi. Зависимость концентрации компонента реакции от времени имеет вид: Ci(t) = Cio – kt, Cio — концентрация компонента реакции в начальный момент.
Для односторонних реакций первого порядка А → продукты: u = –dC/dt = k × C, c = Coe–kt. c — концентрация А в момент времени t (сек). Если m (моль/л) — количество вещества А, прореагировавшее в единице объема к моменту времени t, то m = Cо[1–exp(–kt)].
Полученное уравнение описывает, например, радиоактивный распад. Отметим, что при описании радиоактивного распада вещества пользуются понятием периода полураспада, т. е. времени, в течение которого претерпевает превращение половина исходного вещества. Пусть τ — время полураспада, тогда концентрация вещества к этому моменту времени C(τ) = 0,5Co; 0,5С0 = Co×exp(–kτ). τ = ln2/k. Например, время полураспада плутония 238Pu, τ = 86 лет, иода 131I 8 суток. Легко показать, что время, в течение которого концентрация А изменяется в n раз равно: τ1/n = (2,3/k)lg(n), среднее время жизни молекулы, которая подвержена распаду τ = 1/k.
Для двусторонней реакции первого порядка А1 ⇔ А2 (k1 — константа скорости прямой реакции, k2 — константа скорости обратной реакции) зависимость концентрации от времени для одного из компонентов можно получить из уравнения:
dCi/dt = k1C1 – k2C2
Чтобы проинтегрировать полученное уравнение надо исключить одну из переменных. Пусть начальные концентрации компонентов А1 и А2 равны соответственно Cо1 и Cо2, а количество прореагировавшего А1 к моменту t будет х. Тогда C1 = Cо1 – х, C2 = Cо2 + х. dx/dt = (k1Co1 – k2Co2) – (k1 + k2) × x. Проинтегрировав полученное уравнение, получим зависимость концентрации компонента А как функцию времени.
Для реакций второго порядка кинетическое уравнение имеет вид: u = –dC/dt = kC2, 1/C = 1/Co + kt.
Отметим, что полученные формулы для расчета скорости реакции будут точными только для простых реакций. В случае сложного химического процесса имеет место одновременное протекание реакций разного порядка, поэтому кинетические уравнения, которые описывают реальные процессы, могут сильно отличаться от формальных кинетических уравнений, которые описывают, как правило, элементарные процессы. Как пример кинетического анализа природного процесса, рассмотрим кинетические модели растворения и кристаллизации твердых тел.
14.2. Кинетика растворения твердого тела
Растворение кристаллических веществ — это сложный, многостадийный процесс. Мы рассмотрим растворение твердого тела в предположении, что процесс протекает в две стадии: разрушение кристаллической решетки и выход ионов в тонкий слой насыщенного раствора у самой поверхности твердой фазы; вторая стадия — диффузия частиц из этого слоя в глубину раствора. Каждая стадия развивается со своей скоростью. Скорость всего процесса определяется скоростью самой медленной стадии, в нашем случае — это диффузия ионов из насыщенного раствора. Если кинетика процесса определяется диффузией, то говорят, что имеет место диффузная кинетика. Рассмотрим основные понятия диффузной кинетики. В основе диффузной кинетики лежат два уравнения, предложенные швейцарским физиком А. Фиком в 1855 г. Первое уравнение позволяет вычислить количество вещества dn, продиффундировавшего через поперечное сечение S-раствора:
dn = –(S × f × grad[m]) × dt
f — коэф. диффузии частицы,
grad[m] — градиет концентрации частиц в растворе.
Если нас интересует диффузия частиц в направлении оси OZ декартовой системы координат, то в отсутствии внешнего поля, grad[m] = dm/dz, dm — изменение концентрации компонента в направлении оси OZ. Считаем, что в слое переменной концентрации HL (рис. 14.1), концентрация вещества меняется плавно и имеет место равенство:
dm/dz = –(mo – m)/l = ∆m/l
где mo — концентрация вещества в насыщенном слое;
m — концентрация вещества на расстоянии l от слоя насыщенного раствора.
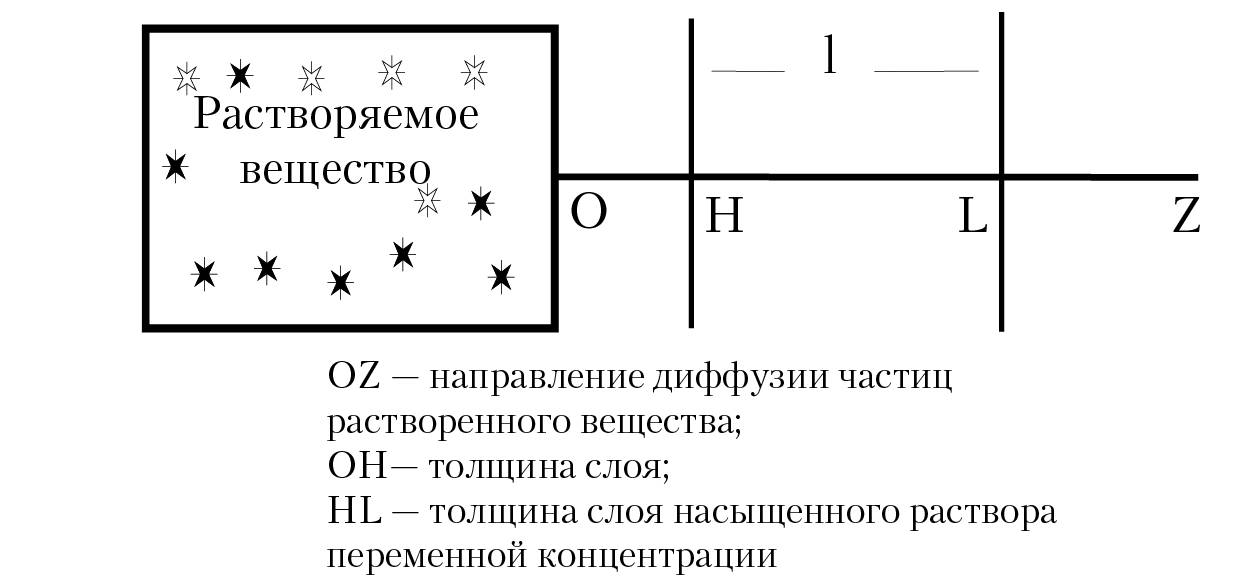
Рис. 14.1. Схема растворения вещества
Если V — объем раствора, тогда mo = no/V, m = n/V, no — число молей растворенного вещества в зоне насыщенного раствора, n — число молей растворенного вещества в слое переменной концентрации. Используя первое уравнение Фика, для скорости растворения вещества получим:
Допустим, что поверхность растворяемого кристалла изменяется медленно по сравнению с диффузией частиц. Тогда fS/lV = const = k и для скорости диффузии частиц в раствор получим:
dn/dt = k(no – n)
Так как при t = 0, n = 0, для числа молей растворенного вещества к моменту времени t, получим:
n = no[1 — exp(–kt)]
Формально получилось, что k = fS/lV — константа скорости реакции растворения твердой фазы.
14.3. Кинетика зарождения и роста кристаллов. Термодинамический и кинетический подходы к решению задачи
Образование кристаллов вещества из пересыщенного раствора связано с возникновением центров кристаллизации (ЦК) и последующим ростом и укрупнением кристаллов. Возникновение ЦК возможно только из так называемого метастабильного состояния раствора. Для образования ЦК должна быть совершена работа, связанная с возникновением границы раздела между фазами (раствор — ЦК) и переходом вещества из расплава в твердую фазу. Пусть µ1 — химический потенциал растворенного вещества в пересыщенном растворе, µ2 — химический потенциал вещества в твердой фазе (ЦК), σ — поверхностное натяжение на границе раствор — ЦК, S — площадь поверхности ЦК. Тогда изобарный потенциал образования ЦК, ∆G = –A (А — работа, которую надо затратить на образование ЦК) и ∆G = n(µ2 – µ1) + σ × S; n — число молей вещества в составе ЦК. Если V — объем ЦК, v — мольный объем вещества, тогда n = V/v. Считаем, что образующиеся ЦК имеют сферическую форму (в этом случае работа против сил поверхностного натяжения будет минимальна) и для изобарного потенциала образования ЦК получим:
∆G = 4/3 × πr3/v × ∆µ + 4πr2σ (14.1)
Легко показать, что минимальное значение изобарного потенциала образования ЦК имеет место при
r = –(2σv)/∆ µ (14.2)
Так как r > 0, образование центров кристаллизации возможно только при условии, что химический потенциал вещества в твердой фазе будет меньше химического потенциала вещества в пересыщенном растворе. Далее: полученное выражение для радиуса ЦК — это минимальный размер зародыша: самопроизвольное появление и рост частиц с радиусом, меньшем критического, невозможно, так как это вызвало бы увеличение изобарного потенциала процесса образования ЦК. Образование ЦК связано с работой, которая должна быть совершена молекулярными силами. Для равновесного процесса образования зародышей, величина работы будет равна (с обратным знаком) изобарному потенциалу образования зародышей. Подставляя значение радиуса зародыша (14.2) в (14.1), получим:
(14.3)
Данное значение изобарного потенциала образования ЦК можно трактовать как энергию активации химической реакции образования ЦК. Используя уравнение М. Фальмера, для вероятности возникновения ЦК получим:
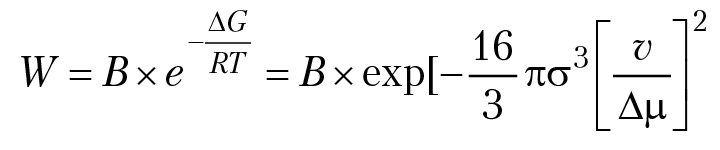
После того, как возникли ЦК, начинается рост кристалла. Кинетика роста кристаллов определяется скоростью диффузии растворенного вещества из области пересыщенного раствора к граням кристалла, где концентрация растворенного вещества несколько больше концентрации насыщенного раствора, но меньше концентрации пересыщенного раствора. Для вычисления скорости диффузии используем ранее рассмотренные уравнения Фика:
u1 = fS/L × ∆C1, u1 = k1 × ∆C1; ∆C1= cp – C
где Cp — концентрация раствора в зоне пересыщения;
c — концентрация раствора у грани кристалла;
L — толщина слоя переменной концентрации.
По Майеру и Марку, скорость перехода вещества из жидкой фазы в твердую равна:
u2 = k2×(∆C2)2
∆C2 = c — Cn; где Cn — концентрация насыщенного раствора.
Для установившегося процесса роста кристаллов u1 = u2. В относительно вязких растворах k2 > k1, k1/k2 ≅ 0, для скорости кристаллизации получим:
u = fS/L × (Cp – Cn)
Механизм кристаллизации вещества из расплава мало чем отличается от механизма кристаллизации вещества из пересыщенного раствора, хотя здесь есть свои особенности.
14.4. Кристаллизация вещества из расплава
Кристаллизация вещества из расплава должна сопровождаться уменьшением изобарного потенциала системы и связана с выделением тепла из системы. Как было показано выше, для изобарного потенциала образования зародышей (центров кристаллизации расплава) имеет место соотношение:
∆G = 4/3 × πr3/v × ∆µ + 4πr2σ
Для процесса кристаллизации из расплава ∆µ = Lk – T∆S; где Lk — теплота и энтропия кристаллизации соответственно. Так как ∆S = Lk/Tk, для ∆µ получим: ∆µ = ∆T × (Lk/Tk), ∆T = Tk – T. Tk — температура кристаллизации, T — температура расплава, ∆T — переохлаждение расплава; для изобарного потенциала образования кристаллов из расплава, получим:
∆G = –4/3 × πrr3 × Lk × ∆T/Tk + 4πrr2σ (14.1)
Минимальный размер зародыша при кристаллизации расплава:
rk = 2σTk/(Lk × ∆T)
σ — коэффициент поверхностного натяжения на границе кристалл-расплав при температуре расплава.
Отметим, что для образования кристаллов в переохлажденном расплаве, необходимо преодолеть энергетический барьер величиной ∆Gk. Этим объясняется относительная устойчивость переохлажденного состояния расплава (в частности, воды). Вблизи точки кристаллизации переохлажденное состояние расплава может оказаться достаточно устойчивым. Подставляя в выражение для изобарного потенциала образования кристаллов из расплава выражение для минимального радиуса зародыша, получим для энергетического барьера образования кристаллов выражение:
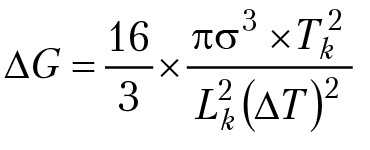
Процесс зарождения кристаллов подчиняется общим законам статистической физики, по которым вероятность перехода системы через энергетический барьер, равна:
W = C × exp(–∆G/kT) = c exp[–Bσ3/T(∆T)2]
гдк k — постоянная Больцмана, B = (16/3)(πT2k/k×Lk2).
Константа скорости зарождения и роста кристаллов w пропорциональна W и зависит от механизма роста кристаллов. Для каждого конкретного случая рассматривается своя модель процесса.

