12.1. Основные понятия и определение Eh — pН диаграмм
12.3. Электрохимическое разложение воды с выделением кислорода
12.4. Электрохимическое разложение воды с выделением водорода
12.5. Анализ Eh — pН диаграммы воды
12.6. Электрохимия в геологии. Поля устойчивости окислов и гидроокислов ванадия
12.7. Анализ ОВ реакций в координатах Р(О2) — рН
12.8. Зависимость параметров ОВ реакции от температуры и давления
12.1. Основные понятия и определение Eh — pН диаграмм
Пусть ОВ свойства раствора обусловлены присутствием в нем окисленной (Ox) и восстановленной (Red) формами элемента и пусть равновесие в растворе поддерживается в результате протекания реакции:
Ox + n × e + k × H+ = Red + (k/2) × H2O
Ox — окисленная форма элемента, Red — восстановленная форма элемента. Например, равновесие в растворе солей марганца поддерживается в результате полуреакции:
MnO4–+ 5e + 8H+ = Mn2+4H2O. MnO4– — окисленная форма марганца, Mn2+ — восстановленная. форма марганца. ОВ потенциал раствора вычислим по уравнению Нернста:
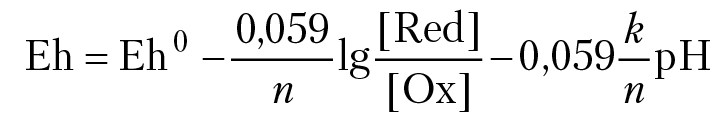
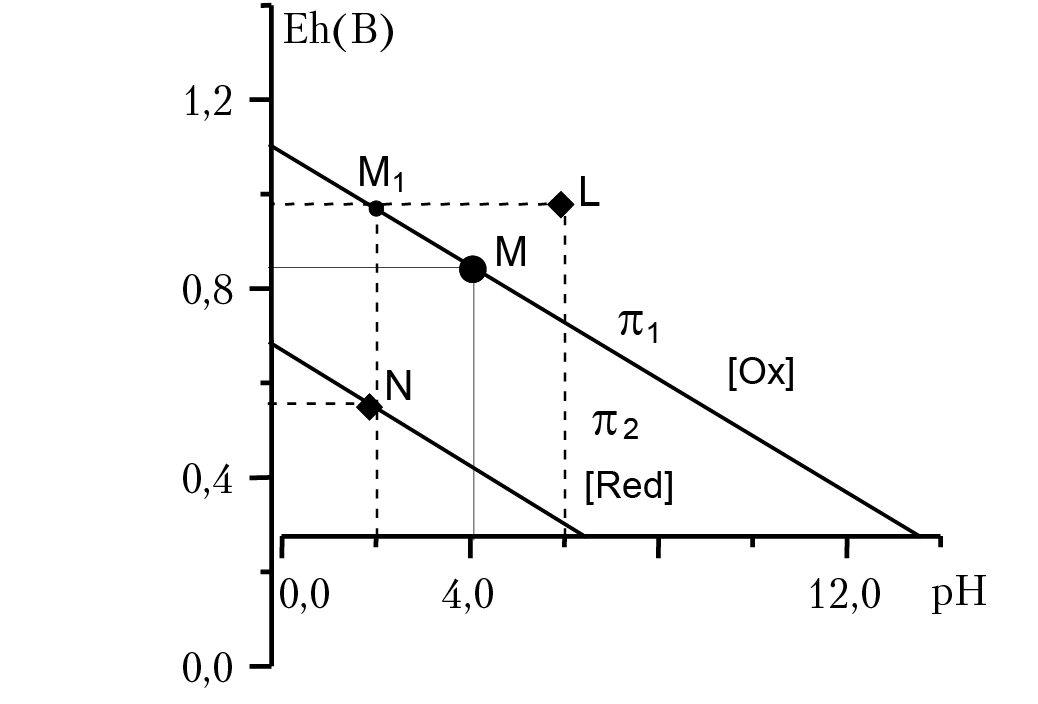
Рис. 12.1. Eh — pH диаграмма
Отметим важную особенность последнего уравнения: при изменении рН раствора, ОВ потенциал раствора Eh изменится таким образом, что отношение концентраций [Red]/[Ox] = const. В координатах Eh — pH построим график зависимости Eh = f(pH) (рис. 12.1). Это будет прямая линия, которая разделит плоскость на две полуплоскости: верхнюю полуплоскость π1 и нижнюю полуплоскость π2. Далее: каждой точке на плоскости (Eh, pH) соответствует конкретное значение ОВ потенциала и рН раствора. Например, точке М соответствует значение ОВ потенциала раствора 0,4 вольта и рН = 4. Говорят, что полуплоскость π1 есть поле устойчивости окисленной формы элемента, полуплоскость π2 — поле устойчивости восстановленной формы элемента. Уточним, что это означает. Пусть параметры раствора соответствуют точке М1. Если в раствор добавить восстановитель (донор электронов), то новые ОВ параметры раствора будут принадлежать нижней полуплоскости (например, точке N), так как добавление восстановителя может только уменьшить ОВ потенциал раствора. Новая Eh — pH диаграмма должна пройти через точку N; для этого необходимо, чтобы равновесие реакции Ox + ne + kH+ = Red + (k/2) × H2O сместилось вправо, концентрация [Red] возрастет, концентрация [Ox] — уменьшится. Значит, мы имеем право утверждать, что если в растворе будет протекать ОВ реакция, в результате которой установятся значения [Eh, pH] ⊂ π2, то концентрация [Red] не уменьшится. Этот факт и лежит в основе понятия, что полуплоскость π2 есть поле устойчивости компонента [Red]. Очевидно, что полуплоскость π1 есть поле устойчивости [Ox]. ОВ равновесие в растворах связано с протеканием конкретных ОВ реакций. Если для этих реакций записать уравнения Нернста и на одной и той же (Eh, pH) плоскости построить и разметить графики Eh = f(pH), соответствующие конкретным ОВ реакциям, то можно предсказать, в каком направлении будут протекать ОВ реакции при взаимодействии компонентов анализируемого раствора. В последующих разделах лекций мы разберем изложенный материал на конкретных примерах.
Мы изучаем ОВ реакции, которые протекают в воде. Что представляет собой вода с точки зрения электрохимических свойств. Какие электрохимические реакции характерны для воды?
1. Диссоциация воды. Н2О = Н++ ОН–. К = [Н+][ОН–] = 10–14 (298 °К). Процесс диссоциации воды обуславливает слабую электропроводность воды.
2. Электрохимическое разложение воды с выделением кислорода: 2Н2О – 4е = О2 + 4Н+.
3. Электрохимическое разложение воды с выделением водорода, 2Н2О + 2е = Н2 + 2ОН–.
Вычислим, при каких значениях Eh, pH среды возможно разложение воды, т. е. выделение кислорода или водорода. Решение данной задачи мы представим в виде Eh — pH диаграммы воды. Чтобы построить Eh — pH диаграмму имеет смысл придерживаться некоторой схемы построения Eh — pН диаграммы. Это означает:
1) записать уравнение ОВ полуреакции. Уравнение полуреакции надо записывать в сторону восстановления, т. е. электроны должны быть в левой части равенства и со знаком плюс;
2) записать уравнение Нернста для данной полуреакции;
3) на плоскости (Eh, pH) построить график зависимости Eh = f(pH);
4) разметить поля устойчивости компонентов полуреакции.
12.3. Электрохимическое разложение воды с выделением кислорода
Уравнение ОВ полуреакции: 1) О2 + 4е + 4Н+ = 2Н2О.
Уравнение Нернста:
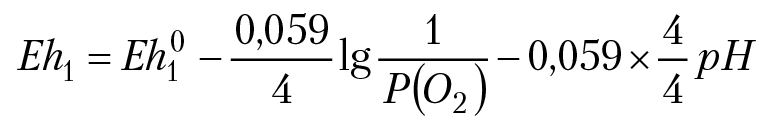
Максимальное давление кислорода на поверхности Земли не может превышать 1 бар. Следовательно, Eh1 = 1,228 – 0,059pH.
Полученное уравнение описывает ОВ равновесие (вода — газообразный кислород).
12.4. Электрохимическое разложение воды с выделением водорода
Уравнение ОВ полуреакции: 2Н2О + 2е = Н2 + 2ОН–. Так как Н2О = Н+ ОН–, исходное уравнение эквивалентно уравнению: 2) 2Н+ 2е = Н2.
Уравнение Нернста:
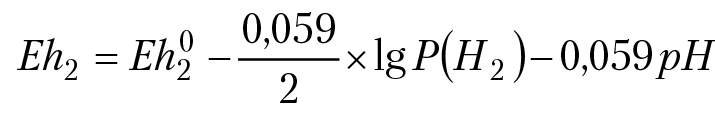
Учитывая, что давление водорода на поверхности Земли ≈ 10–5 бара, вторым слагаемым в уравнении Нернста можно пренебречь. Так как Eh02 = 0, получим: Eh2 = –0,059pH. Если на одной координатной плоскости построить графики зависимости Eh1 = f(pH) и Eh2 = f(pH) получим Eh — pН диаграмму воды, рис. 12.2.
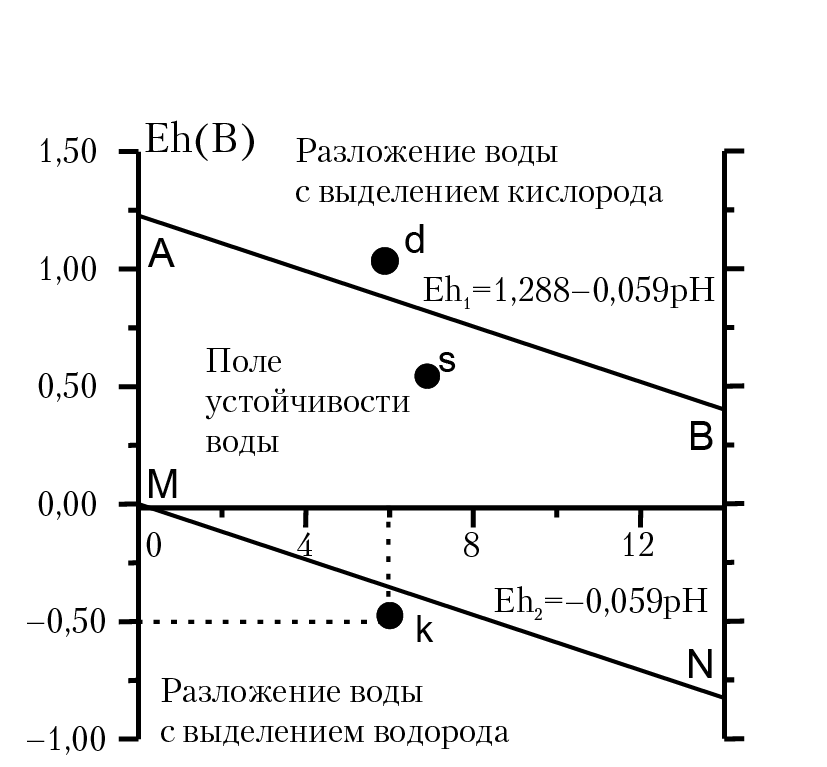
Рис. 12.2. Eh-pH диаграмма воды
12.5. Анализ Eh — pН диаграммы воды
Каждой точке на диаграмме соответствуют параметры внешней среды. В области между линиями AB и MN вода устойчива и имеет место только диссоциация воды:
Н2О = Н+ ОН–
Если электрохимические параметры среды соответствуют координате точки d [pH = 5, Eh = 1,13B, точка d лежит выше линии АВ] будет иметь место разложение воды с выделением кислорода:
Н2О – 4е = О2 + 4Н+
Если ОВ потенциал воды будет соответствовать точке k, вода будет разлагаться с выделением водорода.
Разложение воды с выделением кислорода будет иметь место, если мы подберем окислитель, ОВ потенциал которого будет выше ОВ потенциала полуреакции окисления воды О2 + 4е + 4Н+ = 2Н2О при соответствующим значении рН раствора. Это будет иметь место, если через воду прокачивать, например, газ F2;. ОВ потенциал полуреакции 0,5F2 + e = F–. EhF2 = +2,87B, так велик, что при любом рН раствора EhF2 > Eh1 т. е. в результате реакции:
2Н2О + 2F2 = O2 + 4H+ 4F–
будет иметь место разложение воды с выделением кислорода. Если электрохимические параметры среды соответствуют координате точки k [pH = 5, Eh = –0,5B, точка k лежит ниже линии MN] будет иметь место разложение воды с выделением водорода. Например, при реакции воды с металлическим натрием будет протекать ОВ реакция: 2Н2О + 2Na = H2 + 2Na+ 2OH– [разложения воды с выделением водорода].
12.6. Электрохимия в геологии. Поля устойчивости окислов и гидроокислов ванадия
Окислы и гидроокислы ванадия входят в состав природных синечерных руд, которые найдены в совокупности с урансодержащими минералами. Наша задача рассчитать, какая совокупность минералов ванадия может быть обнаружена в естественных условиях, если заданы Eh-pH параметры природных вод. Для решения задачи надо рассчитать поля устойчивости минералов в координатах [Eh-pH]. Состав системы: раствор + V(OH)2 + V(OH)3 + VO(OH)2 + V2O2 + V2O3 + V2O4. В состав системы входят соединения двухвалентного ванадия [V(OH)2, V2O2], трехвалентного ванадия [V(OH)3, V2O3], четырехвалентного ванадия [VO(OH)2, V2O4]. Так как все соединения ванадия плохо растворимые вещества, считаем, что насыщенные растворы ванадия — это разбавленные растворы. Условие равновесия между двухвалентными и трехвалентными соединениями ванадия найдем из анализа уравнения Нернста для полуреакции:
1) V3+ e = V2+, Eh1 = Eh01 – 0,059lg([V2+]/[V3+]).
V2+ и V3+ — продукты диссоциации гидроокисей ванадия. Считаем, что процесс растворения минералов заканчивается на стадии диссоциации твердой фазы. Вычислим равновесное отношение концентраций f1 = [V2+]/[V3+]. При равновесии,
V(OH)2 = V2+ 2OH–; ∆G°298= 87 914 (Дж/моль), рК = 15,4;
К = [V2+] × [OH–]2.
V(OH)3 =V3+3OH–, ∆G°298 = 196 761(Дж/моль), рК = 34,4;
К = [V3+] × [OH–]3.
Составим отношение:
[V2+][OH–]2 10–15,4
_________ = _____ = 1019.
[V3+][OH–]3 10–34,4
Вычислим:
f1 × f1 = 1019 × [OH–],
lgf1 = 19 + lg[OH–] = 19 + (pH – 14) = 5 + pH.
Eh1 = –0,255 – 0,059(5 + pH) = –0,55 – 0,059pH.
2) Равновесие между трех- и четырехвалентными соединениями ванадия:
VO2+ e + 2H+ = V3+ H2O,
Eh2 = Eh02 – 0,059lg([V3+]/[VO2+]) – 0,118pH.
VO(OH)2 = VO2+ 2OH–,
∆G°298 = 133 965 (Дж/моль); рК = 23,5.
К = [VO2+] × [OH–]2.
Таким образом, f2 = [V3+]/[VO2+] = 3,1 – pH,
Eh2 = Eh02 — 0,059lgf2 – 0,118pH = 0,361 — 0,059(3,1 – pH) = 0,178 — 0,059pH.

Рис. 12.3. Eh-pH диаграмма соединений ванадия
3) Равновесие между двух- и трехвалентными соединениями ванадия: V3+ e = V2+, Eh3 = –0,55 – 0,059pH.
4) Равновесие между трех- и четырехвалентными соединениями ванадия: VO2+ e + 2H+ = V3+ H2O, Eh2 = 0,178 – 0,059pH.
В координатах [Eh, pH] построим графики функций Eh1 и Eh2, (рис. 12.3). Для полноты картины дополнительно построен график функции Eh = –0,059pH (нижняя граница устойчивости воды).
Анализ Eh-pH диаграммы окислов и гидроокислов ванадия. Так как поле устойчивости окиси V2O2 и гидроокиси V(OH)2 двухвалентного ванадия лежит за пределами нижней границы устойчивости воды, их равновесие с природными водами невозможно. Поле устойчивости трехвалентных соединений ванадия [V2O3(монтрозеит), V(OH)3] (см. рис. 12.3), расположено в узкой области между прямыми: Eh2 = 0,178 – 0,059pH и Eh = –0,059pH. Поле устойчивости четырехвалентных соединений ванадия располагается выше прямой Eh2 = 0,178 — 0,059pH.
Задача. Показать, что невозможно равновесие в одних и тех же природных водах шестивалентных соединений урана и трехвалентных соединений ванадия.
Примечание. Записать условие ОВ равновесия для системы {UO2(OH)2/ UO2} и {VO(OH)2/V(OH)3} и построить Eh-pH диаграммы минералов.
12.7. Анализ ОВ реакций в координатах Р(О2) — рН
Вернемся к полуреации 4Н+ 4е + О2 = 2Н2О, которая описывает ОВ равновесие воды с кислородом. Уравнение Нернста для данной полуреакции имеет вид: Eh = Eh0 + (0,059/4)lgP(O2) – 0,059pH. Анализ уравнения показывает, что равновесие воды с кислородом зависит от трех параметров: Eh (ОВ потенциал раствора), Р(О2) — давление кислорода в системе и pH = –lg[H+]. Очевидно, что любой из этих трех параметров может быть выражен через два других с помощью уравнения Нернста. Обычно в качестве независимых параметров выбирают легко измеряемые при стандартных условиях переменные Eh и рН. Однако при повышенных температурах и давлениях удобнее анализировать ОВ процессы в гидротермальных растворах в переменных Р(О2) — рН. Способ расчета ОВ свойств раствора в координах lgP(O2) — pH разберем на примере реакции гидротермального образования пирита за счет пирротина в присутствии сероводорода и кислорода: FeS + 2H+ + S2– + 0,5O2 = FeS2 + H2O.
При равновесии (уравнение Вант-Гоффа):
.png) (12.1)
(12.1)
.png) (12.2)
(12.2)
Полученное уравнение описывает ОВ равновесие между пиритом и пирротином в растворе в присутствии сероводорода и кислорода. Недостаток полученного уравнения — узкий диапазон изменения рН, так как заметная концентрация сульфид иона [S2–] имеет место при рН > 13. Чтобы иметь возножность анализировать равновесие [пирит/пирротин] во всем интервале изменения рН надо выразить концентрацию сульфид иона через давление сероводорода в системе. Это можно сделать по обычной схеме:
H2S = H2S0, K1 = ([H2S0]/P(H2S) = exp[–∆G1(P,T)],
H2S0 = HS– + H+, K2 = ([HS–] × [H+]/[H2S0]) = exp[–∆G2(P,T)],
HS– = S2–+ H+, K3 = ([S2–] × [H+])/[HS–] = exp[–∆G3(P,T)];
lg[S2–] = lg(K1K2K3) + lgPH2S + 2pH.
После подстановки полученного выражения для концентрации сульфид-иона в уравнение (12.2) для описания равновесия в системе пирит/пирротин получим:
lgPO2 = K0 – 2lgPH2S
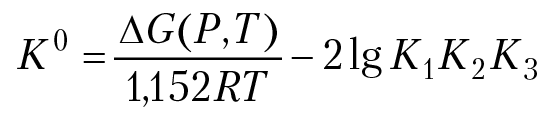
При анализе нескольких, одновременно протекающих процессов, надо построить набор диаграмм в координатах Р(О2) — рН и провести их анализ так, как это было сделано для Eh-pH диаграмм. Чтобы перевести уравнение Eh = f(pH) в координаты lg(PO2) = f(pH) надо решить уравнение
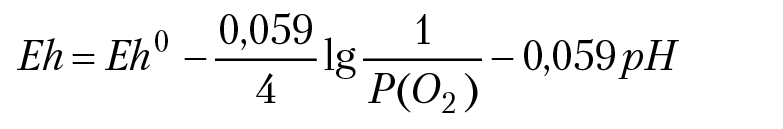
относительно lgP(O2) и подставить вместо Eh его значение для пересчитываемой полуреакции.
12.8. Зависимость параметров ОВ реакции от температуры и давления
Зависимость параметров ОВ реакции от температуры и давления может быть найдена из анализа изобарного потенциала реакции. С другой стороны, анализ ОВ реакции наиболее полно можно сделать с помощью уравнения Нернста и Eh-pH диаграммы. Получим зависимость уравнения Нернста от температуры и давления. Пусть ОВП раствора определяется полуреакцией
Red + ne + kH+ = Ox + k/2 H2O
Тогда ОВП раствора относительно стандартного водородного электрода будет равен:
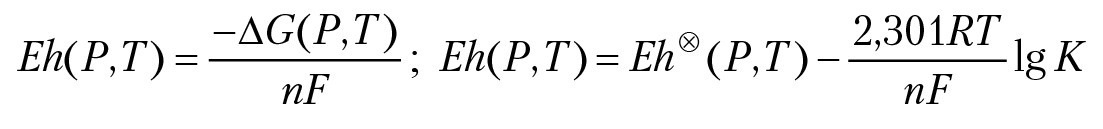
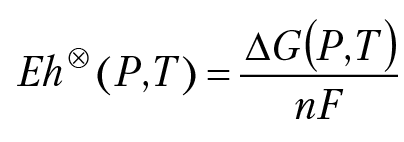
— ОВ потенциал раствора, измеренный относительно стандартного водородного электрода сравнения при концентрациях (или активностях) компонентов раствора и газовой фазы равных единице.
∆G(P,T) — изобарный потенциал ОВ реакции при тех же условиях:
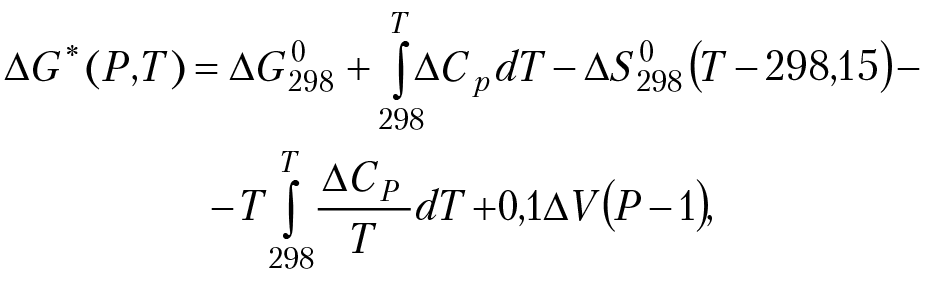
∆G0298 (Дж/моль) — стандартный изобарный потенциал ОВ реакции;
∆V[см3/моль] — мольный объем реакции;
∆Ср = ∆a + ∆b × T – (∆c/T2) теплоемкость реакции.
Задача 12.2. Построить поля устойчивости магнетита Fe3O4 и сидерита FeCO3 в координатах Eh-pH для системы, находящейся в равновесии с атмосферным углекислым газом СО2 (РСО2 = 3 × 10–4 бар) и при t = 95 °С.
Решение: запишем полуреакцию восстановления магнетита до сидерита в присутствии углекислого газа:
Fe3O4 +2e +2H+ 3CO2 = 3FeCO3 + H2O
Запишем уравнение Нернста для полуреакции:
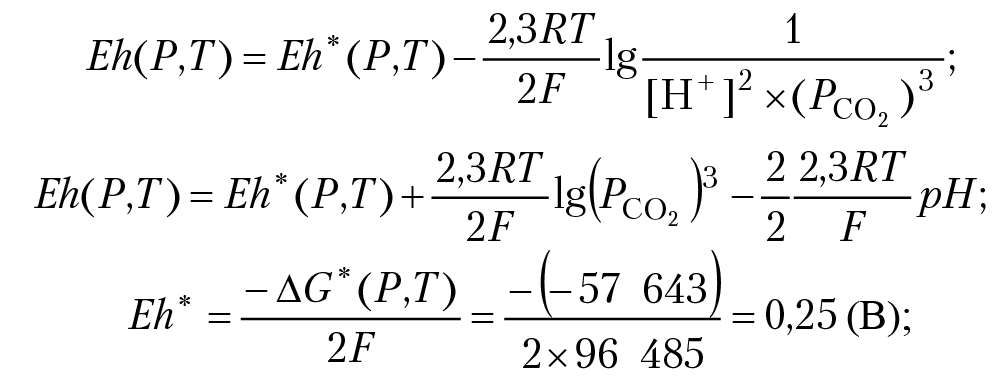
Eh = 0,25 + (–0,13) – 0,073pH;
Eh = 0,12 – 0,073pH.
Используя полученное уравнение Нернста Eh = 0,12 –0,073pH строим Eh-pH диаграмму (рис. 12.4).
Анализ Eh-pH диаграммы. Выше линии равновесия распологается поле устойчивости магнетита Fe3O4. Это означает, что в растворах с Eh и pH выше линии равновесия (например, в точке а (Eh = 0,1B и рН = 3) магнетит будет только растворятся и никаких ОВ превращений не будет иметь место. Ниже линии равновесия будет поле устойчивости сидерита FeCO3.
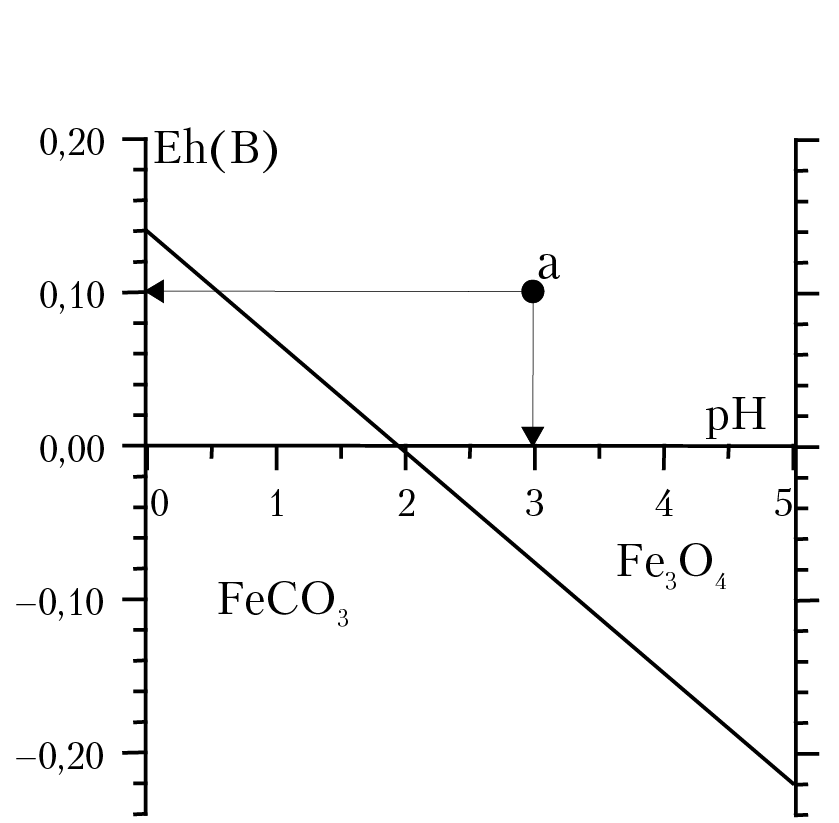
Рис. 12.4. Поля устойчивости магнетита и сидерита

